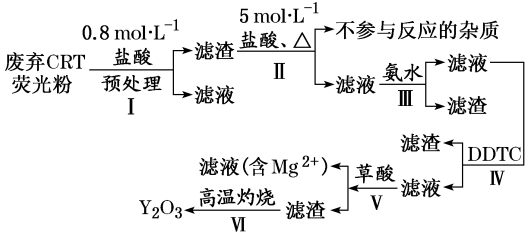
为除去粗盐中的Ca2+. Mg2+. SO42-以及泥沙等杂质,某同学设计了一种制备精盐的实验方案,步骤如下(用于沉淀的试剂稍过量)
(1)第④步中,写出相应的离子方程式(设粗盐溶液中Ca2+的主要存在形式为CaCl2)_______________ ;____________ 。
(2)实验方案的(1)中应使用除杂试剂的化学式__________ ,发生的离子方程式是__________ ,在实验方案的(2)中的操作名称是_______ 。
(3)从实验设计方案优化的角度分析步骤②和④可否颠倒____________ (填“是”或“否”,如果“否”,请说明理由。___________________________________________ ;
(4)判断BaCl2已过量的方法是_________________________________________________ 。
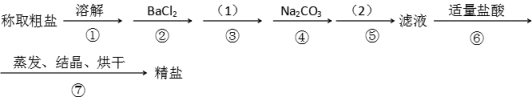
(1)第④步中,写出相应的离子方程式(设粗盐溶液中Ca2+的主要存在形式为CaCl2)
(2)实验方案的(1)中应使用除杂试剂的化学式
(3)从实验设计方案优化的角度分析步骤②和④可否颠倒
(4)判断BaCl2已过量的方法是
更新时间:2018-12-31 15:58:22
|
相似题推荐
【推荐1】海水中除了氢、氧元素,还含氯、钠、镁、硫、钙、钾、溴等元素,资源丰富。某校实验小组在实验室里模拟从浓缩的海水中提取镁、溴及食盐等资源,主要流程如下图。

请回答下列问题:
(1)步骤Ⅰ中用到的主要玻璃仪器有___________ 、烧杯、玻璃棒等。
(2)海水提取镁的主要步骤中___________ (填“有”或“没有”)涉及氧化还原反应。
(3)步骤Ⅱ制取食盐的过程中要除去海水中 和
和 (不考虑其他杂质离子),实验中需要依次使用
(不考虑其他杂质离子),实验中需要依次使用___________ (填相关物质的化学式)等沉淀剂。有同学认为只用 溶液即可同时完全除去
溶液即可同时完全除去 和
和 两种离子。请你判断该说法是否合理,并说明理由
两种离子。请你判断该说法是否合理,并说明理由___________ 。
(4)制得的食盐可用来制备 ,作为海水提取
,作为海水提取 的原料,涉及如下反应,请配平及完成相关反应。
的原料,涉及如下反应,请配平及完成相关反应。
①主反应:_____ ___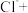 ___H2O
___H2O ___
___ ___
___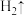 +___;
+___;
②副反应:_____ ___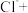 ___H2O
___H2O ___
___ ___
___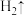 ,该副反应的发生将不利于
,该副反应的发生将不利于 的制备,因此需要控制电解反应的条件。
的制备,因此需要控制电解反应的条件。
(5)步骤Ⅲ中的主要离子反应方程式为___________ 。
(6)结合海水提取 的相关反应,试比较氧化性
的相关反应,试比较氧化性
___________  (填“大于”或“小于”)。
(填“大于”或“小于”)。

请回答下列问题:
(1)步骤Ⅰ中用到的主要玻璃仪器有
(2)海水提取镁的主要步骤中
(3)步骤Ⅱ制取食盐的过程中要除去海水中
 和
和 (不考虑其他杂质离子),实验中需要依次使用
(不考虑其他杂质离子),实验中需要依次使用 溶液即可同时完全除去
溶液即可同时完全除去 和
和 两种离子。请你判断该说法是否合理,并说明理由
两种离子。请你判断该说法是否合理,并说明理由(4)制得的食盐可用来制备
 ,作为海水提取
,作为海水提取 的原料,涉及如下反应,请配平及完成相关反应。
的原料,涉及如下反应,请配平及完成相关反应。①主反应:
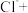 ___H2O
___H2O ___
___ ___
___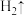 +___;
+___;②副反应:
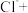 ___H2O
___H2O ___
___ ___
___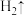 ,该副反应的发生将不利于
,该副反应的发生将不利于 的制备,因此需要控制电解反应的条件。
的制备,因此需要控制电解反应的条件。(5)步骤Ⅲ中的主要离子反应方程式为
(6)结合海水提取
 的相关反应,试比较氧化性
的相关反应,试比较氧化性
 (填“大于”或“小于”)。
(填“大于”或“小于”)。
您最近一年使用:0次
填空题
|
适中
(0.65)
解题方法
【推荐2】无水氯化亚铁为黄绿色吸湿性晶体,溶于水后形成浅绿色溶液。
(1)氯化亚铁的水溶液呈___________ 性,原因为___________ (用离子反应方程式表示)。
(2)粗制 MgCl2晶体中常含有杂质Fe2+,提纯时为了除去Fe2+,常加入合适氧化剂,使Fe2+转化为Fe3+,下列物质最好采用的是___________ (填序号)。若溶液呈强酸性,则转化的离子反应方程式为___________ 。
A.KMnO4 B.H2O2 C.HNO3 D.Na2O2
(3)然后再加入适当物质调节溶液pH,可以达到除去Fe3+而不损失MgCl2的目的,调节溶液 pH可能选用的物质是___________ (填序号)。
A.Mg(OH)2 B.MgO C.NH3•H2O D.Mg2(OH)2CO3
(4)常温下,Ksp[Fe(OH)3]=8.0×10-38,要使Fe3+恰好沉淀完全,即溶液中c(Fe3+)=1.0×10﹣5 mol/L,此时溶液中c(H+)=___________ 。
(5)久置在空气中的氯化亚铁溶液,得到的新物质的化学式为___________ 。
(1)氯化亚铁的水溶液呈
(2)粗制 MgCl2晶体中常含有杂质Fe2+,提纯时为了除去Fe2+,常加入合适氧化剂,使Fe2+转化为Fe3+,下列物质最好采用的是
A.KMnO4 B.H2O2 C.HNO3 D.Na2O2
(3)然后再加入适当物质调节溶液pH,可以达到除去Fe3+而不损失MgCl2的目的,调节溶液 pH可能选用的物质是
A.Mg(OH)2 B.MgO C.NH3•H2O D.Mg2(OH)2CO3
(4)常温下,Ksp[Fe(OH)3]=8.0×10-38,要使Fe3+恰好沉淀完全,即溶液中c(Fe3+)=1.0×10﹣5 mol/L,此时溶液中c(H+)=
(5)久置在空气中的氯化亚铁溶液,得到的新物质的化学式为
您最近一年使用:0次
填空题
|
适中
(0.65)
名校
【推荐1】已知化合物C 为中学常见的化合物。

(1)若D是一种强酸,则C 与水反应的化学方程式为__________________________ 。
有人认为“浓H2SO4 可以干燥气体C”,某同学为了验证该观点是否正确,用如右上图装置进行实验。分液漏斗中应加入_______________ ,打开分液漏斗进行实验,过程中,浓H2SO4中未发现有气体逸出,且变为红棕色,则你得出的解释和结论是__________________ 。
(2)若D是一种常见的强碱,则C 的电子式为:_______________________ 。

(1)若D是一种强酸,则C 与水反应的化学方程式为
有人认为“浓H2SO4 可以干燥气体C”,某同学为了验证该观点是否正确,用如右上图装置进行实验。分液漏斗中应加入
(2)若D是一种常见的强碱,则C 的电子式为:
您最近一年使用:0次
填空题
|
适中
(0.65)
【推荐2】某班学生在老师指导下探究氮的化合物的某些性质。
(1)同学甲在实验室利用下列装置制取氨气和氧气的混合气体,并完成氨的催化氧化。
A中加入浓氨水,D中加入碱石灰,E内放置催化剂(铂石棉),请回答:

①仪器B的名称:_____________ 。B内只需加入一种固体试剂,该试剂的名称为__________ ,B中能产生氨气和氧气混合气体的原因(结合化学方程式回答)_______________________ 。
②按气流方向连接各仪器_____________________________________ (填接口字母)
(2)同学乙拟用甲同学得到的混合气体X(NO及过量的NH3),验证NO能被氨气还原并测算其转化率(忽略装置内空气的影响)。装置如下:

①装置C的作用可能是_____________
②若进入装置A的NO共268.8 mL(已折算为标准状况,下同),氨气过量,最后收集到标准状况下190.4 mL N2,则NO的转化率为_____________
(3)N2O3是一种新型硝化剂。一定温度下,在恒容密闭容器中N2O3可发生下列反应:2N2O3+O2 4NO2(g);△H>0,下表为反应在某温度下的部分实验数据
4NO2(g);△H>0,下表为反应在某温度下的部分实验数据
计算在t=500 s时,NO2的反应速率为_____________________
(1)同学甲在实验室利用下列装置制取氨气和氧气的混合气体,并完成氨的催化氧化。
A中加入浓氨水,D中加入碱石灰,E内放置催化剂(铂石棉),请回答:

①仪器B的名称:
②按气流方向连接各仪器
(2)同学乙拟用甲同学得到的混合气体X(NO及过量的NH3),验证NO能被氨气还原并测算其转化率(忽略装置内空气的影响)。装置如下:

①装置C的作用可能是
②若进入装置A的NO共268.8 mL(已折算为标准状况,下同),氨气过量,最后收集到标准状况下190.4 mL N2,则NO的转化率为
(3)N2O3是一种新型硝化剂。一定温度下,在恒容密闭容器中N2O3可发生下列反应:2N2O3+O2
 4NO2(g);△H>0,下表为反应在某温度下的部分实验数据
4NO2(g);△H>0,下表为反应在某温度下的部分实验数据| t/s | 0 | 500 | 1000 |
| c(N2O3)/mol·L-1 | 5.00 | 3.52 | 2.48 |
计算在t=500 s时,NO2的反应速率为
您最近一年使用:0次
填空题
|
适中
(0.65)
名校
解题方法
【推荐3】牙膏是常见的日用化学品。
(1)下表列出了两种牙膏中的摩擦剂,请写出它们所属的物质类别(填“酸”“碱”“盐”或“氧化物”)。
(2)请根据用途推测并说明二氧化硅在水中的溶解性______ (“易溶”或“难溶”)。
(3)牙膏中的摩擦剂碳酸钙可以用石灰石来制备。
①甲同学设计了一种在实验室中制备碳酸钙的实验方案(如下所示),请写出下述方案中有关反应的化学方程式______ 、______ 、______ 。

②乙同学设计的实验方案为:

乙同学的实验方案与甲同学的相比,有哪些优点__________ ?请写出乙同学的方案中有关反应的离子方程式_________ 、______ 。
(1)下表列出了两种牙膏中的摩擦剂,请写出它们所属的物质类别(填“酸”“碱”“盐”或“氧化物”)。
| 摩擦剂 | 碳酸钙 | 二氧化硅 |
| 物质类别 |
(3)牙膏中的摩擦剂碳酸钙可以用石灰石来制备。
①甲同学设计了一种在实验室中制备碳酸钙的实验方案(如下所示),请写出下述方案中有关反应的化学方程式

②乙同学设计的实验方案为:

乙同学的实验方案与甲同学的相比,有哪些优点
您最近一年使用:0次