Ⅰ.Fe、Al分别与盐酸反应(结果化简成最简单整数比,否则不给分):
(1)若盐酸足量,与等物质的量的Fe、Al反应产生H2的质量之比为_____________ 。
(2)若盐酸足量,与等质量的Fe、Al反应产生H2的质量之比为_________________ 。
(3)若盐酸不足,与足量Fe、Al反应产生H2在同温同压下的体积比为___________ 。
Ⅱ.铝分别与盐酸、NaOH溶液反应(结果化简成最简单整数比,否则不给分):
(4)若盐酸、NaOH溶液足量,与等质量的两份铝反应产生H2的体积之比是_______ 。
(5)若盐酸、NaOH溶液等体积、等物质的量浓度,与足量的两份铝反应产生H2的体积之比是________ 。
(6)若HCl、NaOH溶液与足量的两份铝反应,二者产生的H2相等,则HCl和NaOH的物质的量之比是________ 。
(7)若甲、乙两烧杯中各盛有100 mL 3 mol·L-1的盐酸和NaOH溶液,向两烧杯中分别加入等质量的铝粉,反应结束后,测得生成的气体体积比为V(甲):V(乙)=1:2,则加入铝粉的质量为________ g。
(1)若盐酸足量,与等物质的量的Fe、Al反应产生H2的质量之比为
(2)若盐酸足量,与等质量的Fe、Al反应产生H2的质量之比为
(3)若盐酸不足,与足量Fe、Al反应产生H2在同温同压下的体积比为
Ⅱ.铝分别与盐酸、NaOH溶液反应(结果化简成最简单整数比,否则不给分):
(4)若盐酸、NaOH溶液足量,与等质量的两份铝反应产生H2的体积之比是
(5)若盐酸、NaOH溶液等体积、等物质的量浓度,与足量的两份铝反应产生H2的体积之比是
(6)若HCl、NaOH溶液与足量的两份铝反应,二者产生的H2相等,则HCl和NaOH的物质的量之比是
(7)若甲、乙两烧杯中各盛有100 mL 3 mol·L-1的盐酸和NaOH溶液,向两烧杯中分别加入等质量的铝粉,反应结束后,测得生成的气体体积比为V(甲):V(乙)=1:2,则加入铝粉的质量为
更新时间:2018-12-29 17:27:23
|
相似题推荐
填空题
|
适中
(0.65)
名校
解题方法
【推荐1】硫有多种含氧酸,亚硫酸(H2SO3),硫酸(H2SO4),焦硫酸(H2SO4·SO3)其中硫酸最为重要,在工业上有广泛的应用。试回答下列问题:
(1)14 mol/L的H2SO4溶液中溶质的质量分数为80%,则7 mol/L的H2SO4溶液中溶质的质量分数将_______ (填“大于”等于”或“小于”)40%。
(2)若将18.4 mol/L的浓硫酸稀释为500 mL 0.2 mol/L的溶液,需用量筒取该浓硫酸____ mL。
(3)焦硫酸(H2SO4·SO3))溶于水,其中的SO3都转化为H2SO4。若将89 g焦硫酸溶于水配成800 mLH2SO4溶液,则该H2SO4溶液的物质的量浓度为_______ mol/L。
(4)硫铁矿是工业上制硫酸的主要原料。硫铁矿氧化焙烧的化学反应如下:
3FeS2+8O2=Fe3O4+6SO2
4FeS2+11O2=2Fe2O3+8SO2
若2.4 mol FeS2完全反应消耗氧气145.6 L(标准状况),则反应产物中Fe3O4与Fe2O3的物质的量之比为_______ 。
(1)14 mol/L的H2SO4溶液中溶质的质量分数为80%,则7 mol/L的H2SO4溶液中溶质的质量分数将
(2)若将18.4 mol/L的浓硫酸稀释为500 mL 0.2 mol/L的溶液,需用量筒取该浓硫酸
(3)焦硫酸(H2SO4·SO3))溶于水,其中的SO3都转化为H2SO4。若将89 g焦硫酸溶于水配成800 mLH2SO4溶液,则该H2SO4溶液的物质的量浓度为
(4)硫铁矿是工业上制硫酸的主要原料。硫铁矿氧化焙烧的化学反应如下:
3FeS2+8O2=Fe3O4+6SO2
4FeS2+11O2=2Fe2O3+8SO2
若2.4 mol FeS2完全反应消耗氧气145.6 L(标准状况),则反应产物中Fe3O4与Fe2O3的物质的量之比为
您最近一年使用:0次
填空题
|
适中
(0.65)
名校
解题方法
【推荐2】钠及其化合物在生产、生活中有着重要的应用。
(1)钠是一种银白色的金属,取2.3g钠块在干燥空气中放置一段时间后,其表面会失去金属光泽生成Na2O,此时固体质量为2.46g,则原钠块中已被氧化的钠为___________ mol;再将该钠块在干燥空气中充分加热,会得到浅黄色的___________ (填化学式)粉末;经过上述两步实验后,最终得到的粉末的质量应为___________ g。
(2)45.4g由Na2CO3·xH2O和NaHCO3组成的固体混合物在300℃左右充分加热,将产生的气体和剩余的固体分别进行下列操作。
实验①:将剩余固体溶于水,并加入足量氯化钙溶液,最终得到20g沉淀。
实验②:将加热产生的气体通入足量的澄清石灰水中充分吸收后,最终得到10g沉淀。
实验①中生成的沉淀的化学式为___________ ;实验②中反应的离子方程式为___________ ;由实验测得数据可知x=___________ ;混合物中碳酸氢钠的质量分数为___________ (保留两位有效数字)%。
(1)钠是一种银白色的金属,取2.3g钠块在干燥空气中放置一段时间后,其表面会失去金属光泽生成Na2O,此时固体质量为2.46g,则原钠块中已被氧化的钠为
(2)45.4g由Na2CO3·xH2O和NaHCO3组成的固体混合物在300℃左右充分加热,将产生的气体和剩余的固体分别进行下列操作。
实验①:将剩余固体溶于水,并加入足量氯化钙溶液,最终得到20g沉淀。
实验②:将加热产生的气体通入足量的澄清石灰水中充分吸收后,最终得到10g沉淀。
实验①中生成的沉淀的化学式为
您最近一年使用:0次
填空题
|
适中
(0.65)
解题方法
【推荐3】膜技术原理在化工生产中有着广泛的应用。有人设想利用电化学原理制备少量硫酸和绿色硝化剂N2O5,装置图如下。
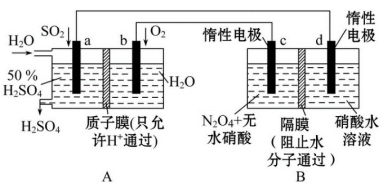
(1)A装置是_______ ,B装置是_______ (填“原电池”或“电解池”)。
(2)N2O5在电解池的_______ (填“c极”或“d极”)区生成,其电极反应式为_______ 。
(3)A装置中通入O2一极的电极反应式为_______ 。
(4)若A装置中通入SO2的速率为2.24L·min-1(标准状况),为稳定持续生产,硫酸溶液的浓度应维持不变,则左侧水的流入速率应为_______ mL·min-1。

(1)A装置是
(2)N2O5在电解池的
(3)A装置中通入O2一极的电极反应式为
(4)若A装置中通入SO2的速率为2.24L·min-1(标准状况),为稳定持续生产,硫酸溶液的浓度应维持不变,则左侧水的流入速率应为
您最近一年使用:0次
填空题
|
适中
(0.65)
【推荐1】Al和FeO的混合物在隔绝空气的条件下加热可发生反应,反应的化学方程式为 。取4份质量均为mg的Al和FeO的混合物(混合物中Al和FeO的物质的量之比均为2:3),进行如下实验。
。取4份质量均为mg的Al和FeO的混合物(混合物中Al和FeO的物质的量之比均为2:3),进行如下实验。
(1)将第一份加入过量NaOH溶液中,发生反应的化学方程式为___________ 。
(2)将第二份在隔绝空气的条件下加热充分反应。
①向反应后的混合物中先加入足量稀硫酸,固体全部溶解,并产生气体,写出产生气体的化学方程式:___________ 。
②向①中所得溶液中滴加NaOH溶液至过量,按反应的先后顺序写出该过程中铝元素参与的两个反应的离子方程式:___________ 、___________ 。
(3)将第三份在隔绝空气的条件下加热充分反应后,加入足量稀盐酸,产生标准状况下的气体体积为V1L;将第四份直接加入足量稀盐酸中,产生标准状况下的气体体积为V2L,则V1_______ V2(填“>”“<”“=”)
 。取4份质量均为mg的Al和FeO的混合物(混合物中Al和FeO的物质的量之比均为2:3),进行如下实验。
。取4份质量均为mg的Al和FeO的混合物(混合物中Al和FeO的物质的量之比均为2:3),进行如下实验。(1)将第一份加入过量NaOH溶液中,发生反应的化学方程式为
(2)将第二份在隔绝空气的条件下加热充分反应。
①向反应后的混合物中先加入足量稀硫酸,固体全部溶解,并产生气体,写出产生气体的化学方程式:
②向①中所得溶液中滴加NaOH溶液至过量,按反应的先后顺序写出该过程中铝元素参与的两个反应的离子方程式:
(3)将第三份在隔绝空气的条件下加热充分反应后,加入足量稀盐酸,产生标准状况下的气体体积为V1L;将第四份直接加入足量稀盐酸中,产生标准状况下的气体体积为V2L,则V1
您最近一年使用:0次
填空题
|
适中
(0.65)
解题方法
【推荐2】阅读下列材料并填空。
2021年10月16日,搭载神舟十三号载人飞船的长征二号F遥十三运载火箭精准点火。神舟十三号载人飞船的成功发射离不开化学燃料。火箭分级推进中使用的燃料主要有①煤油、②液氢、③肼 和④固态铝粉,氧化剂主要有⑤液氧、⑥
和④固态铝粉,氧化剂主要有⑤液氧、⑥ 和⑦高氯酸铵
和⑦高氯酸铵 。
。
(1)上述材料涉及到的物质中,属于混合物的是_______ (填标号,下同);属于氧化物的是_______ ;属于单质的是_______ 。
(2)下列物质能与铝反应的是_______ (填标号)。
A.硝酸铜溶液B.稀硫酸C.氯气
(3)天宫课堂展示的泡腾片实验让我们感受到太空的奇妙。泡腾片含碳酸氢钠和固体酸,实验中将泡腾片放入蓝色水球,水球中产生许多气泡,气泡的主要成分是____ ,你推断的理由是____ 。
2021年10月16日,搭载神舟十三号载人飞船的长征二号F遥十三运载火箭精准点火。神舟十三号载人飞船的成功发射离不开化学燃料。火箭分级推进中使用的燃料主要有①煤油、②液氢、③肼
 和④固态铝粉,氧化剂主要有⑤液氧、⑥
和④固态铝粉,氧化剂主要有⑤液氧、⑥ 和⑦高氯酸铵
和⑦高氯酸铵 。
。(1)上述材料涉及到的物质中,属于混合物的是
(2)下列物质能与铝反应的是
A.硝酸铜溶液B.稀硫酸C.氯气
(3)天宫课堂展示的泡腾片实验让我们感受到太空的奇妙。泡腾片含碳酸氢钠和固体酸,实验中将泡腾片放入蓝色水球,水球中产生许多气泡,气泡的主要成分是
您最近一年使用:0次
填空题
|
适中
(0.65)
【推荐1】请用化学用语回答下列各题:
(1)实验室用无水乙醇处理废小钠屑的化学方程式____ 。
(2)可用作生氧剂的淡黄色固体A,其电子式为___ ,A与水反应的离子方程式为____ 。
(3)在氮气中____ (填“能”或者“不能”)冷却镁粉,其原因是(用化学方程式表示)___ 。
(4)向铝制易拉罐中,滴加NaOH溶液直至过量,主要反应的离子方程式有___ 。
(5)用化合反应制备氯化亚铁的化学方程式:____ 。
(6)用氯化铁溶液腐蚀废旧线路板上铜箔的离子方程式____ 。
(1)实验室用无水乙醇处理废小钠屑的化学方程式
(2)可用作生氧剂的淡黄色固体A,其电子式为
(3)在氮气中
(4)向铝制易拉罐中,滴加NaOH溶液直至过量,主要反应的离子方程式有
(5)用化合反应制备氯化亚铁的化学方程式:
(6)用氯化铁溶液腐蚀废旧线路板上铜箔的离子方程式
您最近一年使用:0次
填空题
|
适中
(0.65)
解题方法
【推荐2】除去下列物质中所含杂质(括号内为杂质),写出除去杂质的化学方程式。
(1)Fe2O3[Fe(OH)3]_______ ;
(2)Fe2O3(Al2O3)_______
(3)Fe(Al)_______
(4)Na2CO3(NaHCO3)_______
(1)Fe2O3[Fe(OH)3]
(2)Fe2O3(Al2O3)
(3)Fe(Al)
(4)Na2CO3(NaHCO3)
您最近一年使用:0次
填空题
|
适中
(0.65)
名校
【推荐1】回答下列问题:
(1)三四两月,桃花李花竞相开放,植物长出嫩嫩绿芽,空气清新。花海飘香,使人流连忘返。
①树林中富含抗氧化防衰老的负氧离子。一种负氧离子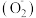 的一个原子团是由一个
的一个原子团是由一个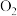 分子俘获了空气中一个自由电子形成的微粒,每个
分子俘获了空气中一个自由电子形成的微粒,每个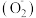 中共含有
中共含有_______ 个电子。
②培育鲜花的某种营养液呈蓝色,可能由 中的一种或几种物质配制而成,其中Ca、N的元素质量比为1:1,则该营养液中含有
中的一种或几种物质配制而成,其中Ca、N的元素质量比为1:1,则该营养液中含有_______ 种溶质。从均衡植物所需营养元素的角度分析,营养液中还需补充_______ (填元素符号)。
(2)分析处理图表中的信息是学习化学的一种重要方法。如表是氯化钠和碳酸钠在不同温度时的溶解度,根据此表回答:
①40℃时,氯化钠的溶解度为_______ g
②在20℃时,将100g的水加入30g碳酸钠中,充分搅拌后得到的是_______ (填“饱和溶液”或“不饱和溶液”)
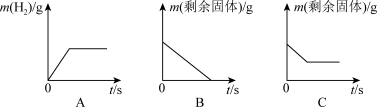
(3)根据所学知识回答下列与金属材料有关的问题。将过量的稀盐酸加入一定量的铁、铜混合物中,反应后溶液中溶质有_______ 种。如图是实验过程生成气体或剩余固体的质量随反应时间的变化关系,其中表示不正确的是_______ (填标号)。
(1)三四两月,桃花李花竞相开放,植物长出嫩嫩绿芽,空气清新。花海飘香,使人流连忘返。
①树林中富含抗氧化防衰老的负氧离子。一种负氧离子
 的一个原子团是由一个
的一个原子团是由一个 分子俘获了空气中一个自由电子形成的微粒,每个
分子俘获了空气中一个自由电子形成的微粒,每个 中共含有
中共含有②培育鲜花的某种营养液呈蓝色,可能由
 中的一种或几种物质配制而成,其中Ca、N的元素质量比为1:1,则该营养液中含有
中的一种或几种物质配制而成,其中Ca、N的元素质量比为1:1,则该营养液中含有(2)分析处理图表中的信息是学习化学的一种重要方法。如表是氯化钠和碳酸钠在不同温度时的溶解度,根据此表回答:
| 温度/℃ | 10 | 20 | 30 | 40 | |
| 溶解度 | 氯化钠 | 35.8 | 36.0 | 36.3 | 36.6 |
| 碳酸钠 | 12.2 | 21.8 | 39.7 | 53.2 | |
①40℃时,氯化钠的溶解度为
②在20℃时,将100g的水加入30g碳酸钠中,充分搅拌后得到的是
(3)根据所学知识回答下列与金属材料有关的问题。将过量的稀盐酸加入一定量的铁、铜混合物中,反应后溶液中溶质有

您最近一年使用:0次
填空题
|
适中
(0.65)
解题方法
【推荐2】历史上金、银、铜主要是作为货币金属或装饰品被应用。
(1)金、银、铜常被作为钱币流通,从化学角度来看,主要是利用它们的________ (填字母)。
A.硬度适中 B.密度适中
C.在自然界里都可得到纯净的单质 D.不活泼性
(2)试样X由氧化亚铁和氧化铜组成,取质量相等的两份试样,按下图所示进行实验:
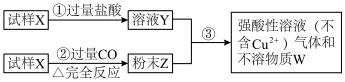
请写出步骤③中所发生的全部反应的离子方程式:________ 。若全部的溶液Y和全部的粉末Z充分反应后,生成的不溶物W的质量是m,则每份试样X中氧化铜的质量为________ (用m表示)。
(1)金、银、铜常被作为钱币流通,从化学角度来看,主要是利用它们的
A.硬度适中 B.密度适中
C.在自然界里都可得到纯净的单质 D.不活泼性
(2)试样X由氧化亚铁和氧化铜组成,取质量相等的两份试样,按下图所示进行实验:

请写出步骤③中所发生的全部反应的离子方程式:
您最近一年使用:0次

 随加入Mg的质量的大致变化曲线图如图,请在图中画出天平的右盘增加的质量
随加入Mg的质量的大致变化曲线图如图,请在图中画出天平的右盘增加的质量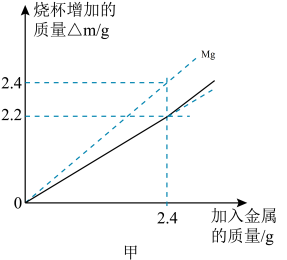
 的最好方法是
的最好方法是 溶液中
溶液中 溶液滴入
溶液滴入 溶液中
溶液中

