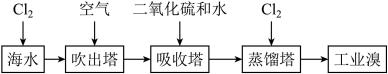
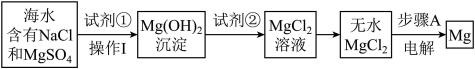
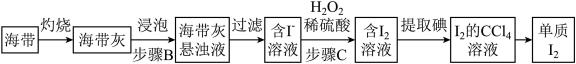
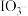海洋经济已经成为拉动我国国民经济发展的重要引擎,海水的综合开发、利用是海洋经济的一部分,海水中可提取多种化工原料,下面是工业上对海水的几项综合利用的示意图。其流程如下图所示:

(1)写出镁原子的结构示意图:_________________ 。在反应①→⑤中属于氧化还原反应的是___________ (填序号);
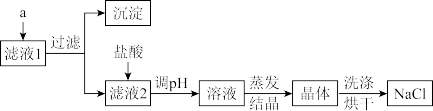
(2)粗盐中含有Na2SO4、MgCl2、CaCl2等可溶性杂质,为制得纯净的NaCl晶体,操作如下:①溶解;②依次加入过量的BaCl2溶液、NaOH溶液、________ 溶液;③_________ ;④滤液中加适量盐酸;⑤__________ (请补全缺少的实验步骤或试剂);
(3)某同学利用反应①原理制备氯气,将200 mL 5.0 mol·L-1NaCl溶液进行电解,则理论上最多可制得标准状况下氯气的体积为__________ L;
(4)实验室模拟Mg的制取流程时,用11.3 mol·L-1的浓盐酸配置反应③所需要的0.5 mol·L―1稀盐酸100 mL,需要用量筒量取浓盐酸________ mL,接下来的配制过程除了玻璃棒和烧杯外,还需要用到的玻璃仪器有___________________ 。

(1)写出镁原子的结构示意图:
(2)粗盐中含有Na2SO4、MgCl2、CaCl2等可溶性杂质,为制得纯净的NaCl晶体,操作如下:①溶解;②依次加入过量的BaCl2溶液、NaOH溶液、
(3)某同学利用反应①原理制备氯气,将200 mL 5.0 mol·L-1NaCl溶液进行电解,则理论上最多可制得标准状况下氯气的体积为
(4)实验室模拟Mg的制取流程时,用11.3 mol·L-1的浓盐酸配置反应③所需要的0.5 mol·L―1稀盐酸100 mL,需要用量筒量取浓盐酸
更新时间:2019-02-14 15:38:38
|
相似题推荐
解答题-工业流程题
|
适中
(0.65)
【推荐1】海洋蕴藏着丰富的资源,以海水为原料可以制取Na、NaOH 、Mg、Cl2、Br2等。下图是某化工厂对海水资源综合利用的示意图。
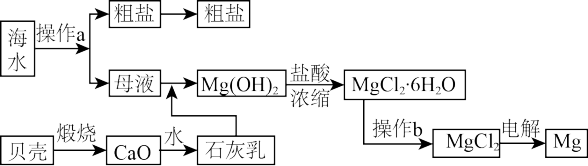
回答下列问题:
(1)流程图中操作a的名称为_______________ 。
(2)原料粗盐中常含有泥沙和Ca2+、Mg2+、Fe3+、 等杂质,必须精制后才能供电解使用。精制时,粗盐溶于水过滤后,还要加入的试剂分别为①Na2CO3、②HCl(盐酸)、③Ba(OH)2,这3种试剂添加的合理顺序是
等杂质,必须精制后才能供电解使用。精制时,粗盐溶于水过滤后,还要加入的试剂分别为①Na2CO3、②HCl(盐酸)、③Ba(OH)2,这3种试剂添加的合理顺序是____________ (填序号)。
(3)镁是一种用途很广的金属材料,目前世界上60%的镁从海水中提取。电解所得的镁蒸气需在特定的环境中冷却,不能用CO2 作冷却剂的原因是___________________ (用化学方程式表示)。
(4)上述流程没有涉及到的四大基本反应类型是________________
A 化合反应 B 分解反应 C 置换反应 D 复分解反应
(5)在该化工厂中,海水提取氯化钠后的母液经过提取氯化镁后又形成了新的母液,向新母液中加入氯气,又制取了重要的化工原料溴单质,生成溴单质反应的离子方程式是______________________ 。

回答下列问题:
(1)流程图中操作a的名称为
(2)原料粗盐中常含有泥沙和Ca2+、Mg2+、Fe3+、
 等杂质,必须精制后才能供电解使用。精制时,粗盐溶于水过滤后,还要加入的试剂分别为①Na2CO3、②HCl(盐酸)、③Ba(OH)2,这3种试剂添加的合理顺序是
等杂质,必须精制后才能供电解使用。精制时,粗盐溶于水过滤后,还要加入的试剂分别为①Na2CO3、②HCl(盐酸)、③Ba(OH)2,这3种试剂添加的合理顺序是(3)镁是一种用途很广的金属材料,目前世界上60%的镁从海水中提取。电解所得的镁蒸气需在特定的环境中冷却,不能用CO2 作冷却剂的原因是
(4)上述流程没有涉及到的四大基本反应类型是
A 化合反应 B 分解反应 C 置换反应 D 复分解反应
(5)在该化工厂中,海水提取氯化钠后的母液经过提取氯化镁后又形成了新的母液,向新母液中加入氯气,又制取了重要的化工原料溴单质,生成溴单质反应的离子方程式是
您最近一年使用:0次
解答题-工业流程题
|
适中
(0.65)
名校
解题方法
【推荐2】氯化钠是一种非常重要钠盐。
I.实验室里需要纯净的氯化钠溶液,但现在只有混有硫酸钠、碳酸氢铵的氯化钠固体。某学生设计了如图方案,请回答下列问题。
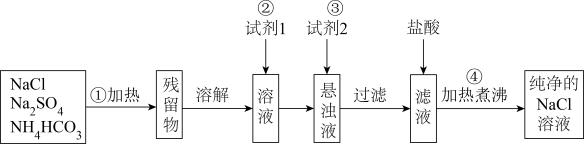
已知:操作①中发生的化学反应方程式为: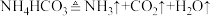
(1)试剂1最好为____________________ (填化学式)。
(2)加入试剂2的目的除去过量的试剂1中引进的杂质离子,写出加入试剂2发生反应的离子方程式:________________________________________ 。
(3)如何检验产品中的溶质为NaCl:______________________________ 。
II. 是一种化工原料,如图所示可以制备一系列物质
是一种化工原料,如图所示可以制备一系列物质
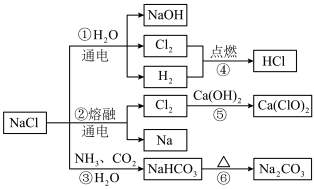
(4)图所列转化反应中属于氧化还原反应的有__________ (填图中序号)。
电解氯化钠溶液发生反应的离子方程式为______________________________ 。
(5)用单线桥分析电解熔融氯化钠时电子转移情况:______________________________ 。

(6)反应③是侯氏制碱法的原理,反应⑥的化学方程式为:______________________________ 。
I.实验室里需要纯净的氯化钠溶液,但现在只有混有硫酸钠、碳酸氢铵的氯化钠固体。某学生设计了如图方案,请回答下列问题。

已知:操作①中发生的化学反应方程式为:
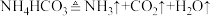
(1)试剂1最好为
(2)加入试剂2的目的除去过量的试剂1中引进的杂质离子,写出加入试剂2发生反应的离子方程式:
(3)如何检验产品中的溶质为NaCl:
II.
 是一种化工原料,如图所示可以制备一系列物质
是一种化工原料,如图所示可以制备一系列物质
(4)图所列转化反应中属于氧化还原反应的有
电解氯化钠溶液发生反应的离子方程式为
(5)用单线桥分析电解熔融氯化钠时电子转移情况:

(6)反应③是侯氏制碱法的原理,反应⑥的化学方程式为:
您最近一年使用:0次
解答题-工业流程题
|
适中
(0.65)
解题方法
【推荐3】海水是人类宝贵的自然资源,从海水中可以提取多种化工原料,部分流程如图所示:
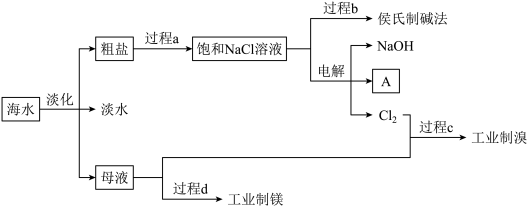
请回答下列问题:
(1)过程a为粗盐的精制。除去粗盐中的 、
、 、
、 时,需向经简单处理过的粗盐溶液中依次加入过量的
时,需向经简单处理过的粗盐溶液中依次加入过量的_______ 溶液、NaOH溶液以及_______ 溶液,过滤后加入适量盐酸。
(2)过程b的部分流程如下:
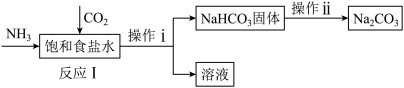
①实验室可用浓氨水与生石灰混合制取NH3,其化学方程式为_______ 。
②进行反应Ⅰ时,应先通入_______ (填“NH3”或“CO2”);实验室进行操作ⅰ时,所需要的硅酸盐仪器主要有_______ 。
③检验Na2CO3中含有的NaCl所需要的试剂为_______ (填名称)。
(3)电解饱和食盐水时会产生单质A,则单质A的化学式为_______ 。
(4)过程c为“吹出法”制溴。两次通入Cl2的目的是富集浓缩溴,若最终获得1molBr2,理论上需消耗的Cl2在标准状况下的体积为_______ L。
(5)过程d中制取无水MgCl2是关键。将 晶体加入二氯亚砜(SOCl2)中,加热即可获得三种产物,无水MgCl2和两种酸性气体,试写出该反应的化学方程式:
晶体加入二氯亚砜(SOCl2)中,加热即可获得三种产物,无水MgCl2和两种酸性气体,试写出该反应的化学方程式:_______ 。

请回答下列问题:
(1)过程a为粗盐的精制。除去粗盐中的
 、
、 、
、 时,需向经简单处理过的粗盐溶液中依次加入过量的
时,需向经简单处理过的粗盐溶液中依次加入过量的(2)过程b的部分流程如下:

①实验室可用浓氨水与生石灰混合制取NH3,其化学方程式为
②进行反应Ⅰ时,应先通入
③检验Na2CO3中含有的NaCl所需要的试剂为
(3)电解饱和食盐水时会产生单质A,则单质A的化学式为
(4)过程c为“吹出法”制溴。两次通入Cl2的目的是富集浓缩溴,若最终获得1molBr2,理论上需消耗的Cl2在标准状况下的体积为
(5)过程d中制取无水MgCl2是关键。将
 晶体加入二氯亚砜(SOCl2)中,加热即可获得三种产物,无水MgCl2和两种酸性气体,试写出该反应的化学方程式:
晶体加入二氯亚砜(SOCl2)中,加热即可获得三种产物,无水MgCl2和两种酸性气体,试写出该反应的化学方程式:
您最近一年使用:0次
解答题-工业流程题
|
适中
(0.65)
名校
解题方法
【推荐1】综合利用海水可以制备食盐、纯碱、金属镁、溴等物质,其流程如图所示

(1)粗盐中含有硫酸钠、氯化镁、氯化钙等可溶性杂质,为除去这些杂质而得精盐,进行如下操作:①溶解;②加过量的BaCl2溶液;③加过量的NaOH溶液;④加过量的Na2CO3溶液;⑤_ ;⑥加适量的盐酸;⑦蒸发结晶。
(2)气体X是_______ (填化学式,下同) ,气体Y是________ ,写出向溶液Ⅱ中通入气体Y发生反应的离子方程式______________________
(3)写出用MgCl2固体制备Mg的化学方程式_______________________________
(4)高温灼烧六水合氯化镁晶体(MgCl2·6H2O)所得固体是氧化镁,试写出该反应的化学方程式:___________________________________
(5)若在母液中通入氯气可提取海水中的溴,反应的离子方程式为_______________________
(6)取8.40g纯碳酸氢钠固体经热解后得5.61g固体,则所得固体中纯碱的质量分数为_____

(1)粗盐中含有硫酸钠、氯化镁、氯化钙等可溶性杂质,为除去这些杂质而得精盐,进行如下操作:①溶解;②加过量的BaCl2溶液;③加过量的NaOH溶液;④加过量的Na2CO3溶液;⑤
(2)气体X是
(3)写出用MgCl2固体制备Mg的化学方程式
(4)高温灼烧六水合氯化镁晶体(MgCl2·6H2O)所得固体是氧化镁,试写出该反应的化学方程式:
(5)若在母液中通入氯气可提取海水中的溴,反应的离子方程式为
(6)取8.40g纯碳酸氢钠固体经热解后得5.61g固体,则所得固体中纯碱的质量分数为
您最近一年使用:0次
解答题-实验探究题
|
适中
(0.65)
解题方法
【推荐2】地球的表面积为 5.1 亿平方公里,其中海洋的面积为 3.67 亿平方公里,占整个地球表面积的 70.8 %。海洋是一个巨大的化学资源宝库,请回答下列问题:
(1)请列举海水淡化的一种方法________ 。
下面是海水资源综合利用的部分流程图:

(2)步骤①中,粗盐中含有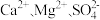 等杂质离子,精制时常用的试剂有:a 稀盐酸;b 氯化钡溶液;c 氢氧化钠溶液;d 碳酸钠溶液。加入试剂的顺序正确的是
等杂质离子,精制时常用的试剂有:a 稀盐酸;b 氯化钡溶液;c 氢氧化钠溶液;d 碳酸钠溶液。加入试剂的顺序正确的是________ (填字母);
(3)反应④由无水 制取金属镁的常用工业方法是
制取金属镁的常用工业方法是 ________ (用化学方程式表示);
(4)步骤⑤已经获得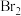 ,步骤⑥又将
,步骤⑥又将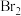 还原为
还原为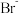 ,其目的是
,其目的是 ________ ;写出步骤⑥反应的离子方程式 ________ ;由海水提溴过程中的反应可得出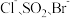 还原性由强到弱的顺序是
还原性由强到弱的顺序是________ 。
海带灰中富含以 形式存在的碘元素。实验室提取
形式存在的碘元素。实验室提取 的途径如图所示:
的途径如图所示:

(5)灼烧海带至灰烬时所用的主要仪器名称是________ ;
(6)向酸化的滤液中加过氧化氢溶液,写出该反应的离子方程式________ 。反应结束后,再加入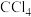 作萃取剂,振荡、静置,可以观察到
作萃取剂,振荡、静置,可以观察到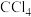 层呈
层呈 ________ 色。
(1)请列举海水淡化的一种方法
下面是海水资源综合利用的部分流程图:

(2)步骤①中,粗盐中含有
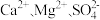 等杂质离子,精制时常用的试剂有:a 稀盐酸;b 氯化钡溶液;c 氢氧化钠溶液;d 碳酸钠溶液。加入试剂的顺序正确的是
等杂质离子,精制时常用的试剂有:a 稀盐酸;b 氯化钡溶液;c 氢氧化钠溶液;d 碳酸钠溶液。加入试剂的顺序正确的是(3)反应④由无水
 制取金属镁的常用工业方法是
制取金属镁的常用工业方法是 (4)步骤⑤已经获得
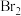 ,步骤⑥又将
,步骤⑥又将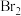 还原为
还原为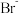 ,其目的是
,其目的是 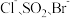 还原性由强到弱的顺序是
还原性由强到弱的顺序是海带灰中富含以
 形式存在的碘元素。实验室提取
形式存在的碘元素。实验室提取 的途径如图所示:
的途径如图所示:
(5)灼烧海带至灰烬时所用的主要仪器名称是
(6)向酸化的滤液中加过氧化氢溶液,写出该反应的离子方程式
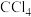 作萃取剂,振荡、静置,可以观察到
作萃取剂,振荡、静置,可以观察到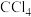 层呈
层呈
您最近一年使用:0次
解答题-实验探究题
|
适中
(0.65)
解题方法
【推荐3】氯化钠是生活必需品,也是重要的化工原料。提纯含少量泥沙的粗盐,一般经过如图操作流程:

(1)操作⑤中除用到铁架台(带铁圈)、酒精灯、玻璃棒、坩埚钳外,还需要用到的仪器是_______
(2)实验结束后称量获得的“精盐”,并计算“精盐”的制得率,发现制得率较低,其可能原因是_______(填字母)。
(3)小明查阅相关资料得知:粗盐中除含泥沙等不溶性杂质外,还含有少量的 、
、 、
、 等可溶性杂质。为了得到较纯净的氯化钠,小明将上述流程图中滤液1做了如图处理:
等可溶性杂质。为了得到较纯净的氯化钠,小明将上述流程图中滤液1做了如图处理:
提供的试剂: 溶液、
溶液、 溶液、
溶液、 溶液、
溶液、 溶液、
溶液、 和
和 溶液。
溶液。
①从提供的试剂中选择,a所代表的试剂是_______ 、_______ 、 溶液(各试剂均稍过量)。
溶液(各试剂均稍过量)。
②判断“滤液I中 是否已除尽操作是
是否已除尽操作是_______ .
③在“滤液2”中加盐酸的作用是_______ 、_______ (用化学方程式表示)。

(1)操作⑤中除用到铁架台(带铁圈)、酒精灯、玻璃棒、坩埚钳外,还需要用到的仪器是
(2)实验结束后称量获得的“精盐”,并计算“精盐”的制得率,发现制得率较低,其可能原因是_______(填字母)。
| A.粗盐没有全部溶解即过滤 |
| B.蒸发时有液滴飞溅 |
| C.蒸发后所得“精盐”很潮湿 |
| D.蒸发皿上粘有的“精盐”没有全部转移到称量纸上 |
 、
、 、
、 等可溶性杂质。为了得到较纯净的氯化钠,小明将上述流程图中滤液1做了如图处理:
等可溶性杂质。为了得到较纯净的氯化钠,小明将上述流程图中滤液1做了如图处理:
提供的试剂:
 溶液、
溶液、 溶液、
溶液、 溶液、
溶液、 溶液、
溶液、 和
和 溶液。
溶液。①从提供的试剂中选择,a所代表的试剂是
 溶液(各试剂均稍过量)。
溶液(各试剂均稍过量)。②判断“滤液I中
 是否已除尽操作是
是否已除尽操作是③在“滤液2”中加盐酸的作用是
您最近一年使用:0次
解答题-工业流程题
|
适中
(0.65)
解题方法
【推荐1】I.海水是巨大的资源宝库,可以进行综合利用。从海水中提取淡水、食盐和溴的过程r如下:
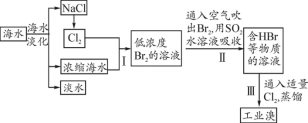
(1)步骤Ⅰ获得Br2的化学反应的离子方程式为___________ 。
(2)步骤Ⅱ用SO2水溶液吸收Br2,使溴蒸气转化为氢溴酸以达到富集的目的,其反应的化学方程式为___________ 。在该反应中,氧化剂是___________ (填化学式);若反应中生成2 mol HBr,则消耗___________ mol SO2。
(3)根据上述反应可判断出SO2、Cl2、Br2三种物质氧化性由强到弱的顺序是___________ 。
II.A是一种重要的化工原料,部分性质及转化关系如下图:

请回答。
(4)D中官能团的名称是___________ 。
(5)A→B的反应类型是___________。
(6)写出A→C反应的化学方程式:___________ 。

(1)步骤Ⅰ获得Br2的化学反应的离子方程式为
(2)步骤Ⅱ用SO2水溶液吸收Br2,使溴蒸气转化为氢溴酸以达到富集的目的,其反应的化学方程式为
(3)根据上述反应可判断出SO2、Cl2、Br2三种物质氧化性由强到弱的顺序是
II.A是一种重要的化工原料,部分性质及转化关系如下图:

请回答。
(4)D中官能团的名称是
(5)A→B的反应类型是___________。
| A.取代反应 | B.加成反应 | C.氧化反应 | D.还原反应 |
您最近一年使用:0次
解答题-工业流程题
|
适中
(0.65)
【推荐2】以苦卤(海水晒盐后得到的母液,显弱碱性,含 )为原料,利用空气吹出法进行“海水提溴”的工艺流程如图(已知:
)为原料,利用空气吹出法进行“海水提溴”的工艺流程如图(已知: 的沸点为58.78℃)。
的沸点为58.78℃)。
苦卤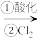 含
含 的海水
的海水 吸收液
吸收液 溴水混合物
溴水混合物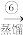 溴蒸气
溴蒸气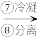 液溴
液溴
回答下列问题:
(1)①酸化的目的是防止_________________ (用离子方程式表示)。
(2)若步骤④使用 和
和 吸收吹出的
吸收吹出的 ,则反应的化学方程式为
,则反应的化学方程式为____________ ,步骤⑤再次用 氧化吸收液,重新生成
氧化吸收液,重新生成 。由此推出
。由此推出 、
、 、
、 的还原性由强到弱的顺序:
的还原性由强到弱的顺序:_________ 。空气吹出后的含溴空气中还含有 ,应选择除氯剂
,应选择除氯剂 溶液,若
溶液,若 少量,写出反应的离子方程式:
少量,写出反应的离子方程式:_____ 。
(3)步骤⑥中蒸馏的温度为80~90℃,温度过高或过低都不利于生产,请解释原因:_____________ 。
(4)该工艺流程中,不直接对“含 的海水”进行蒸馏,而是经历步骤③④⑤后才对“溴水混合物”进行蒸馏获得
的海水”进行蒸馏,而是经历步骤③④⑤后才对“溴水混合物”进行蒸馏获得 单质,“步骤③④⑤”的作用是
单质,“步骤③④⑤”的作用是____________________ 。
(5) 是一种分析试剂。向硫酸酸化的NaI溶液中逐滴加入
是一种分析试剂。向硫酸酸化的NaI溶液中逐滴加入 溶液,当加入2.6mol
溶液,当加入2.6mol  时,测得反应后溶液中溴和碘的存在形式及物质的量分别为:
时,测得反应后溶液中溴和碘的存在形式及物质的量分别为:
则原溶液中NaI的物质的量为_____________ mol。
 )为原料,利用空气吹出法进行“海水提溴”的工艺流程如图(已知:
)为原料,利用空气吹出法进行“海水提溴”的工艺流程如图(已知: 的沸点为58.78℃)。
的沸点为58.78℃)。苦卤
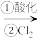 含
含 的海水
的海水 吸收液
吸收液 溴水混合物
溴水混合物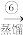 溴蒸气
溴蒸气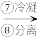 液溴
液溴回答下列问题:
(1)①酸化的目的是防止
(2)若步骤④使用
 和
和 吸收吹出的
吸收吹出的 ,则反应的化学方程式为
,则反应的化学方程式为 氧化吸收液,重新生成
氧化吸收液,重新生成 。由此推出
。由此推出 、
、 、
、 的还原性由强到弱的顺序:
的还原性由强到弱的顺序: ,应选择除氯剂
,应选择除氯剂 溶液,若
溶液,若 少量,写出反应的离子方程式:
少量,写出反应的离子方程式:(3)步骤⑥中蒸馏的温度为80~90℃,温度过高或过低都不利于生产,请解释原因:
(4)该工艺流程中,不直接对“含
 的海水”进行蒸馏,而是经历步骤③④⑤后才对“溴水混合物”进行蒸馏获得
的海水”进行蒸馏,而是经历步骤③④⑤后才对“溴水混合物”进行蒸馏获得 单质,“步骤③④⑤”的作用是
单质,“步骤③④⑤”的作用是(5)
 是一种分析试剂。向硫酸酸化的NaI溶液中逐滴加入
是一种分析试剂。向硫酸酸化的NaI溶液中逐滴加入 溶液,当加入2.6mol
溶液,当加入2.6mol  时,测得反应后溶液中溴和碘的存在形式及物质的量分别为:
时,测得反应后溶液中溴和碘的存在形式及物质的量分别为:粒子 |
|
|
|
物质的量/mol | 1.3 | 2 |
您最近一年使用:0次
【推荐1】浩瀚的海洋里蕴藏着丰富的化学资源,利用海水可以提取溴和镁,提取过程如下:
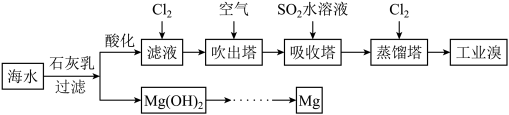
(1)“吹出法”是工业上常用的一种海水提溴技术。
①写出“吸收”步骤中反应的化学方程式:___________ ,经过2次Br-→Br2,转化的目的是___________ 。
②“吹出法”中的“吸收”及后续步骤的工艺也可采用如下流程:

写出步骤②中反应的离子方程式:___________ 。
(2)在实验中,欲利用获得的Mg(OH)2制取纯净的MgC12·6H2O晶体,请补充实验方案:取一定量Mg(OH)2固体置于烧杯中,___________ ,得到MgC12·6H2O晶体。(可选用试剂:1 mol-L-1 H2SO4溶液、2moL-1HCl溶液、冰水)。
(3)溴量法测定废水中苯酚(C6H6O)含量的过程如下(废水中不含干扰测定的物质)。
步骤1 向盛有5.00mL0.0002mol/L KBrO3溶液的锥形瓶中加入过量KBr,加H2SO4酸化一段时间;
步骤2 加入50.00mL废水,充分反应( );
);
步骤3 向锥形瓶中加入过量KI,生成的I2恰好和4.80mL0.001mol/LNa2S2O3反应( )。
)。
计算该废水中苯酚的含量___________ (单位为mg/L,写出计算过程)。

(1)“吹出法”是工业上常用的一种海水提溴技术。
①写出“吸收”步骤中反应的化学方程式:
②“吹出法”中的“吸收”及后续步骤的工艺也可采用如下流程:

写出步骤②中反应的离子方程式:
(2)在实验中,欲利用获得的Mg(OH)2制取纯净的MgC12·6H2O晶体,请补充实验方案:取一定量Mg(OH)2固体置于烧杯中,
(3)溴量法测定废水中苯酚(C6H6O)含量的过程如下(废水中不含干扰测定的物质)。
步骤1 向盛有5.00mL0.0002mol/L KBrO3溶液的锥形瓶中加入过量KBr,加H2SO4酸化一段时间;
步骤2 加入50.00mL废水,充分反应(
 );
);步骤3 向锥形瓶中加入过量KI,生成的I2恰好和4.80mL0.001mol/LNa2S2O3反应(
 )。
)。计算该废水中苯酚的含量
您最近一年使用:0次
解答题-实验探究题
|
适中
(0.65)
解题方法
【推荐2】综合利用海水可以制备食盐、纯碱、金属镁等物质,其流程如图所示:
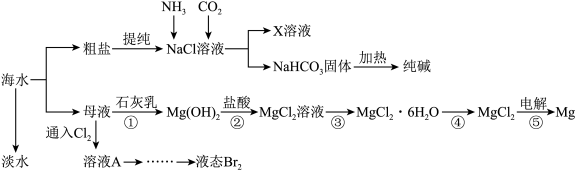
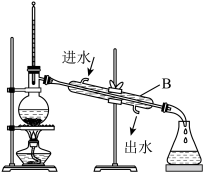
(1)从海水中获得淡水的装置如图,其中有_____ 处错误。
(2)在母液中通入氯气的离子方程式为_____ ,从溶液A中提取Br2,需要的主要仪器是____
(3)操作③是_____
(4)粗盐中含有Na2SO4、MgCl2、CaCl2等可溶性杂质。
①为制得纯净的NaCl晶体,操作如下:
a.溶解;
b.依次加入过量的_____ 溶液、NaOH溶液、_____ 溶液;
c._____ ;
d.加适量盐酸;
e._____ (请补全缺少的试剂和实验步骤)
②步骤b中,加入最后一种试剂发生反应的离子方程式为_____
(5)用这种方法制得的Na2CO3中有少量的NaCl,检验NaCl的实验为_____

(1)从海水中获得淡水的装置如图,其中有

(2)在母液中通入氯气的离子方程式为
(3)操作③是
(4)粗盐中含有Na2SO4、MgCl2、CaCl2等可溶性杂质。
①为制得纯净的NaCl晶体,操作如下:
a.溶解;
b.依次加入过量的
c.
d.加适量盐酸;
e.
②步骤b中,加入最后一种试剂发生反应的离子方程式为
(5)用这种方法制得的Na2CO3中有少量的NaCl,检验NaCl的实验为
您最近一年使用:0次
解答题-工业流程题
|
适中
(0.65)
名校
解题方法
【推荐3】海水中化学资源的综合开发利用,已受到各国的高度重视。Br2和Mg等两种单质都可以从海水中提取,如图为提取它们的主要步骤:
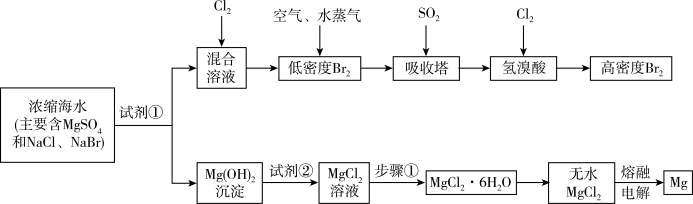
请回答:
Ⅰ.从海水中提取的溴占世界溴年产量的三分之一,主要方法就是上述流程中的空气吹出法。
(1)制取Br2时第一次通入Cl2时发生反应的离子方程式是_________ 。
(2)吸收塔中反应的离子方程式是_______ ,工业生产1mol Br2,理论上需要Cl2的物质的量为______ 。
(3)取10L海水经过提纯浓缩,向吸收塔吸收后的溶液中加入0.100 mol/L AgNO3溶液8.0 mL恰好完全反应,则海水中含溴的含量为______ mg/L(不考虑提纯过程中溴的损失)。
Ⅱ.镁及其合金是用途很广的金属材料,而目前世界上60%的镁就是从海水中按上述流程提取的。
(1)上述流程中为了使MgSO4完全转化为Mg(OH)2,试剂①可以选用__________ (写化学式)。
(2)步骤①包括加热、蒸发、冷却、结晶、____________ 。
(3)通电时无水MgCl2在熔融状态下反应的化学方程式是_______________ 。

请回答:
Ⅰ.从海水中提取的溴占世界溴年产量的三分之一,主要方法就是上述流程中的空气吹出法。
(1)制取Br2时第一次通入Cl2时发生反应的离子方程式是
(2)吸收塔中反应的离子方程式是
(3)取10L海水经过提纯浓缩,向吸收塔吸收后的溶液中加入0.100 mol/L AgNO3溶液8.0 mL恰好完全反应,则海水中含溴的含量为
Ⅱ.镁及其合金是用途很广的金属材料,而目前世界上60%的镁就是从海水中按上述流程提取的。
(1)上述流程中为了使MgSO4完全转化为Mg(OH)2,试剂①可以选用
(2)步骤①包括加热、蒸发、冷却、结晶、
(3)通电时无水MgCl2在熔融状态下反应的化学方程式是
您最近一年使用:0次