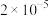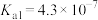黄铁矿石是制取硫酸的主要原料,主要成分为FeS2和少量FeS(假设其它杂质中不含铁、硫元素,且高温下不发生化学变化)。某化学兴趣小组对该黄铁矿石进行如下实验探究。将m1g该黄铁矿石的样品放入如图装置(夹持和加热装置略)的石英管中,从a处不断地缓缓通入空气,高温灼烧黄铁矿样品至反应完全。其反应的化学方程式为4FeS2+11O2=2Fe2O3+8SO2,4FeS+7O2=2Fe2O3+4SO2
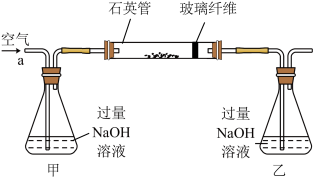
(1)鼓人空气的作用是___________ ,锥形瓶乙中NaOH溶液的作用是___________ 。
【实验一】测定硫元素的含量
反应结束后,将乙瓶中的溶液进行如下处理:
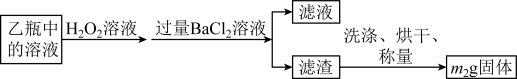
(2)反应结束后,给乙瓶溶液中加入足量H2O2溶液的目的是___________ (用化学方程式表示)。
(3)洗涤滤渣的方法是______________________ 。
(4)该黄铁矿石中硫元素的质量分数为___________ (列出表达式即可)。
【实验二】测定铁元素的含量
①用足量稀硫酸溶解石英管中的固体残渣;②加还原剂使溶液中的Fe3+恰好完全转化为Fe2+后,过滤、洗涤;③将滤液稀释至250mL;④取25.00mL稀释液,用0.1000mol·L-1的酸性KMnO4溶液滴定,三次滴定实验,平均消耗酸性KMnO4溶液25.00mL。
(5)操作②中用铁粉作还原剂,测定铁的含量___________ (填“偏高”或“偏低”或“不变”),操作④中滴定时酸性KMnO4溶液盛装在___________ 填“酸式滴定管”或“碱式滴定管”),③中稀释液中Fe2+的物质的量浓度c(Fe2+)=___________ 。

(1)鼓人空气的作用是
【实验一】测定硫元素的含量
反应结束后,将乙瓶中的溶液进行如下处理:

(2)反应结束后,给乙瓶溶液中加入足量H2O2溶液的目的是
(3)洗涤滤渣的方法是
(4)该黄铁矿石中硫元素的质量分数为
【实验二】测定铁元素的含量
①用足量稀硫酸溶解石英管中的固体残渣;②加还原剂使溶液中的Fe3+恰好完全转化为Fe2+后,过滤、洗涤;③将滤液稀释至250mL;④取25.00mL稀释液,用0.1000mol·L-1的酸性KMnO4溶液滴定,三次滴定实验,平均消耗酸性KMnO4溶液25.00mL。
(5)操作②中用铁粉作还原剂,测定铁的含量
更新时间:2019/04/18 17:06:32
|
相似题推荐
解答题-实验探究题
|
适中
(0.65)
【推荐1】水中Cl-的测定常用硝酸银滴定法,实验步骤及测定原理如下:
I.水样的预处理。
(1)如果水样带有颜色,则需要加入氢氧化铝胶体处理,利用了该胶体的_______ 性。
(2)如果水样耗氧量过高,则需要加入高锰酸钾晶体,煮沸后再加入少量乙醇处理,过程中高锰酸钾表现了______ 性,加入乙醇的目的是:______ 。
II.样品的测定。
将经过处理的水样置于锥形瓶中,加入少量的稀K2CrO4溶液做指示剂,用AgNO3 标准溶液滴定至砖红色沉淀(Ag2CrO4)刚好出现,且半分钟不消失时,即为滴定终点。已知Ksp(AgCl)=1.6 ×10-10,Ksp(Ag2CrO4)=9.0×10-12,Ksp(AgOH)=2.0×10-8。
(3)AgNO3 标准溶液置于棕色_______ 式滴定管中。
(4)实验中需严格控制水样的pH及指示剂的用量,如果pH过高,会使测定结果_____ (填偏高、偏低或不变,下同),如果pH 过低,会使指示剂转化为 Cr2O72-而失效,如果指示剂过多会使测定结果________ 。
(5)取50.00mL水样,用浓度为cmol/ AgNO3标准溶液滴定,到达滴定终点时消耗的体积为VmL,则样品中Cl-的含量为_____ mg/L。
I.水样的预处理。
(1)如果水样带有颜色,则需要加入氢氧化铝胶体处理,利用了该胶体的
(2)如果水样耗氧量过高,则需要加入高锰酸钾晶体,煮沸后再加入少量乙醇处理,过程中高锰酸钾表现了
II.样品的测定。
将经过处理的水样置于锥形瓶中,加入少量的稀K2CrO4溶液做指示剂,用AgNO3 标准溶液滴定至砖红色沉淀(Ag2CrO4)刚好出现,且半分钟不消失时,即为滴定终点。已知Ksp(AgCl)=1.6 ×10-10,Ksp(Ag2CrO4)=9.0×10-12,Ksp(AgOH)=2.0×10-8。
(3)AgNO3 标准溶液置于棕色
(4)实验中需严格控制水样的pH及指示剂的用量,如果pH过高,会使测定结果
(5)取50.00mL水样,用浓度为cmol/ AgNO3标准溶液滴定,到达滴定终点时消耗的体积为VmL,则样品中Cl-的含量为
您最近一年使用:0次
解答题-实验探究题
|
适中
(0.65)
名校
解题方法
【推荐2】回答下列问题
Ⅰ.用中和滴定法测定某烧碱的纯度,试根据实验回答:
(1)称取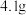 烧碱样品,将样品配成
烧碱样品,将样品配成 待测液,需要的主要玻璃仪器除烧杯、玻璃棒、胶头滴管外还需
待测液,需要的主要玻璃仪器除烧杯、玻璃棒、胶头滴管外还需__________ 。
(2)取 待测液,用
待测液,用___________ 量取。
(3)用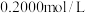 标准盐酸滴定待测烧碱溶液,以酚酞为指示剂,滴定终点的现象是
标准盐酸滴定待测烧碱溶液,以酚酞为指示剂,滴定终点的现象是___________ 。
(4)根据表中数据,计算样品烧碱的质量分数为___________ (结果保留四位有效数字)。
(5)滴定过程,下列情况会使测定结果偏高的是___________ (填序号)。
①记录酸式滴定管起始体积时,仰视读数,终点时俯视
②碱式滴定管水洗后就用来量取待测液
③滴定前,酸式滴定管有气泡,滴定后消失
④取待测液时滴定过快成细流、将碱液溅到锥形瓶壁而又未摇匀洗下
Ⅱ.在常温时,几种酸的电离平衡常数 如下:
如下:
(6)向 溶液中通入少量
溶液中通入少量 的离子方程式为
的离子方程式为___________ 。
Ⅰ.用中和滴定法测定某烧碱的纯度,试根据实验回答:
(1)称取
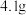 烧碱样品,将样品配成
烧碱样品,将样品配成 待测液,需要的主要玻璃仪器除烧杯、玻璃棒、胶头滴管外还需
待测液,需要的主要玻璃仪器除烧杯、玻璃棒、胶头滴管外还需(2)取
 待测液,用
待测液,用(3)用
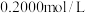 标准盐酸滴定待测烧碱溶液,以酚酞为指示剂,滴定终点的现象是
标准盐酸滴定待测烧碱溶液,以酚酞为指示剂,滴定终点的现象是(4)根据表中数据,计算样品烧碱的质量分数为
滴定次数 | 待测液体积(mL) | 标准盐酸体积(mL) | |
滴定前读数(mL) | 滴定后读数(mL) | ||
第一次 | 10.00 | 0.50 | 20.40 |
第二次 | 10.00 | 4.00 | 24.10 |
第三次 | 10.00 | 5.12 | 28.02 |
①记录酸式滴定管起始体积时,仰视读数,终点时俯视
②碱式滴定管水洗后就用来量取待测液
③滴定前,酸式滴定管有气泡,滴定后消失
④取待测液时滴定过快成细流、将碱液溅到锥形瓶壁而又未摇匀洗下
Ⅱ.在常温时,几种酸的电离平衡常数
 如下:
如下:溶质 |
|
|
|
|
|
|
|
 溶液中通入少量
溶液中通入少量 的离子方程式为
的离子方程式为
您最近一年使用:0次
解答题-实验探究题
|
适中
(0.65)
名校
【推荐3】I.硫酸亚铁 是中学化学常用试剂,可用于治疗缺铁性贫血症。
是中学化学常用试剂,可用于治疗缺铁性贫血症。
(1)实验室配备 溶液时为防止硫酸亚铁变质,常采用的措施是
溶液时为防止硫酸亚铁变质,常采用的措施是_______ (填一种)。
(2)以 为原料可制备碱式硫酸铁
为原料可制备碱式硫酸铁 、铁红、硫酸亚铁铵[
、铁红、硫酸亚铁铵[ ,俗名摩尔盐],转化关系如图1所示。
,俗名摩尔盐],转化关系如图1所示。

①制备 时,若pH过高会导致碱式硫酸铁的产率偏低,其原因是
时,若pH过高会导致碱式硫酸铁的产率偏低,其原因是_______ 。
②制备 时,向
时,向 溶液中加入过量的
溶液中加入过量的 溶液,有气体生成,该反应的离子方程式为
溶液,有气体生成,该反应的离子方程式为_______ 。
Ⅱ.用工业废渣(主要含有 、FeO、
、FeO、 及少量Fe)制备绿矾
及少量Fe)制备绿矾 晶体的流程如下:
晶体的流程如下:
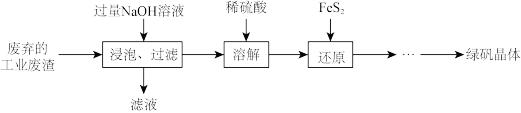
(3)“浸泡过程中加入过量NaOH溶液的目的是_______ 。
(4)“溶解”后所得溶液中含有的阳离子为 和
和_______ 。
(5)“还原时选择 而不用Cu粉的原因是
而不用Cu粉的原因是_______ 。
(6)测定绿矾中 的氧化率实验方案如下:
的氧化率实验方案如下:
步骤一:称取一定质量的绿矾样品,将其溶于适量的无氧蒸馏水并配成250mL溶液;
步骤二:取步骤一中配得的溶液25.00mL于锥形瓶,并加入适量稀硫酸酸化,逐滴滴加0.0400mol/L 溶液至恰好完全反应,反应原理为:
溶液至恰好完全反应,反应原理为: (未配平),消耗
(未配平),消耗 溶液20.00mL;
溶液20.00mL;
步骤三:另取步骤一中配得的溶液25.00mL于烧杯,加入足量氨水,将沉淀过滤、洗涤、干燥,在空气中灼烧至固体质量不再变化,称得残留红棕色固体的质量为0.4g。
(已知: 的氧化率
的氧化率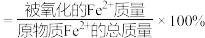 )
)
根据以上数据,计算该绿矾样品中 的氧化率,写出计算过程
的氧化率,写出计算过程______ 。
 是中学化学常用试剂,可用于治疗缺铁性贫血症。
是中学化学常用试剂,可用于治疗缺铁性贫血症。(1)实验室配备
 溶液时为防止硫酸亚铁变质,常采用的措施是
溶液时为防止硫酸亚铁变质,常采用的措施是(2)以
 为原料可制备碱式硫酸铁
为原料可制备碱式硫酸铁 、铁红、硫酸亚铁铵[
、铁红、硫酸亚铁铵[ ,俗名摩尔盐],转化关系如图1所示。
,俗名摩尔盐],转化关系如图1所示。
①制备
 时,若pH过高会导致碱式硫酸铁的产率偏低,其原因是
时,若pH过高会导致碱式硫酸铁的产率偏低,其原因是②制备
 时,向
时,向 溶液中加入过量的
溶液中加入过量的 溶液,有气体生成,该反应的离子方程式为
溶液,有气体生成,该反应的离子方程式为Ⅱ.用工业废渣(主要含有
 、FeO、
、FeO、 及少量Fe)制备绿矾
及少量Fe)制备绿矾 晶体的流程如下:
晶体的流程如下:
(3)“浸泡过程中加入过量NaOH溶液的目的是
(4)“溶解”后所得溶液中含有的阳离子为
 和
和(5)“还原时选择
 而不用Cu粉的原因是
而不用Cu粉的原因是(6)测定绿矾中
 的氧化率实验方案如下:
的氧化率实验方案如下:步骤一:称取一定质量的绿矾样品,将其溶于适量的无氧蒸馏水并配成250mL溶液;
步骤二:取步骤一中配得的溶液25.00mL于锥形瓶,并加入适量稀硫酸酸化,逐滴滴加0.0400mol/L
 溶液至恰好完全反应,反应原理为:
溶液至恰好完全反应,反应原理为: (未配平),消耗
(未配平),消耗 溶液20.00mL;
溶液20.00mL;步骤三:另取步骤一中配得的溶液25.00mL于烧杯,加入足量氨水,将沉淀过滤、洗涤、干燥,在空气中灼烧至固体质量不再变化,称得残留红棕色固体的质量为0.4g。
(已知:
 的氧化率
的氧化率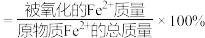 )
)根据以上数据,计算该绿矾样品中
 的氧化率,写出计算过程
的氧化率,写出计算过程
您最近一年使用:0次
解答题-实验探究题
|
适中
(0.65)
解题方法
【推荐1】Ⅰ.实验室利用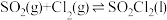
 ,制取磺酰氯
,制取磺酰氯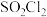 (
( )的装置如图所示(夹持装置略)。已知:
)的装置如图所示(夹持装置略)。已知: 的熔点为
的熔点为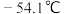 ,沸点为69.1℃,遇水极易反应生成两种酸;E中装有纯净的氯气。
,沸点为69.1℃,遇水极易反应生成两种酸;E中装有纯净的氯气。

回答下列问题:
(1)装置A中a的作用是________ ;图示装置存在一处缺陷,指出改正方法为________________ 。
(2)为提高装置C中反应物的平衡转化率,最佳反应条件为________ (填标号,下同)。
A.冰水浴 B.常温 C.加热至69.1℃ D.沸水浴
从化学平衡角度解释其原因________________ 。
Ⅱ.滴定法测定磺酰氯的纯度:
(3)滴定前,滴定管的正确操作是:检漏→蒸馏水洗涤→________ →开始滴定。
A.装入滴定液至零刻度以上 B.调整滴定液液面至零刻度或零刻度以下
C.排除气泡 D.用滴定液润洗2至3次
E.记录起始读数
(4)取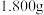 产品,加入到
产品,加入到

 溶液中加热充分水解,冷却后加蒸馏水稀释至
溶液中加热充分水解,冷却后加蒸馏水稀释至 ,取
,取 溶液于锥形瓶中,滴加2滴甲基橙,用
溶液于锥形瓶中,滴加2滴甲基橙,用 盐酸标准溶液滴定至终点,重复实验,结果记录如下:
盐酸标准溶液滴定至终点,重复实验,结果记录如下:
达到滴定终点的现象是________ ,产品的纯度为________ 。
(5)下列操作会导致测定结果偏低的是________。
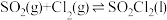
 ,制取磺酰氯
,制取磺酰氯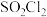 (
( )的装置如图所示(夹持装置略)。已知:
)的装置如图所示(夹持装置略)。已知: 的熔点为
的熔点为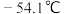 ,沸点为69.1℃,遇水极易反应生成两种酸;E中装有纯净的氯气。
,沸点为69.1℃,遇水极易反应生成两种酸;E中装有纯净的氯气。
回答下列问题:
(1)装置A中a的作用是
(2)为提高装置C中反应物的平衡转化率,最佳反应条件为
A.冰水浴 B.常温 C.加热至69.1℃ D.沸水浴
从化学平衡角度解释其原因
Ⅱ.滴定法测定磺酰氯的纯度:
(3)滴定前,滴定管的正确操作是:检漏→蒸馏水洗涤→
A.装入滴定液至零刻度以上 B.调整滴定液液面至零刻度或零刻度以下
C.排除气泡 D.用滴定液润洗2至3次
E.记录起始读数
(4)取
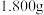 产品,加入到
产品,加入到

 溶液中加热充分水解,冷却后加蒸馏水稀释至
溶液中加热充分水解,冷却后加蒸馏水稀释至 ,取
,取 溶液于锥形瓶中,滴加2滴甲基橙,用
溶液于锥形瓶中,滴加2滴甲基橙,用 盐酸标准溶液滴定至终点,重复实验,结果记录如下:
盐酸标准溶液滴定至终点,重复实验,结果记录如下:| 实验次数 | 第一次 | 第二次 | 第三次 |
| 消耗盐酸标准溶液体积/mL | 10.02 | 9.98 | 11.12 |
(5)下列操作会导致测定结果偏低的是________。
| A.滴定前读数正确,滴定后俯视读数 |
| B.滴定时不慎将盐酸标准溶液滴到锥形瓶外 |
| C.滴定达终点时发现滴定管尖嘴内有气泡生成 |
| D.装盐酸标准溶液的滴定管用蒸馏水洗后没有润洗 |
您最近一年使用:0次
解答题-实验探究题
|
适中
(0.65)
名校
【推荐2】过氧化钙是一种白色固体,常用作杀菌剂、防腐剂。
(1)化学实验小组选用如下装置(部分固定装置略)用钙和氧气制备过氧化钙。
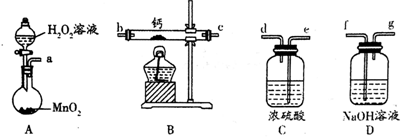
①请选择必要的装置(装置可重复使用),按气流方向连接顺序为__________________ 。(填仪器接口的字母编号)
②连接好装置进行实验,步骤如下:
I.检查装置气密性后,装入药品;
II._____________________ ;
III.点燃B处酒精灯加热药品;反应结束后,_______________________________ ;
Ⅳ.拆除装置,取出产物。
(2)已知化学反应Ca2++H2O2+2NH3+8H2O= CaO2·8H2O↓+2NH4+。在碱性环境中制取CaO2·8H2O的装置如下图:
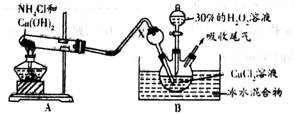
①装置B中仪器X的作用是__________________________________ ;反应在冰水浴中进行的原因是__________________________________________________________ 。
②反应结束后,经________ 、__________ 、低温烘干获得CaO2·8H2O。
(1)化学实验小组选用如下装置(部分固定装置略)用钙和氧气制备过氧化钙。

①请选择必要的装置(装置可重复使用),按气流方向连接顺序为
②连接好装置进行实验,步骤如下:
I.检查装置气密性后,装入药品;
II.
III.点燃B处酒精灯加热药品;反应结束后,
Ⅳ.拆除装置,取出产物。
(2)已知化学反应Ca2++H2O2+2NH3+8H2O= CaO2·8H2O↓+2NH4+。在碱性环境中制取CaO2·8H2O的装置如下图:

①装置B中仪器X的作用是
②反应结束后,经
您最近一年使用:0次
解答题-实验探究题
|
适中
(0.65)
【推荐3】硫酸亚铁铵又称莫尔盐,是浅绿色晶体.它在空气中比一般亚铁盐稳定,是常用的Fe2+试剂.某实验小组利用工业废铁屑制取莫尔盐,并测定其纯度.
已知:①
②莫尔盐在乙醇溶剂中难溶.
Ⅰ.莫尔盐的制取

试分析:
(1)必须在铁屑少量剩余时进行过滤,其原因是______________________ .
(2)步骤3中包含的实验操作名称_____________________ .
(3)产品莫尔盐最后用______________________ 洗涤(填字母编号).
a.蒸馏水 b.乙醇 c.滤液
Ⅱ.为测定硫酸亚铁铵(NH4)2SO4•FeSO4•6H2O晶体纯度,某学生取m g硫酸亚铁铵样品配制成500mL溶液。根据物质组成甲、乙、丙三位同学设计了如下三个实验方案,请回答:
方案一:取20.00mL硫酸亚铁铵溶液用0.1000molL﹣1的酸性KMnO4溶液分三次进行滴定.
方案二:取20.00mL硫酸亚铁铵溶液进行如下实验.

(4)若实验操作都正确,但方案一的测定结果总是小于方案二,其可能原因为_________ ,验证推测的方法为:___________________________________________ 方案三:(通过NH4+测定)实验设计图如下所示.取20.00mL硫酸亚铁铵溶液进行该实验.
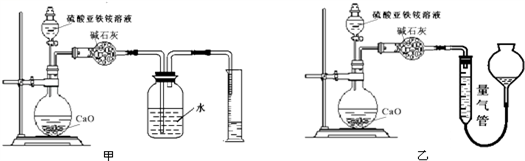
(5)装置___________ (填“甲”或“乙”)较为合理,判断理由是_______________ .
(6)量气管中最佳试剂是__________ (填字母编号.如选“乙”则填此空,如选“甲”此空可不填).
a.水 b.饱和NaHCO3溶液 c.CCl4
(7)若测得NH3的体积为V L(已折算为标准状况下),则该硫酸亚铁铵晶体的纯度为_______ .
已知:①
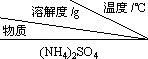 | 10 | 20 | 30 | 40 | 50 | 70 |
(NH4)2SO4 | 73.3 | 75.4 | 78.0 | 81.0 | 84.5 | 91.9 |
FeSO4•7H2O | 40.0 | 48.0 | 60.0 | 73.3 | ﹣ | ﹣ |
| (NH4)2SO4•FeSO4•6H2O | 18.1 | 21.2 | 24.5 | 27.9 | 31.3 | 38.5 |
Ⅰ.莫尔盐的制取

试分析:
(1)必须在铁屑少量剩余时进行过滤,其原因是
(2)步骤3中包含的实验操作名称
(3)产品莫尔盐最后用
a.蒸馏水 b.乙醇 c.滤液
Ⅱ.为测定硫酸亚铁铵(NH4)2SO4•FeSO4•6H2O晶体纯度,某学生取m g硫酸亚铁铵样品配制成500mL溶液。根据物质组成甲、乙、丙三位同学设计了如下三个实验方案,请回答:
方案一:取20.00mL硫酸亚铁铵溶液用0.1000molL﹣1的酸性KMnO4溶液分三次进行滴定.
方案二:取20.00mL硫酸亚铁铵溶液进行如下实验.

(4)若实验操作都正确,但方案一的测定结果总是小于方案二,其可能原因为

(5)装置
(6)量气管中最佳试剂是
a.水 b.饱和NaHCO3溶液 c.CCl4
(7)若测得NH3的体积为V L(已折算为标准状况下),则该硫酸亚铁铵晶体的纯度为
您最近一年使用:0次