键能的大小可用于计算化学反应的反应热(△H)。
(1)利用上表中的数据判断发生反应H2(g) + Cl2(g) = 2HCl(g)过程中,当生成1molHCl气体时需要___ (填“吸收”或“放出” )____ kJ能量。
(2)已知N2 (g)+3H2(g) = 2NH3(g) ΔH=-92 kJ/mol,则N—H键的键能是___ kJ·mol-1。
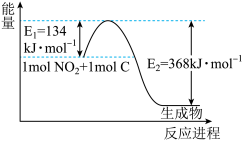
(3)1molNO2气体和1mol CO气体反应生成CO2气体和NO气体过程中能量变化如下图,请写出NO2和CO反应的热化学方程式:____ 。
(4)已知在常温常压下:
①2CH3OH(l)+3O2(g)=2CO2(g)+4H2O(g) ΔH1
②2CO(g)+O2(g)=2CO2(g) ΔH2
③H2O(g)=H2O(l) ΔH3
则CH3OH(l)+O2(g)= CO(g) + 2H2O(l) ΔH=_______ (用含ΔH1、ΔH2、ΔH3的式子表示)。
| 化学键 | Cl-Cl | H—H | H—Cl | N≡N |
| 键能/kJ·mol-1 | 243 | 436 | 431 | 946 |
(1)利用上表中的数据判断发生反应H2(g) + Cl2(g) = 2HCl(g)过程中,当生成1molHCl气体时需要
(2)已知N2 (g)+3H2(g) = 2NH3(g) ΔH=-92 kJ/mol,则N—H键的键能是
(3)1molNO2气体和1mol CO气体反应生成CO2气体和NO气体过程中能量变化如下图,请写出NO2和CO反应的热化学方程式:

(4)已知在常温常压下:
①2CH3OH(l)+3O2(g)=2CO2(g)+4H2O(g) ΔH1
②2CO(g)+O2(g)=2CO2(g) ΔH2
③H2O(g)=H2O(l) ΔH3
则CH3OH(l)+O2(g)= CO(g) + 2H2O(l) ΔH=
更新时间:2019-05-07 14:55:10
|
相似题推荐
计算题
|
适中
(0.65)
名校
【推荐1】回答下列小题
(1)在催化剂作用下,用还原剂[如肼(N2H4)]选择性地与NOx反应生成N2和H2O。
已知200℃时:i.3N2H4(g)=N2(g)+4NH3(g) ΔH1=-32.9kJ·mol-1;
ii.N2H4(g)+H2(g)=2NH3(g) ΔH2=-41.8kJ·mol-1。
①写出肼的电子式:_____ 。
②200℃时,肼分解成氮气和氢气的热化学方程式为_____ 。
(2)研究CO2的利用对促进低碳社会的构建具有重要意义。工业上利用废气中的CO2合成CH3OH,主要有以下反应:
反应Ⅰ:CO2(g)+3H2(g) CH3OH(g)+H2O(g) ΔH1=-49.0kJ·mol-1
CH3OH(g)+H2O(g) ΔH1=-49.0kJ·mol-1
反应Ⅱ:2CO2(g)+6H2(g) CH3OCH3(g)+3H2O(g) ΔH2
CH3OCH3(g)+3H2O(g) ΔH2
反应Ⅲ:CH3OCH3(g)+H2O(g) 2CH3OH(g) ΔH3=+23.4kJ·mol-1
2CH3OH(g) ΔH3=+23.4kJ·mol-1
已知某些化学键的键能数据如下:
氢气中的H—H比甲醇中的C—H_____ (填“强”或“弱”)。用盖斯定律计算反应Ⅱ中的ΔH2=_____ kJ·mol-1
(3)基于Al2O3载氮体的碳基化学链合成氨技术示意图如下。

总反应3C(s)+N2(g)+3H2O(l)=3CO(g)+2NH3(g) ΔH=_____ kJ·mol-1
(4)Kistiakowsky曾研究了NOCl光化学分解反应,在一定频率(ν)光的照射下机理为:
NOCl+hν→NOCl*
NOCl+NOCl*→2NO+Cl2
其中hν表示一个光子能量,NOCl*表示NOCl的激发态。可知,分解1mol的NOCl需要吸收_____ mol的光子。
(1)在催化剂作用下,用还原剂[如肼(N2H4)]选择性地与NOx反应生成N2和H2O。
已知200℃时:i.3N2H4(g)=N2(g)+4NH3(g) ΔH1=-32.9kJ·mol-1;
ii.N2H4(g)+H2(g)=2NH3(g) ΔH2=-41.8kJ·mol-1。
①写出肼的电子式:
②200℃时,肼分解成氮气和氢气的热化学方程式为
(2)研究CO2的利用对促进低碳社会的构建具有重要意义。工业上利用废气中的CO2合成CH3OH,主要有以下反应:
反应Ⅰ:CO2(g)+3H2(g)
 CH3OH(g)+H2O(g) ΔH1=-49.0kJ·mol-1
CH3OH(g)+H2O(g) ΔH1=-49.0kJ·mol-1反应Ⅱ:2CO2(g)+6H2(g)
 CH3OCH3(g)+3H2O(g) ΔH2
CH3OCH3(g)+3H2O(g) ΔH2反应Ⅲ:CH3OCH3(g)+H2O(g)
 2CH3OH(g) ΔH3=+23.4kJ·mol-1
2CH3OH(g) ΔH3=+23.4kJ·mol-1已知某些化学键的键能数据如下:
| 化学键 | C=O | C—O | O—H |
键能/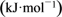 | 750 | 343 | 465 |
(3)基于Al2O3载氮体的碳基化学链合成氨技术示意图如下。

总反应3C(s)+N2(g)+3H2O(l)=3CO(g)+2NH3(g) ΔH=
(4)Kistiakowsky曾研究了NOCl光化学分解反应,在一定频率(ν)光的照射下机理为:
NOCl+hν→NOCl*
NOCl+NOCl*→2NO+Cl2
其中hν表示一个光子能量,NOCl*表示NOCl的激发态。可知,分解1mol的NOCl需要吸收
您最近一年使用:0次
计算题
|
适中
(0.65)
名校
【推荐2】已知下列热化学方程式:
①Fe2O3(s)+3CO(g)═2Fe(s)+3CO2(g) △H1=-25kJ•mol-1;
②3Fe2O3(s)+CO(g)═2Fe3O4(s)+CO2(g) △H2=-47kJ•mol-1;
③Fe3O4(s)+CO(g)═3FeO(s)+CO2(g) △H3=+19kJ•mol-1.
写出FeO(s)被CO还原成Fe和CO2的热化学方程式__ 。
①Fe2O3(s)+3CO(g)═2Fe(s)+3CO2(g) △H1=-25kJ•mol-1;
②3Fe2O3(s)+CO(g)═2Fe3O4(s)+CO2(g) △H2=-47kJ•mol-1;
③Fe3O4(s)+CO(g)═3FeO(s)+CO2(g) △H3=+19kJ•mol-1.
写出FeO(s)被CO还原成Fe和CO2的热化学方程式
您最近一年使用:0次
计算题
|
适中
(0.65)
名校
解题方法
【推荐3】苯乙烯(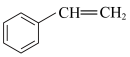 )常用来合成橡胶,还广泛应用于制药、染料、农药等行业,是石化行业的重要基础原料,苯乙烯与各物质之间反应的能量变化如下:
)常用来合成橡胶,还广泛应用于制药、染料、农药等行业,是石化行业的重要基础原料,苯乙烯与各物质之间反应的能量变化如下:
I.


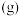

II.

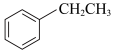
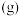
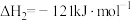
III.


IV.

回答下列问题:
(1)①根据上述反应计算得△H3=___________ kJ/mol。
②设NA为阿伏加德罗常数的值。反应II每生成5.3 g苯乙烷,放出的热量为___________ kJ,转移的电子数为___________ NA。
(2)相关化学键的键能数据如下表所示。
①x=___________ 。
②完全燃烧5.2 g苯乙烯,消耗氧气___________ mol。
 )常用来合成橡胶,还广泛应用于制药、染料、农药等行业,是石化行业的重要基础原料,苯乙烯与各物质之间反应的能量变化如下:
)常用来合成橡胶,还广泛应用于制药、染料、农药等行业,是石化行业的重要基础原料,苯乙烯与各物质之间反应的能量变化如下:I.




II.



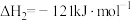
III.



IV.
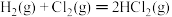

回答下列问题:
(1)①根据上述反应计算得△H3=
②设NA为阿伏加德罗常数的值。反应II每生成5.3 g苯乙烷,放出的热量为
(2)相关化学键的键能数据如下表所示。
| 化学键 | Cl-Cl | H-Cl | H-H |
| 键能/(kJ/mol) | 243 | x | 436 |
②完全燃烧5.2 g苯乙烯,消耗氧气
您最近一年使用:0次
计算题
|
适中
(0.65)
解题方法
【推荐1】(1)二甲醚(CH3OCH3)重整制取H2,具有无毒、无刺激性等优点。CH3OCH3和O2发生反应ⅠCH3OCH3(g)+ O2(g)=2CO(g)+3H2(g) ΔH,已知:①CH3OCH3(g)=CO(g)+H2(g)+CH4(g) ΔH1;②CH4(g)+
O2(g)=2CO(g)+3H2(g) ΔH,已知:①CH3OCH3(g)=CO(g)+H2(g)+CH4(g) ΔH1;②CH4(g)+ O2(g)=CO(g)+2H2O(g) ΔH2;③H2(g)+
O2(g)=CO(g)+2H2O(g) ΔH2;③H2(g)+ O2(g)=H2O(g) ΔH3,则反应Ⅰ的ΔH=
O2(g)=H2O(g) ΔH3,则反应Ⅰ的ΔH=_____ (用含ΔH1、ΔH2、ΔH3的代数式表示)。
(2)CO2与CH4经催化重整,制得合成气:CH4(g)+ CO2(g)=2CO (g)+ 2H2(g),已知上述反应中相关的化学键键能数据如下,则该反应的ΔH=______ 。
 O2(g)=2CO(g)+3H2(g) ΔH,已知:①CH3OCH3(g)=CO(g)+H2(g)+CH4(g) ΔH1;②CH4(g)+
O2(g)=2CO(g)+3H2(g) ΔH,已知:①CH3OCH3(g)=CO(g)+H2(g)+CH4(g) ΔH1;②CH4(g)+ O2(g)=CO(g)+2H2O(g) ΔH2;③H2(g)+
O2(g)=CO(g)+2H2O(g) ΔH2;③H2(g)+ O2(g)=H2O(g) ΔH3,则反应Ⅰ的ΔH=
O2(g)=H2O(g) ΔH3,则反应Ⅰ的ΔH=(2)CO2与CH4经催化重整,制得合成气:CH4(g)+ CO2(g)=2CO (g)+ 2H2(g),已知上述反应中相关的化学键键能数据如下,则该反应的ΔH=
| 化学键 | C-H | C=O | H-H | 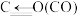 |
键能( ) ) | 413 | 745 | 436 | 1075 |
您最近一年使用:0次
计算题
|
适中
(0.65)
解题方法
【推荐2】(1)沼气是一种能源,它的主要成分是CH4,常温下,0.5molCH4完全燃烧生成CO2(g)和液态水时,放出445kJ热量,则热化学方程式为__ 。
(2)已知: N2(g)+
N2(g)+ H2(g)=N(g)+3H(g) ΔH1=+akJ·mol-1
H2(g)=N(g)+3H(g) ΔH1=+akJ·mol-1
N(g)+3H(g)=NH3(g) ΔH2=-bkJ·mol-1
NH3(g)=NH3(l) ΔH3=-ckJ·mol-1
写出N2(g)和H2(g)反应生成液氨的热化学方程式__ 。
(3)SF6是一种优良的绝缘气体,分子结构中,只存在S-F键,已知1molS(s)转化为气态硫原子吸收能量280kJ,F-F键能为160kJ·mol-1,S-F键能为330kJ·mol-1,试写出S(s)和F2(g)反应生成SF6(g)的热化学方程式__ 。
(2)已知:
 N2(g)+
N2(g)+ H2(g)=N(g)+3H(g) ΔH1=+akJ·mol-1
H2(g)=N(g)+3H(g) ΔH1=+akJ·mol-1N(g)+3H(g)=NH3(g) ΔH2=-bkJ·mol-1
NH3(g)=NH3(l) ΔH3=-ckJ·mol-1
写出N2(g)和H2(g)反应生成液氨的热化学方程式
(3)SF6是一种优良的绝缘气体,分子结构中,只存在S-F键,已知1molS(s)转化为气态硫原子吸收能量280kJ,F-F键能为160kJ·mol-1,S-F键能为330kJ·mol-1,试写出S(s)和F2(g)反应生成SF6(g)的热化学方程式
您最近一年使用:0次
计算题
|
适中
(0.65)
【推荐3】按要求回答下列问题:
(1)已知拆开 键、
键、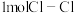 键、
键、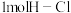 键分别需要吸收的能量为
键分别需要吸收的能量为 、
、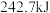 、
、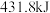 。则由
。则由 和
和 反应生成1molHCl需要
反应生成1molHCl需要_______  填“放出”或“吸收”
填“放出”或“吸收”
_________  的热量。
的热量。
(2)将等物质的量的A和B,混合于2 L的密闭容器中,发生如下反应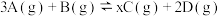 。2min后,测得D的浓度为
。2min后,测得D的浓度为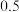 mol/L ,
mol/L ,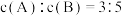 ,C的反应速率是
,C的反应速率是 mol/(L·min)。则:
mol/(L·min)。则:
①x的值是__________ ;
②B的平均反应速率是____________ ;
③A在2min末的浓度是________________ ;
(1)已知拆开
 键、
键、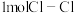 键、
键、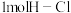 键分别需要吸收的能量为
键分别需要吸收的能量为 、
、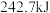 、
、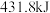 。则由
。则由 和
和 反应生成1molHCl需要
反应生成1molHCl需要 填“放出”或“吸收”
填“放出”或“吸收”
 的热量。
的热量。(2)将等物质的量的A和B,混合于2 L的密闭容器中,发生如下反应
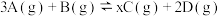 。2min后,测得D的浓度为
。2min后,测得D的浓度为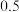 mol/L ,
mol/L ,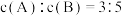 ,C的反应速率是
,C的反应速率是 mol/(L·min)。则:
mol/(L·min)。则:①x的值是
②B的平均反应速率是
③A在2min末的浓度是
您最近一年使用:0次
【推荐1】汽车尾气中主要污染物是NOx和CO,它们是现代化城市中的重要大气污染物。
(1)汽车发动机工作时会引发N2和O2反应生成NO,其能量变化如图1所示,则图1中三种分子最稳定的是___________ ,图1中对应反应的热化学方程式为___________ 。
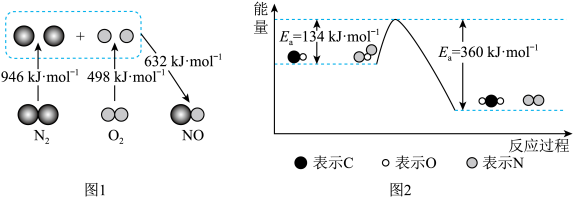
(2)N2O和CO均是有害气体,可在Pt2O+表面转化为无害气体,其反应原理如下:CO(g)+N2O(g) N2(g)+CO2(g) △H。有关化学反应的能量变化过程如图2所示。
N2(g)+CO2(g) △H。有关化学反应的能量变化过程如图2所示。
①图2中反应是___________ (填“放热”或“吸热”)反应,该反应的活化能为___________ ,该反应的△H=___________ 。
②加入Pt2O+作为该反应的催化剂,则Ea___________ (填“增大”“减小”或“不变”,下同),△H___________ 。
(3)利用NH3还原法可将NOx,还原为N2进行脱除。已知:4NH3(g)+6NO(g)=5N2(g)+6H2O(g) △H=-2070 kJ∙mol-1,若有0.5molNO被还原,放出的热量为___________ 。
(1)汽车发动机工作时会引发N2和O2反应生成NO,其能量变化如图1所示,则图1中三种分子最稳定的是

(2)N2O和CO均是有害气体,可在Pt2O+表面转化为无害气体,其反应原理如下:CO(g)+N2O(g)
 N2(g)+CO2(g) △H。有关化学反应的能量变化过程如图2所示。
N2(g)+CO2(g) △H。有关化学反应的能量变化过程如图2所示。①图2中反应是
②加入Pt2O+作为该反应的催化剂,则Ea
(3)利用NH3还原法可将NOx,还原为N2进行脱除。已知:4NH3(g)+6NO(g)=5N2(g)+6H2O(g) △H=-2070 kJ∙mol-1,若有0.5molNO被还原,放出的热量为
您最近一年使用:0次
【推荐2】2SO2(g)+O2(g) 2SO3(g)反应过程的能量变化如图所示。已知1 mol SO2(g)氧化为1 mol SO3的ΔH=-99 kJ·mol-1,请回答下列问题:
2SO3(g)反应过程的能量变化如图所示。已知1 mol SO2(g)氧化为1 mol SO3的ΔH=-99 kJ·mol-1,请回答下列问题:

(1)E的大小对该反应的反应热有无影响?__________ ,该反应通常用V2O5作催化剂,加V2O5会使图中B点升高还是降低?__________ 。
(2)图中△H=__________ kJ·mol-1。
(3)已知单质硫的燃烧热为296 kJ·mol-1,计算由S(s)生成1 mol SO3(g)放出的热量为__________ kJ。
 2SO3(g)反应过程的能量变化如图所示。已知1 mol SO2(g)氧化为1 mol SO3的ΔH=-99 kJ·mol-1,请回答下列问题:
2SO3(g)反应过程的能量变化如图所示。已知1 mol SO2(g)氧化为1 mol SO3的ΔH=-99 kJ·mol-1,请回答下列问题:
(1)E的大小对该反应的反应热有无影响?
(2)图中△H=
(3)已知单质硫的燃烧热为296 kJ·mol-1,计算由S(s)生成1 mol SO3(g)放出的热量为
您最近一年使用:0次
计算题
|
适中
(0.65)
名校
【推荐3】低碳经济成为人们一种新的生活理念,二氧化碳的捕捉和利用是能源领域的一个重要研究方向。结合下列有关图示和所学知识回答:
(1)用 催化加氢可以制取乙烯:
催化加氢可以制取乙烯: 。若该反应体系的能量随反应过程变化关系如图所示,则该反应的
。若该反应体系的能量随反应过程变化关系如图所示,则该反应的
_______ (用含a、b的式子表示)。又知:相关化学键的键能如下表所示,实验测得上述反应的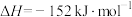 ,则表中的x=
,则表中的x=_______ 。
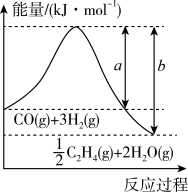
注:乙烯结构如图: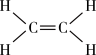
(2)用 表示阿伏加德罗常数,在
表示阿伏加德罗常数,在 (气态)完全燃烧生成
(气态)完全燃烧生成 和液态水的反应中,每有
和液态水的反应中,每有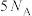 个电子转移时,放出
个电子转移时,放出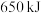 的热量。其燃烧热的热化学方程式为
的热量。其燃烧热的热化学方程式为_______ 。
(3)二氧化碳的捕集、利用是我国能源领域的一个重要战略方向。
①科学家提出由 制取C的太阳能工艺如图所示。
制取C的太阳能工艺如图所示。
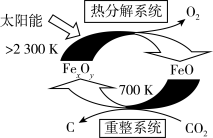
已知“重整系统”发生的反应中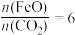 ,则
,则 的化学式为
的化学式为_______ 。“热分解系统”中每分解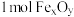 ,转移电子的物质的量为
,转移电子的物质的量为_______ mol。
②工业上用 和
和 反应合成二甲醚。已知:
反应合成二甲醚。已知: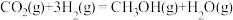
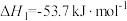 ,
,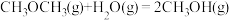
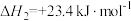 ,则
,则
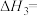
_______  。
。
(1)用
 催化加氢可以制取乙烯:
催化加氢可以制取乙烯: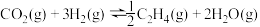 。若该反应体系的能量随反应过程变化关系如图所示,则该反应的
。若该反应体系的能量随反应过程变化关系如图所示,则该反应的
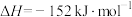 ,则表中的x=
,则表中的x=
| 化学键 |  |  | 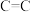 |  |  |
键能/ | 803 | 436 | x | 414 | 464 |
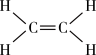
(2)用
 表示阿伏加德罗常数,在
表示阿伏加德罗常数,在 (气态)完全燃烧生成
(气态)完全燃烧生成 和液态水的反应中,每有
和液态水的反应中,每有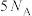 个电子转移时,放出
个电子转移时,放出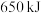 的热量。其燃烧热的热化学方程式为
的热量。其燃烧热的热化学方程式为(3)二氧化碳的捕集、利用是我国能源领域的一个重要战略方向。
①科学家提出由
 制取C的太阳能工艺如图所示。
制取C的太阳能工艺如图所示。
已知“重整系统”发生的反应中
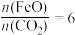 ,则
,则 的化学式为
的化学式为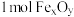 ,转移电子的物质的量为
,转移电子的物质的量为②工业上用
 和
和 反应合成二甲醚。已知:
反应合成二甲醚。已知: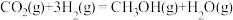
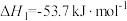 ,
,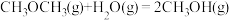
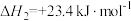 ,则
,则
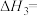
 。
。
您最近一年使用:0次



