判断强弱电解质的标准是( )
| A.导电能力 | B.相对分子质量 | C.电离程度 | D.溶解度 |
11-12高二上·河北保定·期中 查看更多[19]
(已下线)2011-2012学年河北省涿州二中高二上学期期中考试化学试卷(已下线)2011-2012学年黑龙江省绥棱县第一中学高二上学期期末考试化学试卷2015-2016学年湖北孝感高级中学高二上期中测试化学试卷(已下线)同步君 选修4 第3章 第1节 弱电解质的电离2016-2017学年新疆兵团第二师华山中学高二下学期学前考试化学试卷高中化学人教版 选修四 第三章 水溶液中的离子反应 第一节 弱电解质的电离 弱电解质的电离云南省中央民族大学附属中学芒市国际学校2017-2018学年高二上学期末考试化学试题【全国市级联考】四川省雅安市2017-2018学年高二下学期期末考试化学试题(已下线)2018年10月6日 《每日一题》人教选修4--周末培优【全国百强校】内蒙古自治区杭锦后旗奋斗中学2018-2019学年高二下学期期中考试化学试题(已下线)2019年9月27日 《每日一题》选修4—— 强电解质与弱电解质的判断上海2018年高一下-同步练习卷-7.1 《电解质的电离》吉林省吉林市第五十五中学2019-2020学年高二上学期期中考试化学试题吉林省蛟河市朝鲜族中学校2019-2020学年高二上学期期中考试化学试题陕西省咸阳市2017~2018学年高二上学期期末考试化学试题重庆市开州区陈家中学2020-2021学年高二10月月考化学试题吉林省吉林市江城中学2020-2021学年高二上学期期中考试化学(理)试题浙江省天台县育才中学2021-2022学年高二上学期第一次月考试卷化学试题(已下线)2022年浙江省6月高考真题变式题1-10
更新时间:2019-05-26 10:21:14
|
相似题推荐
单选题
|
适中
(0.65)
解题方法
【推荐1】已知:25℃,A-(aq)+HB(aq)⇌HA(aq)+B-(aq) △H=+9.1kJ/mol(HA、HB为两种一元酸)。通过计算,该过程正向自发,下列说法正确的是
| A.由于此过程△H>0,故HB比HA更稳定 |
| B.相对于B-,A-与质子的结合能力更强 |
| C.体积和物质的量浓度均相同的NaA和NaB两溶液中,前者离子总数更多 |
| D.该过程△S一定小于0,且其大小是决定此过程是否能够自发的主要因素 |
您最近一年使用:0次
单选题
|
适中
(0.65)
名校
【推荐2】下列事实中能说明醋酸是弱电解质的是
| A.用醋酸溶液作导电实验,灯光较暗 |
| B.醋酸(CH3COOH)是共价化合物 |
| C.醋酸不与氯化钠反应 |
| D.常温下1 mol・L-1醋酸溶液的c(H+)约为0.004 mol·L-1 |
您最近一年使用:0次
单选题
|
适中
(0.65)
名校
【推荐1】下列说法正确的是
| A.熔融状态下不能导电的化合物是非电解质 |
B.方程式:BaSO4(s)  Ba2++SO42-表示硫酸钡的电离 Ba2++SO42-表示硫酸钡的电离 |
| C.微粒直径在1~100nm之间的物质属于胶体 |
| D.由2CH3COOH+Pb(NO3)2 =Pb(CH3COO)2+2HNO3产物均易溶,可知盐类不都是强电解质 |
您最近一年使用:0次
单选题
|
适中
(0.65)
名校
解题方法
【推荐2】下表中根据实验操作能达到实验目的的是
| 选项 | 实验操作 | 实验目的 |
| A | 常温下,向 的醋酸溶液中加入少量醋酸铵固体,溶液的pH变大 的醋酸溶液中加入少量醋酸铵固体,溶液的pH变大 | 检验醋酸铵溶液的酸碱性 |
| B | 向 溶液中滴加酸性 溶液中滴加酸性 溶液, 溶液, 溶液褪色 溶液褪色 | 证明 具有还原性 具有还原性 |
| C | 分别用pH试纸测定同浓度的 溶液和 溶液和 溶液的pH 溶液的pH | 酸性: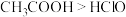 |
| D | 分别测定同浓度 溶液和 溶液和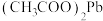 溶液的导电性 溶液的导电性 | 证明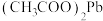 是弱电解质 是弱电解质 |
| A.A | B.B | C.C | D.D |
您最近一年使用:0次



