碘及其化合物在合成杀菌剂、药物、化学研究等方面具有广泛用途。
(1)为了探究FeCl3溶液和KI溶液的反应是否存在一定的限度,取5mL0.5mol·L-1 KI溶液,向其中加入0.1 mol·L-1FeCl3溶液1 mL,充分反应。下列实验操作能验证该反应是否存在限度的是___ 。
A.再滴加AgNO3溶液,观察是否有黄色沉淀产生
B.再加入CCl4振荡后,观察下层液体颜色是否变为紫红色
C.再加入CCl4振荡后,取上层清液,滴加AgNO3溶液,观察是否有白色沉淀产生
D.再加入CCl4振荡后,取上层清液,滴加KSCN溶液,观察溶液是否变成血红色
(2)已知1molH2(g)、1molI2(g)、1molHI(g)分子中化学键断裂时分别需要吸收436kJ、151kJ、 300kJ的能量,则氢气和碘蒸气反应生成HI气体的热化学方程式为_____ 。
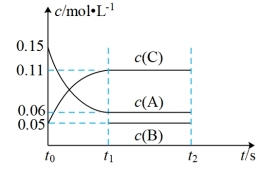
(3)Bodensteins研究了下列反应:2HI(g) H2(g) +I2(g),在716K,容积固定为2L的密闭容器中,气体混合物中碘化氢的物质的量n(HI)与反应时间t的关系如下表:
H2(g) +I2(g),在716K,容积固定为2L的密闭容器中,气体混合物中碘化氢的物质的量n(HI)与反应时间t的关系如下表:
0min到20min HI的平均反应速率为_______ ;
反应到达40min时,剩余HI 的物质的量____ 0.82mol(填“﹥” “﹤”或“=”)。
(1)为了探究FeCl3溶液和KI溶液的反应是否存在一定的限度,取5mL0.5mol·L-1 KI溶液,向其中加入0.1 mol·L-1FeCl3溶液1 mL,充分反应。下列实验操作能验证该反应是否存在限度的是
A.再滴加AgNO3溶液,观察是否有黄色沉淀产生
B.再加入CCl4振荡后,观察下层液体颜色是否变为紫红色
C.再加入CCl4振荡后,取上层清液,滴加AgNO3溶液,观察是否有白色沉淀产生
D.再加入CCl4振荡后,取上层清液,滴加KSCN溶液,观察溶液是否变成血红色
(2)已知1molH2(g)、1molI2(g)、1molHI(g)分子中化学键断裂时分别需要吸收436kJ、151kJ、 300kJ的能量,则氢气和碘蒸气反应生成HI气体的热化学方程式为
(3)Bodensteins研究了下列反应:2HI(g)
 H2(g) +I2(g),在716K,容积固定为2L的密闭容器中,气体混合物中碘化氢的物质的量n(HI)与反应时间t的关系如下表:
H2(g) +I2(g),在716K,容积固定为2L的密闭容器中,气体混合物中碘化氢的物质的量n(HI)与反应时间t的关系如下表:| t/min | 0 | 20 | 40 |
| n(HI) | 1 | 0.91 | n |
反应到达40min时,剩余HI 的物质的量
更新时间:2019-06-06 08:41:01
|
相似题推荐
填空题
|
适中
(0.65)
解题方法
【推荐1】1909年,化学家哈伯用N2和H2在高温高压条件下首次合成了氨气,反应原理为 ,该反应的能量变化如图所示(a、b均大于零),回答下列问题:
,该反应的能量变化如图所示(a、b均大于零),回答下列问题:
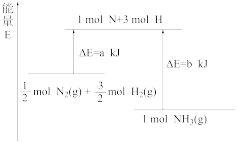
(1)根据图示可知,该反应为___________ (填“吸热”或“放热”)反应,写出生成2molNH3时的热化学方程式:___________ 。
(2)在500℃、30MPa下,断裂1molH-H键、1molN-H键、1molN≡N键需要吸收的能量分别为436kJ、391 kJ、946.5 kJ。
①每消耗0.6molN2时,该反应放出的热量为___________ 。
②向某一密闭容器中充入1.5molH2(g)和0.5molN2(g),在催化剂条件下进行上述反应,此时断裂的H-H吸收的热是___________ (填“>”、“<”或“=”)654kJ,原因是___________ 。
③加入催化剂,该反应的
___________ (填“变大”、“变小”或“不变”),原因是___________ 。
 ,该反应的能量变化如图所示(a、b均大于零),回答下列问题:
,该反应的能量变化如图所示(a、b均大于零),回答下列问题:
(1)根据图示可知,该反应为
(2)在500℃、30MPa下,断裂1molH-H键、1molN-H键、1molN≡N键需要吸收的能量分别为436kJ、391 kJ、946.5 kJ。
①每消耗0.6molN2时,该反应放出的热量为
②向某一密闭容器中充入1.5molH2(g)和0.5molN2(g),在催化剂条件下进行上述反应,此时断裂的H-H吸收的热是
③加入催化剂,该反应的

您最近一年使用:0次
填空题
|
适中
(0.65)
名校
解题方法
【推荐2】从能量的角度看,断开化学键要________ , 形成化学键要________ . 已知拆开1mol H﹣H键、1mol I﹣I、1mol H﹣I键分别需要吸收的能量为436kJ、151k J、299k J.则由氢气和碘反应生成1mol HI需要________ (填“放出”或“吸收”)_________ k J的热量.当反应物的总能量高于生成物总能量时,该反应为________ 反应;当反应物的总能量低于生成物总能量时,该反应为______ 反应.
您最近一年使用:0次
填空题
|
适中
(0.65)
【推荐3】回答下列问题:
(1)写出下列反应的热化学方程式:
①32g铜粉在足量氧气中反应生成氧化铜固体时放出78.5kJ热量:____ 。
②一氧化碳气体还原Fe3O4得到1mol单质铁时放出14.7kJ热量:____ 。
(2)工业上用CO生产燃料甲醇,一定条件下发生反应:CO(g)+2H2(g)=CH3OH(g),反应过程中的能量变化情况如图所示。
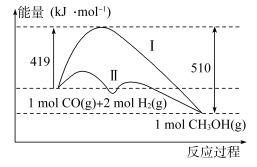
①曲线Ⅰ和曲线Ⅱ分别表示不使用催化剂和使用催化剂的两种情况。计算当反应生成1.5molCH3OH(g)时,能量变化值是____ kJ。
②选择适宜的催化剂____ (填“能”或“不能”)改变该反应的反应热。
(3)断开1molH—H键、1molN—H键、1molN≡N键分别需要吸收能量为436kJ、391kJ、946kJ,则1molH2与足量N2反应生成NH3需____ (填“吸收”或“放出”)能量____ kJ。(小数点后保留两位数字),事实上,反应的热量总小于理论值,理由是____ 。
(1)写出下列反应的热化学方程式:
①32g铜粉在足量氧气中反应生成氧化铜固体时放出78.5kJ热量:
②一氧化碳气体还原Fe3O4得到1mol单质铁时放出14.7kJ热量:
(2)工业上用CO生产燃料甲醇,一定条件下发生反应:CO(g)+2H2(g)=CH3OH(g),反应过程中的能量变化情况如图所示。

①曲线Ⅰ和曲线Ⅱ分别表示不使用催化剂和使用催化剂的两种情况。计算当反应生成1.5molCH3OH(g)时,能量变化值是
②选择适宜的催化剂
(3)断开1molH—H键、1molN—H键、1molN≡N键分别需要吸收能量为436kJ、391kJ、946kJ,则1molH2与足量N2反应生成NH3需
您最近一年使用:0次
填空题
|
适中
(0.65)
名校
解题方法
【推荐1】某温度时,在2L恒容容器中X、Y、Z三种物质随时间的变化关系曲线如图所示。
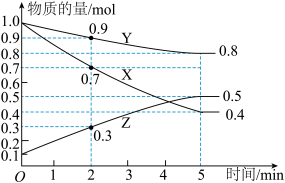
(1)由图中的数据分析,该反应的化学方程式为___ 。
(2)反应开始至2min、5min时,Z的平均反应速率分别为___ 、___ 。
(3)5min后Z的生成速率___ (填“大于”“小于”或“等于”)5min末Z的生成速率。

(1)由图中的数据分析,该反应的化学方程式为
(2)反应开始至2min、5min时,Z的平均反应速率分别为
(3)5min后Z的生成速率
您最近一年使用:0次
填空题
|
适中
(0.65)
【推荐2】某温度时,在0.5 L密闭容器中,某一反应中A、B气体的物质的量随时间变化的曲线如图所示,回答下列问题:_______ 。
(2)第4 min时,正、逆反应速率的大小关系为:v(正)_______ v(逆),(填“>”“<”或“=”)。
(3)下列措施能加快反应速率的是_______。
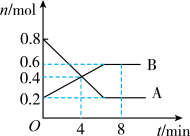
(2)第4 min时,正、逆反应速率的大小关系为:v(正)
(3)下列措施能加快反应速率的是_______。
| A.恒温恒容充入He气 | B.缩小体积,使压强增大 |
| C.恒温恒压充入He气 | D.使用催化剂 |
您最近一年使用:0次
填空题
|
适中
(0.65)
解题方法
【推荐3】(1)反应3Fe(S)+4H2O(g)=Fe3O4(s)+4H2(g)在一可变的容积的密闭容器中进行,试回答:
①增加Fe的量,其正反应速率的变化是_______ (填增大、不变、减小,以下相同)
②将容器的体积缩小一半,其正反应速率________
③保持体积不变,充入N2使体系压强增大,其正反应速率________ 。
④保持压强不变,充入N2使容器的体积增大,其正反应速率_______ 。
(2)将等物质的量的A和B,混合于2 L的密闭容器中,发生如下反应:
3A(g)+B(g) ⇌ xC(g)+2D(g),5 min后测得c(D)=0.5 mol·L-1,c(A)∶c(B)=3∶5,C的反应速率是0.1 mol·L-1·min-1。
①A在5 min末的浓度是___________ 。② v(B) =___________ 。 ③ x=_______ 。
①增加Fe的量,其正反应速率的变化是
②将容器的体积缩小一半,其正反应速率
③保持体积不变,充入N2使体系压强增大,其正反应速率
④保持压强不变,充入N2使容器的体积增大,其正反应速率
(2)将等物质的量的A和B,混合于2 L的密闭容器中,发生如下反应:
3A(g)+B(g) ⇌ xC(g)+2D(g),5 min后测得c(D)=0.5 mol·L-1,c(A)∶c(B)=3∶5,C的反应速率是0.1 mol·L-1·min-1。
①A在5 min末的浓度是
您最近一年使用:0次
填空题
|
适中
(0.65)
名校
【推荐1】完成下列问题。
(1)在已达到平衡的可逆反应2SO2(g)+O2(g)⇌2SO3(g)的体系中,充入由18O组成的氧气一段时间后,18O存在下列物质中的___________。(填序号,下同)
(2)在容积为2L的密闭容器中充入2molSO2和一定量O2,发生反应2SO2+O2⇌2SO3,当反应进行到4min时,测得n(SO2)=0.4mol。则反应进行到2min时,容器中SO2的物质的量是___________。
(3)①下图表示在密闭容器中反应:2SO2+O2⇌2SO3,△H<0达到平衡时,由于条件改变而引起反应速率和化学平衡的变化情况,t3—t5过程中改变的条件可能是___________ ;
②t7时刻,若c(SO3)减小,反应速率变化情况画在下图中___________ 。
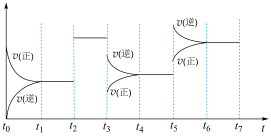
(4)在上图中,t2—t7时间段内,反应物转化率最低的时间段是___________ 。
(5)恒压(1.01×105Pa)下,将2molSO2与amolO2的混合气体通入一个容积可变的密闭容器中,发生如下反应:2SO2(g)+O2(g)⇌2SO3(g),△H<0,T1℃下反应达平衡时,测得容器内n(SO3)=1.3mol,n(O2)=3.0mol,则a=_________ ;平衡时该反应平衡常数为_________ 。(保留两位有效数字)
(1)在已达到平衡的可逆反应2SO2(g)+O2(g)⇌2SO3(g)的体系中,充入由18O组成的氧气一段时间后,18O存在下列物质中的___________。(填序号,下同)
| A.SO2 | B.O2 | C.SO3 | D.SO2、SO3、O2 |
| A.等于1.6mol | B.等于1.2mol | C.大于1.6mol | D.小于1.2mol |
②t7时刻,若c(SO3)减小,反应速率变化情况画在下图中

(4)在上图中,t2—t7时间段内,反应物转化率最低的时间段是
(5)恒压(1.01×105Pa)下,将2molSO2与amolO2的混合气体通入一个容积可变的密闭容器中,发生如下反应:2SO2(g)+O2(g)⇌2SO3(g),△H<0,T1℃下反应达平衡时,测得容器内n(SO3)=1.3mol,n(O2)=3.0mol,则a=
您最近一年使用:0次
填空题
|
适中
(0.65)
名校
【推荐2】氨气是重要的化工原料,工业合成氨反应原理为: ,其反应过程中能量变化如图所示。
,其反应过程中能量变化如图所示。
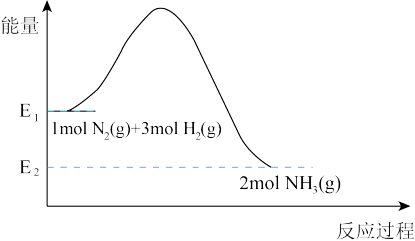
(1)工业合成氨的条件是___________ 。
(2)合成氨的反应是___________ 反应(填“吸热”或“放热”)。
(3)若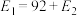 ,则每消耗
,则每消耗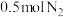 ,反应放出(或吸收)的热量
,反应放出(或吸收)的热量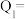
___________ kJ。
(4)将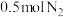 和
和 充入密闭容器中,在相同条件下发生该反应,达到平衡时,放出或吸收的热量为
充入密闭容器中,在相同条件下发生该反应,达到平衡时,放出或吸收的热量为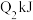 ,则
,则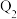
___________  (填“>”“<”或“=”),理由是
(填“>”“<”或“=”),理由是___________ 。
 ,其反应过程中能量变化如图所示。
,其反应过程中能量变化如图所示。
(1)工业合成氨的条件是
(2)合成氨的反应是
(3)若
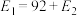 ,则每消耗
,则每消耗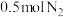 ,反应放出(或吸收)的热量
,反应放出(或吸收)的热量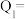
(4)将
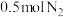 和
和 充入密闭容器中,在相同条件下发生该反应,达到平衡时,放出或吸收的热量为
充入密闭容器中,在相同条件下发生该反应,达到平衡时,放出或吸收的热量为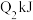 ,则
,则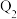
 (填“>”“<”或“=”),理由是
(填“>”“<”或“=”),理由是
您最近一年使用:0次