A、B、C、D、E、F是六种短周期元素,它们的原子序数依次增大;A元素的原子是半径最小的原子;B元素的最高价氧化物对应水化物与其气态氢化物反应生成一种盐X;D与A同主族,且与F同周期;F元素的最外层电子数是其次外层电子数的3/4倍,A、B、D、F这四种元素,每一种与C元素都能形成元素的原子个数比不相同的若干种化合物。D、E、F三种元素对应的最高价氧化物的水化物间两两皆能反应。
请回答下列问题:
(1)写出B、C、E元素的名称B_________ 、C___________ 、E____________ ;
(2)写出C、D两种元素形成的原子个数比为1:1的物质的电子式为_______________ ;
(3)可以验证C和F两种元素非金属性强弱的结论是(填编号)_________________ ;
①比较这两种元素的气态氢化物的沸点
②比较这两种元素的单质与氢气化合的难易程度
③比较这两种元素的气态氢化物的还原性
④比较这两种元素反应中得电子的多少
(4)向E的硝酸盐溶液中滴加过量D的最高价氧化物的水化物溶液,反应的离子方程式为____________ 。
(5)A、C、D、F四种元素可以形成两种酸式盐 均由四种元素组成
均由四种元素组成 ,这两种酸式盐的化学式分别为
,这两种酸式盐的化学式分别为_____ 、______ ,这两种酸式盐相互反应的离子方程式为______________________ 。
请回答下列问题:
(1)写出B、C、E元素的名称B
(2)写出C、D两种元素形成的原子个数比为1:1的物质的电子式为
(3)可以验证C和F两种元素非金属性强弱的结论是(填编号)
①比较这两种元素的气态氢化物的沸点
②比较这两种元素的单质与氢气化合的难易程度
③比较这两种元素的气态氢化物的还原性
④比较这两种元素反应中得电子的多少
(4)向E的硝酸盐溶液中滴加过量D的最高价氧化物的水化物溶液,反应的离子方程式为
(5)A、C、D、F四种元素可以形成两种酸式盐
 均由四种元素组成
均由四种元素组成 ,这两种酸式盐的化学式分别为
,这两种酸式盐的化学式分别为
更新时间:2019-06-13 18:53:06
|
相似题推荐
解答题-实验探究题
|
较难
(0.4)
名校
【推荐1】回答下列问题:
(1)某实验小组用 NaOH溶液和
NaOH溶液和
 溶液进行中和热的测定。取50mL NaOH溶液和30mL
溶液进行中和热的测定。取50mL NaOH溶液和30mL  溶液进行实验,实验数据如表所示。
溶液进行实验,实验数据如表所示。
近似认为 NaOH溶液和
NaOH溶液和
 溶液的密度都是
溶液的密度都是 ,中和后混合溶液的比热容
,中和后混合溶液的比热容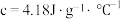 ,则
,则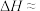
_______ (结果保留小数点后一位)。
(2)上述实验数值结果与57.3kJ/mol有偏差,产生偏差的原因可能是(填字母)_______。
(3)研究人员提出利用含硫物质热化学循环实现太阳能的转化与存储。过程如图:
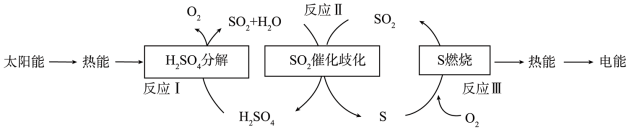
反应I: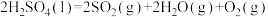
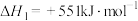
反应Ⅲ:
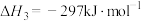
反应Ⅱ的热化学方程式:_______ 。
(4)热力学标准态(298K、101kPa)下,由稳定单质发生反应生成1mol化合物的反应热叫该化合物的生成热( )。如图为第VIA族元素(包括O、S、Se、Te)氢化物a、b、c、d的生成热数据示意图。试完成下列问题。
)。如图为第VIA族元素(包括O、S、Se、Te)氢化物a、b、c、d的生成热数据示意图。试完成下列问题。
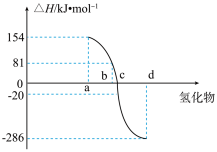
①图中a对应的氢化物是_______ (填化学式),结合元素周期律归纳非金属元素氢化物的稳定性与氢化物的生成热 的关系:
的关系:_______ 。
②硒化氢在上述条件下发生分解反应的热化学方程式为_______ 。(沸点:硒化氢-41.3℃;硒:6849℃)
(1)某实验小组用
 NaOH溶液和
NaOH溶液和
 溶液进行中和热的测定。取50mL NaOH溶液和30mL
溶液进行中和热的测定。取50mL NaOH溶液和30mL  溶液进行实验,实验数据如表所示。
溶液进行实验,实验数据如表所示。| 温度实验次数 | 起始温度 | 终止温度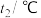 | ||
 溶液 溶液 | NaOH溶液 | 平均值 | ||
| 1 | 26.2 | 26.6 | 26.4 | 30.4 |
| 2 | 27.0 | 27.4 | 27.2 | 33.3 |
| 3 | 25.9 | 25.9 | 25.9 | 29.8 |
| 4 | 26.4 | 26.2 | 26.3 | 30.4 |
 NaOH溶液和
NaOH溶液和
 溶液的密度都是
溶液的密度都是 ,中和后混合溶液的比热容
,中和后混合溶液的比热容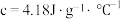 ,则
,则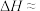
(2)上述实验数值结果与57.3kJ/mol有偏差,产生偏差的原因可能是(填字母)_______。
| A.实验装置保温、隔热效果差 |
| B.量取稀硫酸溶液的体积时仰视读数 |
| C.一次性把NaOH溶液倒入盛有硫酸的小烧杯中 |
| D.用温度计测定NaOH溶液起始温度后直接测定硫酸溶液的温度 |
(3)研究人员提出利用含硫物质热化学循环实现太阳能的转化与存储。过程如图:

反应I:
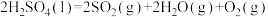
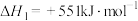
反应Ⅲ:

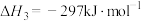
反应Ⅱ的热化学方程式:
(4)热力学标准态(298K、101kPa)下,由稳定单质发生反应生成1mol化合物的反应热叫该化合物的生成热(
 )。如图为第VIA族元素(包括O、S、Se、Te)氢化物a、b、c、d的生成热数据示意图。试完成下列问题。
)。如图为第VIA族元素(包括O、S、Se、Te)氢化物a、b、c、d的生成热数据示意图。试完成下列问题。
①图中a对应的氢化物是
 的关系:
的关系:②硒化氢在上述条件下发生分解反应的热化学方程式为
您最近一年使用:0次
解答题-无机推断题
|
较难
(0.4)
解题方法
【推荐2】下表是元素周期表的一部分,针对表中的①~⑩种元素,请用化学用语回答下列问题:
(1) 在③~⑦元素中,原子半径最大的是__________ (填元素符号);
(2) ⑦元素的最高价氧化物对应的水化物与其氢化物能生成盐M,M中含有的化学键类型有________________________ ;
(3)写出元素①和⑧的单质在加热条件下反应生成的化合物的电子式:_____________ 。
(4) ③、⑤、⑦、⑧所形成的离子,其半径由小到大的顺序是________ (填离子符号)
(5) ①~⑨中元素最高价氧化物对应的水化物中酸性最强的是_____________ (填物质化学式),呈两性的氢氧化物是_________ (填物质化学式);该化合物与NaOH溶液反应的离子方程式为___________ 。
(6) 用电子式表示元素③与⑨形成化合物的过程_____________________________ 。
(7)写出工业冶炼⑤的化学方程式:_______________________________________ 。
| 族 周期 | IA | IIA | IIIA | IVA | VA | VIA | VIIA | 0 |
| 2 | ⑥ | ⑦ | ⑧ | |||||
| 3 | ① | ③ | ⑤ | ⑨ | ⑩ | |||
| 4 | ② | ④ |
(2) ⑦元素的最高价氧化物对应的水化物与其氢化物能生成盐M,M中含有的化学键类型有
(3)写出元素①和⑧的单质在加热条件下反应生成的化合物的电子式:
(4) ③、⑤、⑦、⑧所形成的离子,其半径由小到大的顺序是
(5) ①~⑨中元素最高价氧化物对应的水化物中酸性最强的是
(6) 用电子式表示元素③与⑨形成化合物的过程
(7)写出工业冶炼⑤的化学方程式:
您最近一年使用:0次
解答题-有机推断题
|
较难
(0.4)
名校
解题方法
【推荐3】随着原子序数递增,短周期主族元素(用字母A、B、C等表示)原子半径的相对大小的变化如图所示,根据判断出的元素回答问题。

(1)L在元素周期表中的位置是___________ 。
(2)M、G、H的简单气态氢化物的稳定性由强到弱的顺序是___________ (用化学式表示)。
(3)E、X、Y三种元素的最高价氧化物对应的水化物的酸性由强到弱的顺序是___________ (用化学式表示)。
(4)G和I能形成一种淡黄色的固体,请写出该物质的电子式:___________ 。
(5)E与A形成的饱和链烃中,有几种物质每个分子的电子总数均为42,符合该条件的有机物共有___________ 种,其一氯代物有4种的该饱和链烃结构简式为___________ 。
(6)A与G、与X均可形成18个电子的分子,这两种分子在水溶液中反应后,生成物之一是含10电子的化合物,该反应可观察到现象是___________ ,原因是___________ 。(用化学方程式表示)

(1)L在元素周期表中的位置是
(2)M、G、H的简单气态氢化物的稳定性由强到弱的顺序是
(3)E、X、Y三种元素的最高价氧化物对应的水化物的酸性由强到弱的顺序是
(4)G和I能形成一种淡黄色的固体,请写出该物质的电子式:
(5)E与A形成的饱和链烃中,有几种物质每个分子的电子总数均为42,符合该条件的有机物共有
(6)A与G、与X均可形成18个电子的分子,这两种分子在水溶液中反应后,生成物之一是含10电子的化合物,该反应可观察到现象是
您最近一年使用:0次
解答题-无机推断题
|
较难
(0.4)
解题方法
【推荐1】Ⅰ.颜料是指不溶解、只能以微粒状态分散于粘合剂中的着色剂。颜料混合时的三原色是红、黄、蓝,通过三原色可以调出其他所有颜色。物质A,B,C的溶液颜色类似于这三种颜色。
含铁物质X与HSCN和NaSCN反应得到A(反应①),将固体A置于浓 上方,会逐渐失去9分子结晶水(失重23.51%)。X与含铁物质Y以及KOH反应得到B(反应②),X与HCl反应得到C(反应③),固体C为六水合物,其无水形式可以由单质反应生成。含铁的物质X和Y可以反应生成不溶于水的蓝色物质Z(
上方,会逐渐失去9分子结晶水(失重23.51%)。X与含铁物质Y以及KOH反应得到B(反应②),X与HCl反应得到C(反应③),固体C为六水合物,其无水形式可以由单质反应生成。含铁的物质X和Y可以反应生成不溶于水的蓝色物质Z( ,反应④)。1.000gY可以得到1.327gZ,用相同质量的Y可以得到1.42gB.Y在空气中放置也会生成Z,同时产生剧毒物质(反应⑤)。
,反应④)。1.000gY可以得到1.327gZ,用相同质量的Y可以得到1.42gB.Y在空气中放置也会生成Z,同时产生剧毒物质(反应⑤)。
(1)①推出物质A,B,C,X,Y,Z的化学式,A______ ,B______ ,C______ ,X______ ,Y______ ,Z______
②写出反应①、②、④、⑤的方程式。①______ ,②______ ,④______ ,⑤______
(2)指出物质A、B、C的颜色。A______ ,B______ ,C______ ,
Ⅱ.电子屏幕上千变万化的颜色则是由红、绿、蓝三原色来组成。 、
、 、
、 分别经一步反应生成D(青绿色,反应⑥)、E(紫色,反应⑦)、F(黄色,反应⑧)。化合物D,E,F的颜色类似于将红,绿,蓝色的光两两混合后得到。物质D和E为结晶水合物,F为不含氧的二元化合物,其金属元素的质量分数为44.95%。物质D(
分别经一步反应生成D(青绿色,反应⑥)、E(紫色,反应⑦)、F(黄色,反应⑧)。化合物D,E,F的颜色类似于将红,绿,蓝色的光两两混合后得到。物质D和E为结晶水合物,F为不含氧的二元化合物,其金属元素的质量分数为44.95%。物质D( ,
, )的溶液能与银氨溶液发生反应(反应⑨)。物质E为复盐,50g2.50%的E溶液与过量硝酸钡溶液反应,生成1.165g不溶于酸和碱的白色沉淀。
)的溶液能与银氨溶液发生反应(反应⑨)。物质E为复盐,50g2.50%的E溶液与过量硝酸钡溶液反应,生成1.165g不溶于酸和碱的白色沉淀。
(3)①通过计算和推理写出物质D、E、F的化学式。D______ ,E______ ,F______ ,
②写出反应⑨的方程式。______
(4)对物质D,E,F,指出屏幕上是哪两种基本颜色的光可以形成该物质的颜色。______ ,
含铁物质X与HSCN和NaSCN反应得到A(反应①),将固体A置于浓
 上方,会逐渐失去9分子结晶水(失重23.51%)。X与含铁物质Y以及KOH反应得到B(反应②),X与HCl反应得到C(反应③),固体C为六水合物,其无水形式可以由单质反应生成。含铁的物质X和Y可以反应生成不溶于水的蓝色物质Z(
上方,会逐渐失去9分子结晶水(失重23.51%)。X与含铁物质Y以及KOH反应得到B(反应②),X与HCl反应得到C(反应③),固体C为六水合物,其无水形式可以由单质反应生成。含铁的物质X和Y可以反应生成不溶于水的蓝色物质Z( ,反应④)。1.000gY可以得到1.327gZ,用相同质量的Y可以得到1.42gB.Y在空气中放置也会生成Z,同时产生剧毒物质(反应⑤)。
,反应④)。1.000gY可以得到1.327gZ,用相同质量的Y可以得到1.42gB.Y在空气中放置也会生成Z,同时产生剧毒物质(反应⑤)。(1)①推出物质A,B,C,X,Y,Z的化学式,A
②写出反应①、②、④、⑤的方程式。①
(2)指出物质A、B、C的颜色。A
Ⅱ.电子屏幕上千变万化的颜色则是由红、绿、蓝三原色来组成。
 、
、 、
、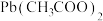 分别经一步反应生成D(青绿色,反应⑥)、E(紫色,反应⑦)、F(黄色,反应⑧)。化合物D,E,F的颜色类似于将红,绿,蓝色的光两两混合后得到。物质D和E为结晶水合物,F为不含氧的二元化合物,其金属元素的质量分数为44.95%。物质D(
分别经一步反应生成D(青绿色,反应⑥)、E(紫色,反应⑦)、F(黄色,反应⑧)。化合物D,E,F的颜色类似于将红,绿,蓝色的光两两混合后得到。物质D和E为结晶水合物,F为不含氧的二元化合物,其金属元素的质量分数为44.95%。物质D(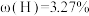 ,
, )的溶液能与银氨溶液发生反应(反应⑨)。物质E为复盐,50g2.50%的E溶液与过量硝酸钡溶液反应,生成1.165g不溶于酸和碱的白色沉淀。
)的溶液能与银氨溶液发生反应(反应⑨)。物质E为复盐,50g2.50%的E溶液与过量硝酸钡溶液反应,生成1.165g不溶于酸和碱的白色沉淀。(3)①通过计算和推理写出物质D、E、F的化学式。D
②写出反应⑨的方程式。
(4)对物质D,E,F,指出屏幕上是哪两种基本颜色的光可以形成该物质的颜色。
您最近一年使用:0次
解答题-无机推断题
|
较难
(0.4)
【推荐2】分现有A、B、C、D、E、F六种短周期元素,它们的原子序数依次增大。A与D、C与E分别同主族,D、E、F同周期,B原子的最外层电子数是内层电子数的2.5倍,A与C形成的常见化合物在常温下为液态。
(1)元素A在周期表中的位置是________ ;D、E、F形成的简单离子中半径最大的是_______ (填离子符号)。
(2)常温下,F的单质能与由A、C、D三种元素组成的一种常见化合物发生反应,该反应的化学方程式为________ 。
(3) E与F的最简单气态氢化物中稳定性较强的是________ (填化学式)。
(4)元素B和元素F能形成一种化合物BF3,其中F显+1价。BF3能发生水解反应生成一种弱碱和一种弱酸,写出该反应的化学方程式:________ 。
(1)元素A在周期表中的位置是
(2)常温下,F的单质能与由A、C、D三种元素组成的一种常见化合物发生反应,该反应的化学方程式为
(3) E与F的最简单气态氢化物中稳定性较强的是
(4)元素B和元素F能形成一种化合物BF3,其中F显+1价。BF3能发生水解反应生成一种弱碱和一种弱酸,写出该反应的化学方程式:
您最近一年使用:0次
解答题-结构与性质
|
较难
(0.4)
名校
【推荐3】锂离子电池让电动汽车飞速发展,有利于实现节能减排。LiCoO2、LiFePO4、Li4Ti5O12常用作电池的电极材料,LiPF6、LiAsF6常用作锂离子聚合物电池的载体材料。
(1)在周期表中,与Li的化学性质最相似的邻族元素是_______ ,LiCoO2中基态Co原子核外电子的空间运动状态有_______ 种。
(2)含氧酸的通式可写为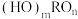 ,,根据含氧酸的结构规律,下列酸中酸性与H3PO4相近的有_______(填字母)。
,,根据含氧酸的结构规律,下列酸中酸性与H3PO4相近的有_______(填字母)。
(3)电池工作时,Li+计可在电解质LiPF6或LiAsF6中发生迁移,相同条件下,Li+在_______ (填“LiPF6”或“LiAsF6”)中迁移较快,原因是_______ 。
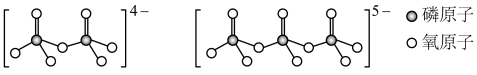
(4)LiFePO4中P的_______ 杂化轨道与O的2p轨道形成 键。LiFePO4属于简单磷酸盐,而直链的多磷酸盐则是一种复杂磷酸盐,如:焦磷酸钠、三磷酸钠等。焦磷酸根离子、三磷酸根离子如下图所示,这类磷酸根离子的化学式可用通式表示为
键。LiFePO4属于简单磷酸盐,而直链的多磷酸盐则是一种复杂磷酸盐,如:焦磷酸钠、三磷酸钠等。焦磷酸根离子、三磷酸根离子如下图所示,这类磷酸根离子的化学式可用通式表示为_______ (用n代表P原子数)。
(5)Li4Ti5O12中Ti元素的化合物TiO2是一种重要的瓷器釉料。研究表明,在TiO2中通过氮掺杂反应可生成TiO2-aNb,能使TiO2对可见光具有活性,掺杂过程如图所示。
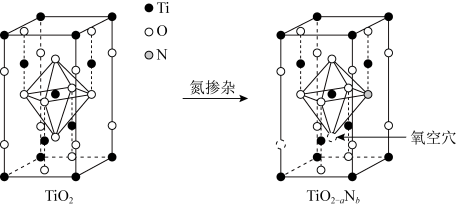
则TiO2-aNb晶体中a=_______ ,b=_______ 。
(1)在周期表中,与Li的化学性质最相似的邻族元素是
(2)含氧酸的通式可写为
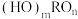 ,,根据含氧酸的结构规律,下列酸中酸性与H3PO4相近的有_______(填字母)。
,,根据含氧酸的结构规律,下列酸中酸性与H3PO4相近的有_______(填字母)。| A.HClO | B.H2SO4 | C.HNO2 | D.HNO3 |
(4)LiFePO4中P的
 键。LiFePO4属于简单磷酸盐,而直链的多磷酸盐则是一种复杂磷酸盐,如:焦磷酸钠、三磷酸钠等。焦磷酸根离子、三磷酸根离子如下图所示,这类磷酸根离子的化学式可用通式表示为
键。LiFePO4属于简单磷酸盐,而直链的多磷酸盐则是一种复杂磷酸盐,如:焦磷酸钠、三磷酸钠等。焦磷酸根离子、三磷酸根离子如下图所示,这类磷酸根离子的化学式可用通式表示为
(5)Li4Ti5O12中Ti元素的化合物TiO2是一种重要的瓷器釉料。研究表明,在TiO2中通过氮掺杂反应可生成TiO2-aNb,能使TiO2对可见光具有活性,掺杂过程如图所示。

则TiO2-aNb晶体中a=
您最近一年使用:0次
解答题-无机推断题
|
较难
(0.4)
名校
解题方法
【推荐1】A、B、C、D是原子序数依次增大的短周期主族元素,A、C在元素周期表中的相对位置如图,A元素最外层与次外层的电子数之差为3,B为地壳中含量最多的金属元素。

(1)D原子结构示意图为_______ 。
(2)将C的低价态氧化物甲中通入到D单质的水溶液会使之褪色,体现了甲的_______ 性,写出该反应的离子方程式_______ 。
(3)A的最高价氧化物对应的水化物是乙,现将过量Cu加入到100mL8.0mol/L乙的浓溶液中,充分反应,共收集到6.72L(标准状况)气体,则该气体的成分是_______ ,还原剂失电子数为_______ 。
(4)将两份足量的B单质分别加入到等体积等浓度的盐酸和NaOH溶液中,充分反应生成气体的体积比为_______ ,若将反应后所得的溶液混合,会生成白色沉淀,发生反应的离子方程式为_______ ;B单质表面的氧化膜可用NaOH溶液除去,写出该反应的化学方程式_______ 。

(1)D原子结构示意图为
(2)将C的低价态氧化物甲中通入到D单质的水溶液会使之褪色,体现了甲的
(3)A的最高价氧化物对应的水化物是乙,现将过量Cu加入到100mL8.0mol/L乙的浓溶液中,充分反应,共收集到6.72L(标准状况)气体,则该气体的成分是
(4)将两份足量的B单质分别加入到等体积等浓度的盐酸和NaOH溶液中,充分反应生成气体的体积比为
您最近一年使用:0次
解答题-无机推断题
|
较难
(0.4)
名校
【推荐2】下表为元素周期表的一部分,请参照元素①~⑩在表中的位置,回答下列问题(填元素符号或化学式):
(1)元素⑪的原子结构示意图为________________ 。
(2)④、⑤、⑥的简单离子半径由大到小的顺序为______________ (用离子符号和“>”表示)。
(3)④⑨⑩的气态氢化物中,最稳定的是__________ (用化学式表示),最高价氧化物对应水化物中,酸性最强的是_________ (用化学式表示)。
(4)⑥的最高价氧化物对应的水化物与⑧的最高价氧化物对应的水化物发生反应的离子方程式____________________________________ 。
(5)⑥的单质在空气中燃烧可生成淡黄色粉末X,X常用作呼吸面具和潜水艇中的供氧剂,可选用合适的化学试剂和下图所示实验装置证明X有提供氧气的作用。回答下列问题:

①装置A使用石灰石与浓盐酸反应制取CO2,装置B中饱和NaHCO3溶液的作用是_____________________________________________ ;
②装置C中X与CO2反应的化学方程式是_________________________________ ,装置D盛放NaOH溶液的作用是除去____________________________________ ;
③为检验试管F收集的气体,操作为________________________ ,出现_____________________ 现象,即证明X可作供氧剂。
| ① | |||||||||||||||||
| ② | ③ | ④ | ⑤ | ||||||||||||||
| ⑥ | ⑦ | ⑧ | ⑨ | ⑩ | |||||||||||||
| ⑪ | |||||||||||||||||
(2)④、⑤、⑥的简单离子半径由大到小的顺序为
(3)④⑨⑩的气态氢化物中,最稳定的是
(4)⑥的最高价氧化物对应的水化物与⑧的最高价氧化物对应的水化物发生反应的离子方程式
(5)⑥的单质在空气中燃烧可生成淡黄色粉末X,X常用作呼吸面具和潜水艇中的供氧剂,可选用合适的化学试剂和下图所示实验装置证明X有提供氧气的作用。回答下列问题:

①装置A使用石灰石与浓盐酸反应制取CO2,装置B中饱和NaHCO3溶液的作用是
②装置C中X与CO2反应的化学方程式是
③为检验试管F收集的气体,操作为
您最近一年使用:0次
解答题-无机推断题
|
较难
(0.4)
名校
解题方法
【推荐3】下图为元素周期表的一部分,请参照元素①~⑧在表中的位置,回答下列问题:
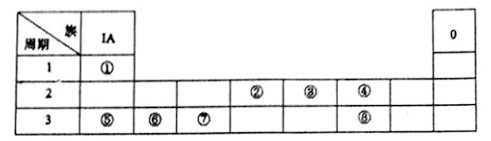
(1)在上述元素的最高价氧化物对应的水化物中:属于强酸的是_______ (用化学式表示,下同);碱性最强的是_______ 。
(2)④、⑤、⑥的简单离子半径由大到小的顺序是_______ (用离子符号表示)
(3)有两种离子化合物,均由①、④、⑤、⑧四种元素组成.这两种物质可在水溶液中发生反应。写山该反应的离子方程式:_______________ 。
(4)请写出涉及上述有关元素的两个置换反应(要求:同一反应中两种单质对应元素既不同周期也不同主族)__________________ ;_____________ 。
(5)由表中元素形成的常见无机化合物A、B、C、X有以下转化关系:
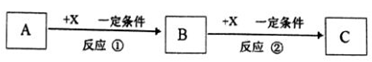
若A、B、C含同一金属元素,X为强电解质.且反应都在溶液中进行,则B的化学式为_____ ,X的化学式可能为______ 或______ (写不同类别物质)。

(1)在上述元素的最高价氧化物对应的水化物中:属于强酸的是
(2)④、⑤、⑥的简单离子半径由大到小的顺序是
(3)有两种离子化合物,均由①、④、⑤、⑧四种元素组成.这两种物质可在水溶液中发生反应。写山该反应的离子方程式:
(4)请写出涉及上述有关元素的两个置换反应(要求:同一反应中两种单质对应元素既不同周期也不同主族)
(5)由表中元素形成的常见无机化合物A、B、C、X有以下转化关系:

若A、B、C含同一金属元素,X为强电解质.且反应都在溶液中进行,则B的化学式为
您最近一年使用:0次
解答题-无机推断题
|
较难
(0.4)
名校
解题方法
【推荐1】如表为几种短周期元素的性质,回答下列问题:
(1)E元素在元素周期表中的位置是_____ ;C 元素与G元素形成化合物的电子式_____ 。
(2)D的单质与B的最高价氧化物对应水化物的溶液反应,其离子方程式为_________ 。
(3)B2A2中含有的化学键为_______ ,该物质与水反应的化学反应方程式为________ 。
(4)下列说法不正确的是______ (填序号)。
①H的气态氢化物水溶液能导电,说明H的气态氢化物为电解质
②最高价氧化物对应水化物的碱性:B>C>D
③D的最高价氧化物对应水化物可以溶于氨水
④元素气态氢化物的稳定性:F>A>G
| 元素编号 | A | B | C | D | E | F | G | H |
| 原子半径/10-1 nm | 0.74 | 1.54 | 1.30 | 1. 18 | 1.11 | 1.06 | 0.99 | 0.75 |
| 最高或最低化合价 | -2 | +1 | +2 | +3 | +4,-4 | +5,-3 | +7,-1 | +5,-3 |
(2)D的单质与B的最高价氧化物对应水化物的溶液反应,其离子方程式为
(3)B2A2中含有的化学键为
(4)下列说法不正确的是
①H的气态氢化物水溶液能导电,说明H的气态氢化物为电解质
②最高价氧化物对应水化物的碱性:B>C>D
③D的最高价氧化物对应水化物可以溶于氨水
④元素气态氢化物的稳定性:F>A>G
您最近一年使用:0次
解答题-无机推断题
|
较难
(0.4)
解题方法
【推荐2】X、Y、Z、Q、R是五种短周期元素,原子序数依次增大。X、Y两元素最高正价与最低负价之和均为零;Q与X同主族;Z、R分别是地壳中含量最高的非金属元素和金属元素。请回答下列问题:
(1)五种元素原子半径由大到小的顺序是(写元素符号)________________________
(2)X与Y能形成多种化合物,其中既含极性键又含非极性键,且相对分子质量最小的物质是(写分子式)_____________________
(3)由以上某些元素组成的化合物A、B、C、D有如下转化关系:
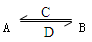
(在水溶液中进行),其中C是溶于水显酸性的气体,D是淡黄色固体。
写出C的结构式_____________ ;D的电子式____________________ 。
①如果A、B均由三种元素组成,B为两性不溶物,则A的化学式为_______________ ,由A转化为B的离子方程式______________________________
②如果A由三种元素组成,B由四种元素组成,A、B溶液均显碱性。用离子方程式表示A溶液显碱性的原因______________________ 。
(1)五种元素原子半径由大到小的顺序是(写元素符号)
(2)X与Y能形成多种化合物,其中既含极性键又含非极性键,且相对分子质量最小的物质是(写分子式)
(3)由以上某些元素组成的化合物A、B、C、D有如下转化关系:
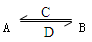
(在水溶液中进行),其中C是溶于水显酸性的气体,D是淡黄色固体。
写出C的结构式
①如果A、B均由三种元素组成,B为两性不溶物,则A的化学式为
②如果A由三种元素组成,B由四种元素组成,A、B溶液均显碱性。用离子方程式表示A溶液显碱性的原因
您最近一年使用:0次
解答题-无机推断题
|
较难
(0.4)
名校
解题方法
【推荐3】几种短周期元素的原子半径及化合价见下表:
分析上表中有关数据,结合已学过的知识,回答以下问题。
涉及上述元素的答案,请用元素符号表示。
(1)E元素在周期表中的位置是___________ 。
(2)A、H、J对应的离子半径由大到小的顺序是(填写离子符号)____________ 。
(3)用电子式表示A与I所形成化合物的形成过程__________________ 。
(4)B与H所形成的化合物与J的最高价氧化物的水化物X的溶液发生反应的离子方程式为__________________ ;
(5)用B与D所形成的化合物的化学式为__________________ ,属于___________ 晶体。
元素代号 | A | B | D | E | G | H | I | J |
化合价 | -1 | -2 | +4、-4 | +6、-2 | +5、-3 | +3 | +2 | +1 |
原子半径/nm | 0.071 | 0.074 | 0.130 | 0.102 | 0.110 | 0.143 | 0.160 | 0.186 |
涉及上述元素的答案,请用元素符号表示。
(1)E元素在周期表中的位置是
(2)A、H、J对应的离子半径由大到小的顺序是(填写离子符号)
(3)用电子式表示A与I所形成化合物的形成过程
(4)B与H所形成的化合物与J的最高价氧化物的水化物X的溶液发生反应的离子方程式为
(5)用B与D所形成的化合物的化学式为
您最近一年使用:0次



