A、B、C、D、E是五种短周期元素。已知:它们的原子序数依次增大,A是元素周期表中原子半径最小的元素;B原子最外层电子数比其次外层电子数多2,C是E的邻族元素;D和E的原子序数之和为30,且D的族序数与周期数相等。甲、乙、丙、丁是它们两两形成的化合物,其中甲分子中含有18个电子。
请回答下列问题:
(1)若元素E的某种核素中中子数比质子数多3个,表示这种核素的符号为___________ ;
(2)把D的单质放到NaOH溶液中,反应的离子方程式为:______________________ ;
(3)甲的电子式:____________________________________________ ;
(4)有100mL MgCl2和丙的混合溶液,其中c(Mg2+)=0.2mol·L-1,c(Cl-)=1.3mol·L-1,要使Mg2+全部转化为沉淀分离出来,至少需要4mol·L-1NaOH溶液的体积是:________ mL;
(5)在密闭容器中充入BC2、BC和乙的混合气体共mg,若加入足量Na2O2,并不断用电火花点燃至反应完全,测得固体质量增重mg,则BC2与乙的质量比为__________ 。
| 物质组成 | 甲 | 乙 | 丙 | 丁 |
| 化合物中各元素原子个数比 | A和C 1:1 | B和A 1:4 | D和E 1:3 | B和E 1:4 |
(1)若元素E的某种核素中中子数比质子数多3个,表示这种核素的符号为
(2)把D的单质放到NaOH溶液中,反应的离子方程式为:
(3)甲的电子式:
(4)有100mL MgCl2和丙的混合溶液,其中c(Mg2+)=0.2mol·L-1,c(Cl-)=1.3mol·L-1,要使Mg2+全部转化为沉淀分离出来,至少需要4mol·L-1NaOH溶液的体积是:
(5)在密闭容器中充入BC2、BC和乙的混合气体共mg,若加入足量Na2O2,并不断用电火花点燃至反应完全,测得固体质量增重mg,则BC2与乙的质量比为
更新时间:2019-06-26 18:20:04
|
相似题推荐
解答题-无机推断题
|
适中
(0.65)
名校
【推荐1】现有七种元素,其中A、B、C、D、E为短周期主族元素,F、G为第四周期元素,它们的原子序数依次增大。请根据下列相关信息,回答问题。
(1)已知BA5为离子化合物,写出其电子式:____________ 。
(2)B基态原子中能量最高的电子,其电子云在空间有________ 个方向,原子轨道呈________ 形。
(3)某同学根据上述信息,推断C基态原子的核外电子排布图为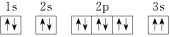 。该同学所画的电子排布图违背了
。该同学所画的电子排布图违背了________ 。
(4)G位于__________ 族__________ 区,价电子排布式为__________ 。
| 元素 | 相关信息 |
| A | 元素的核外电子数和电子层数相等,也是宇宙中最丰富的元素 |
| B | 元素原子的核外p电子数比s电子数少1 |
| C | 原子的第一至第四电离能分别是 I1=738 kJ/mol;I2=1 451 kJ/mol; I3=7 733 kJ/mol;I4=10 540 kJ/mol |
| D | 原子核外所有p轨道全满或半满 |
| E | 元素的主族序数与周期数的差为4 |
| F | 是前四周期中电负性最小的元素 |
| G | 在周期表的第七列 |
(2)B基态原子中能量最高的电子,其电子云在空间有
(3)某同学根据上述信息,推断C基态原子的核外电子排布图为
 。该同学所画的电子排布图违背了
。该同学所画的电子排布图违背了(4)G位于
您最近一年使用:0次
解答题-无机推断题
|
适中
(0.65)
名校
【推荐2】元素是构成我们生活的世界中一切物质的“原材料”。
(1)自18世纪以来,科学家们不断探索元素之谜。通过从局部到系统 的研究过程,逐渐发现了元素之间的内在联系。下面列出了几位杰出科学家的研究工作。
上述科学家的研究按照时间先后排序合理的是_________ (填数字序号)。
(2)1869年,门捷列夫在前人研究的基础上制出了第一张元素周期表,如图所示。
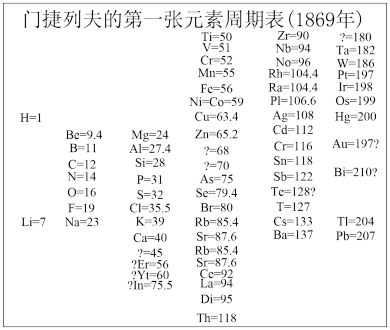
①门捷列夫将已有元素按照相对原子质量排序,同一___________ (填“横行”或“纵列”)元素性质相似。结合表中信息,猜想第4列方框中“?=70”的问号表达的含义是_______________ ,第5列方框中“Te=128?”的问号表达的含义是_______________ 。
②到20世纪初,门捷列夫周期表中为未知元素留下的空位逐渐被填满。而且,随着原子结构的逐渐揭秘,科学家们发现了元素性质不是随着相对原子质量 递增呈现周期性变化,而是随着原子序数 (核电荷数)递增呈现周期性变化。其本质原因是_______________ (填字母序号)。
A. 随着核电荷数递增,原子核外电子排布呈现周期性变化
B. 随着核电荷数递增,原子半径呈现周期性变化
C. 随着核电荷数递增,元素主要化合价呈现周期性变化
(3)短周期元素A、B、D、E、G、J在周期表中的位置如下:
根据上表回答问题:
①D在周期表中的位置是_______________ 。
②A、B、E、G的原子半径由大到小的顺序是_______________ (填元素符号)。
③B、D的气态氢化物的稳定性大小关系为_______________ (填化学式)。
④E、G、J的最高价氧化物对应水化物两两之间反应的离子方程式分别为i. H++OH-=H2O、ii._______________ 、iii_______________ 。
⑤用电子式表示E的最高价氧化物的形成过程_______________ 。
(1)自18世纪以来,科学家们不断探索元素之谜。通过
| 序号 | ① | ② | ③ | ④ |
| 科学 | 纽兰兹 | 道尔顿 | 德贝莱纳 | 尚古尔多 |
| 工作 | 发现“ | 创立 | 发现了5组性质相似的“ | 认为 |
(2)1869年,门捷列夫在前人研究的基础上制出了第一张元素周期表,如图所示。

①门捷列夫将已有元素按照相对原子质量排序,同一
②到20世纪初,门捷列夫周期表中为未知元素留下的空位逐渐被填满。而且,随着原子结构的逐渐揭秘,科学家们发现了元素性质不是随着
A. 随着核电荷数递增,原子核外电子排布呈现周期性变化
B. 随着核电荷数递增,原子半径呈现周期性变化
C. 随着核电荷数递增,元素主要化合价呈现周期性变化
(3)短周期元素A、B、D、E、G、J在周期表中的位置如下:
| A | |||||||
| B | D | ||||||
| E | G | J |
①D在周期表中的位置是
②A、B、E、G的原子半径由大到小的顺序是
③B、D的气态氢化物的稳定性大小关系为
④E、G、J的最高价氧化物对应水化物两两之间反应的离子方程式分别为i. H++OH-=H2O、ii.
⑤用电子式表示E的最高价氧化物的形成过程
您最近一年使用:0次
解答题-无机推断题
|
适中
(0.65)
【推荐3】A、B、C、D、E、F代表6种元素。请填写下列空白。
(1) A元素基态原子的最外层电子数是内层电子数的3倍,其原子结构示意图为____ ,位于元素周期表中第________ 周期第________ 族。
(2) B元素的负一价离子和C元素的正一价离子的电子层结构都与Ne相同,B的原子半径_____ C的原子半径(填“>”或“<”)。
(3) D的基态原子在前四周期元素的基态原子中单电子数最多,D的元素名称为____ ,其基态原子的电子排布式为_______ ,有____ 种运动状态不同的电子。
(4)E元素的正三价离子的3d轨道为半充满,E的元素符号为_____ ,其基态原子的价电子排布图为____ ,其正三价离子比正二价离子稳定,原因是_______________ 。
(5)F元素基态原子的M层全充满,N层没有成对电子,只有一个未成对电子,F的元素符号为_____ ,在元素周期表中位于______ 区。
(1) A元素基态原子的最外层电子数是内层电子数的3倍,其原子结构示意图为
(2) B元素的负一价离子和C元素的正一价离子的电子层结构都与Ne相同,B的原子半径
(3) D的基态原子在前四周期元素的基态原子中单电子数最多,D的元素名称为
(4)E元素的正三价离子的3d轨道为半充满,E的元素符号为
(5)F元素基态原子的M层全充满,N层没有成对电子,只有一个未成对电子,F的元素符号为
您最近一年使用:0次
解答题-无机推断题
|
适中
(0.65)
【推荐1】X、Y、Z、W是原子序数依次增大的短周期元素,且互不同族;其中只有两种为金属;X原子的最外层电子数与次外层电子数相等;X与W、Y与Z这两对原子的最外层电子数之和均为9。单质Y和W都可与浓的NaOH溶液反应。请回答下列问题:
(1)Y、Z、W的原子半径由小到大的顺序是(用元素符号表示)________ 。
(2)写出实验室制备Y的最高价氧化物的水化物的离子方程式:___________________
(3)X与Y化学性质相似,则X与浓的NaOH溶液反应的化学方程式是__________ 。
(4)0.1mol的单质W与50mL 1.5mol/L的FeBr2溶液反应,已知2Fe2++Br2==Fe3++2Br—则被氧化的Fe2+和Br-的物质的量之比是____________
(5)用化学方程式表示W的非金属性比Z强:____________________________
(1)Y、Z、W的原子半径由小到大的顺序是(用元素符号表示)
(2)写出实验室制备Y的最高价氧化物的水化物的离子方程式:
(3)X与Y化学性质相似,则X与浓的NaOH溶液反应的化学方程式是
(4)0.1mol的单质W与50mL 1.5mol/L的FeBr2溶液反应,已知2Fe2++Br2==Fe3++2Br—则被氧化的Fe2+和Br-的物质的量之比是
(5)用化学方程式表示W的非金属性比Z强:
您最近一年使用:0次
解答题-无机推断题
|
适中
(0.65)
名校
【推荐2】原子序数依次增大的四种元素A、B、C、D分别处于第一至第四周期,自然界中存在多种A的化合物;B原子核外电子有6种不同的运动状态;B与C可形成正四面体形分子;D的基态原子的最外能层只有一个电子,其他能层均已充满电子。
(1)这四种元素中电负性最大的元素,其基态原子的价电子排布图为_______ ,第一电离能最小的元素是_______ (填元素符号)。
(2)C所在主族的前四种元素分别与A形成的化合物,沸点由低到高的顺序是_______ (填化学式),呈现如此递变规律的原因是_______ 。
(3)D元素的原子共有_______ 种不同能级的电子,电子占据的最高能层符号为_______ 该元素形成的单质,其晶体的堆积模型为_______ 。其晶胞棱长为a nm,则密度可用代数式表示为_______ g/cm3.
(1)这四种元素中电负性最大的元素,其基态原子的价电子排布图为
(2)C所在主族的前四种元素分别与A形成的化合物,沸点由低到高的顺序是
(3)D元素的原子共有
您最近一年使用:0次
解答题-结构与性质
|
适中
(0.65)
名校
解题方法
【推荐3】前四周期原子序数依次增大的X、Y、Z、G、Q、R、T七种元素,核电荷数均小于36,已知X的一种1:2型氢化物分子中既有σ键又有π键,且所有原子共平面;Z的L层上有2个未成对电子;G原子s能级与P能级电子数相等;R单质是制造各种计算机、微电子产品的核心材料;T处于周期表的ds区,原子中只有一个未成对电子.
(1)Y原子核外共有______ 种不同运动状态的电子,T+离子价电子排布图为________ 。
(2)T元素在周期表的位置为__________ 。
(3)G、Q、R三种元素的氯化物的熔点如下表,G的氯化物明显高于其他两种的原因是__________ 。Q的氯化物高于R的氯化物,有同学猜想可能是因为其存在缔合分子,试写出其结构式____ 。
(4)硒(Se)与Z同一主族,Se原子比Z原子多两个电子层,则Se的原子序数为_____ ,其最高价氧化物中心原子的杂化方式为_____ 。该族2-5周期元素单质分别于H2反应生成1mol气态氢化物的反应热如下,表示生成1mol硒化氢反应热的是_____ (填字母代号)。
a.+99.7KJ/mol b.+29.7KJ/mol
c.-20.6KJ/mol d.-241.8KJ/mol
(5)金属Q属立方晶系,其晶胞边长为405pm,密度是2.70g/cm3,通过计算确定Q原子在三维空间中堆积方式________ (已知NA=6.02×1023,4053=6.64×107);晶胞中距离最近的Q原子可看作是接触的,列式计算Q的原子半径=pm______ 。(只列出计算式即可)
(1)Y原子核外共有
(2)T元素在周期表的位置为
(3)G、Q、R三种元素的氯化物的熔点如下表,G的氯化物明显高于其他两种的原因是
| 氟化物 | G的氯化物 | Q的氯化物 | R的氯化物 |
| 熔点/℃ | 714 | 190 | -70 |
a.+99.7KJ/mol b.+29.7KJ/mol
c.-20.6KJ/mol d.-241.8KJ/mol
(5)金属Q属立方晶系,其晶胞边长为405pm,密度是2.70g/cm3,通过计算确定Q原子在三维空间中堆积方式
您最近一年使用:0次
解答题-无机推断题
|
适中
(0.65)
【推荐1】现有8种元素的性质、数据如下表所列,它们属于第二或第三周期。
回答下列问题:
(1)⑥的单质在空气中加热,生成物的电子式为_______________ 。
(2)在最高价氧化物的水化物中,酸性最强的化合物的分子式是___________ 。
(3)比较①和⑦的氢化物的稳定性(用化学式表示)_______________________________ 。
(4)写出实验室制备⑤的单质的离子方程式:________________________________ 。
(5)写出⑧的单质跟③的最高价氧化物的水化物的溶液反应的离子方程式:___________________________ 。
| ① | ② | ③ | ④ | ⑤ | ⑥ | ⑦ | ⑧ | |
| 原子半径(10-10m) | 0.74 | 1.60 | 1.86 | 1.10 | 0.99 | 1.52 | 0.75 | 1.43 |
| 最高或最低化合价 | +2 | +1 | +5 | +7 | +1 | +5 | +3 | |
| -2 | -3 | -1 | -3 |
(1)⑥的单质在空气中加热,生成物的电子式为
(2)在最高价氧化物的水化物中,酸性最强的化合物的分子式是
(3)比较①和⑦的氢化物的稳定性(用化学式表示)
(4)写出实验室制备⑤的单质的离子方程式:
(5)写出⑧的单质跟③的最高价氧化物的水化物的溶液反应的离子方程式:
您最近一年使用:0次
解答题-无机推断题
|
适中
(0.65)
名校
解题方法
【推荐2】元素周期表与元素周期律在学习、研究中有很重要的作用。下表是元素周期表中6种元素的相关信息,其中Q、W、X位于同一周期。
(1)Q元素所在周期表的位置为_____ 。
(2)W单质的电子式为_____ 。
(3)Z的单质与X的最高价氧化物对应的水化物反应的离子方程式为_____ 。
(4)Y的金属性强于X,请结合原子结构解释其原因_____ 。
(5)下列对于M及其化合物的推断中,正确的是_____ (填序号)。
①M的最低负化合价与W的最低负化合价相同
②M的氢化物的稳定性弱于W的氢化物的稳定性
③M的单质可与X和W形成的化合物的水溶液发生置换反应
(6)与M位于同一主族,电子层数比M多一层的元素在生活中的用途是_____ (写出一条即可)。
| 元素 | 信息 |
| Q | 单质是稳定的半导体材料,用于制造芯片 |
| W | 最高化合价为+7价 |
| X | 最高价氧化物对应的水化物在本周期中碱性最强 |
| Y | 焰色反应为紫色(透过蓝色钴玻璃片) |
| Z | 地壳中含量最高的金属元素,其合金可用于制造飞机外壳 |
| M | 原子结构示意图为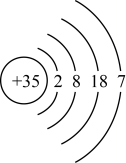 |
(1)Q元素所在周期表的位置为
(2)W单质的电子式为
(3)Z的单质与X的最高价氧化物对应的水化物反应的离子方程式为
(4)Y的金属性强于X,请结合原子结构解释其原因
(5)下列对于M及其化合物的推断中,正确的是
①M的最低负化合价与W的最低负化合价相同
②M的氢化物的稳定性弱于W的氢化物的稳定性
③M的单质可与X和W形成的化合物的水溶液发生置换反应
(6)与M位于同一主族,电子层数比M多一层的元素在生活中的用途是
您最近一年使用:0次
解答题-无机推断题
|
适中
(0.65)
名校
【推荐3】现有A、B、C、D、E、F六种短周期元素,它们的原子序数依次增大,A、D同主族,C与E同主族,D、E、F同周期,A、B的最外层电子数之和与C的最外层电子数相等, A能分别与B、C形成电子总数相等的分子,且A与C形成的化合物常温下为液态,A能分别与E、F形成电子总数相等的气体分子。请回答下列问题(题中的字母只代表元素代号,与实际元素符号无关):
(1)E的元素符号为__________ ,E、F的离子半径最小的是____ (填离子符号);
(2)ACD三种元素组成的一种常见化合物,是氯碱工业的重要的产品,该化合物电子式为__________ 。
(3)BC最简单的氢化物的稳定性最强的是__________ (填分子式)。
(4)B与F两种元素形成的一种化合物分子,各原子均达8电子结构,则该化合物化学式为___________ 。B和F两种元素还能形成另一种化合物,其中B显最高正价,该化合物能与水反应生成两种酸,请写出该化合物与水反应的化学方程式:______________ 。
(1)E的元素符号为
(2)ACD三种元素组成的一种常见化合物,是氯碱工业的重要的产品,该化合物电子式为
(3)BC最简单的氢化物的稳定性最强的是
(4)B与F两种元素形成的一种化合物分子,各原子均达8电子结构,则该化合物化学式为
您最近一年使用:0次
解答题-无机推断题
|
适中
(0.65)
【推荐1】现有下列短周期元素的数据。
回答下列问题:
(1)①号元素在周期表中的位置是_______ ;上述所列元素最高价氧化物的水化物的酸性最强的是_______ (填酸的化学式)。
(2)①④⑥三种元素简单离子的半径由小到大的顺序是_______ (填离子符号)。
(3)写出④的单质投入NaOH溶液中反应的离子方程式_______ 。
(4)下列说法不正确的是_______。
(5)用电子式表示⑤、⑥元素组成的化合物的形成过程:_______ 。
| 元素代号 | ① | ② | ③ | ④ | ⑤ | ⑥ | ⑦ | ⑧ |
| 原子半径(nm) | 0.074 | 0.160 | 0.152 | 0.143 | 0.099 | 0.186 | 0.075 | 0.082 |
| 最高正化合价 | +2 | +1 | +3 | +7 | +1 | +5 | +3 | |
| 最低负化合价 | -2 | -1 | -3 |
(1)①号元素在周期表中的位置是
(2)①④⑥三种元素简单离子的半径由小到大的顺序是
(3)写出④的单质投入NaOH溶液中反应的离子方程式
(4)下列说法不正确的是_______。
| A.最简单氢化物的稳定性:①>⑦ |
| B.最高价氧化物的水化物碱性:②>④ |
| C.与⑧号元素同主族的第四周期元素的单质是半导体材料 |
| D.③号元素的单质在氧气中加热可以得到两种氧化物 |
您最近一年使用:0次
解答题-无机推断题
|
适中
(0.65)
名校
【推荐2】A、B、C、D、E是原子序数依次增大的五种短周期元素。A原子的电子层数与它的核外电子总数相同,A与C、B与D分别为同主族,B和C的最外层电子数之和与E的最外层电子数相同,A与E形成的化合物化学式为AE,其分子中含18个电子。请回答下列问题:
(1)B元素 在周期表中的位置___________ ,写出E最高价氧化物对应水化物的化学式___________ 。
(2)由B、C两种元素形成的含共价键的化合物的电子式为___________ ,写出其与CO2反应的化学方程式并用双线桥标出电子转移的方向和数目___________
(3)写出E单质与A、B、C三种元素形成的化合物反应的离子方程式___________ 。
(4)A、B、C、D、E常见离子半径由大到小的顺序为___________ (用离子符号表示)。
(1)B元素 在周期表中的位置
(2)由B、C两种元素形成的含共价键的化合物的电子式为
(3)写出E单质与A、B、C三种元素形成的化合物反应的离子方程式
(4)A、B、C、D、E常见离子半径由大到小的顺序为
您最近一年使用:0次
解答题-无机推断题
|
适中
(0.65)
【推荐3】有A、B、C、D、E五种短周期元素,已知:①C+、D3+均与E的气态氢化物分子含有相同的电子数;A2-、B-与B的气态氢化物分子含有相同的电子数:②A单质在空气中燃烧产生气体R;③B的气态氢化物与E的气态氢化物相遇时有白烟生成。
请回答下列问题:
(1)元素A在元素周期表中的位置是___________ 。
(2)A、B、C、D的简单离子半径从大到小顺序为___________ (用离子符号表示)。
(3)B的气态氢化物与E的气态氢化物相遇时生成白烟,该白烟的电子式为___________ 。
(4)D的最高价氧化物的水化物与C的最高价氧化物的水化物反应的离子方程式为___________ 。
(5)A元素和B元素以原子个数比1∶1形成化合物Q,Q的结构式为___________ 。已知Q是种黄色油状液体,常温下遇水易反应,产生R气体,且溶液出现浑浊,请写出Q与水反应的化学方程式___________ 。
请回答下列问题:
(1)元素A在元素周期表中的位置是
(2)A、B、C、D的简单离子半径从大到小顺序为
(3)B的气态氢化物与E的气态氢化物相遇时生成白烟,该白烟的电子式为
(4)D的最高价氧化物的水化物与C的最高价氧化物的水化物反应的离子方程式为
(5)A元素和B元素以原子个数比1∶1形成化合物Q,Q的结构式为
您最近一年使用:0次



