某化学兴趣小组利用铜跟浓硫酸反应,探究SO2的部分性质,实验装置如图所示。
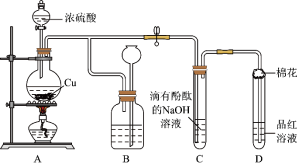
(1)装置A中发生的化学反应的化学方程式为________________________________ 。
(2)装置B的作用是贮存多余的气体,B中广口瓶内应盛放的液体是________ (填序号);
①水 ②饱和的NaHSO3溶液 ③NaOH溶液 ④酸性KMnO4
(3)装置C和D中产生的现象相同,但原因却不同。C中是由于SO2与溶液中的NaOH反应使碱性减弱,而D中则是由于SO2具有____________ 性。
(4)装置D中试管口塞一团棉花,棉花中应浸有一种液体,其作用是____________ 。
(5)若实验中用一定质量的铜片和25.0 mL 18.0 mol·L-1的浓硫酸在加热条件充分反应,最终铜片与硫酸均有剩余。假定反应前后溶液的体积不变,设剩余硫酸的浓度为d mol·L-1,现向反应后溶液中缓慢加入硝酸钾固体,充分搅拌直到剩余铜片恰好完全反应,反应消耗硝酸钾____________ mol(用含d的代数式表示)。
(6)SO2气体为无色气体,有强烈刺激性气味,是大气主要污染物之一,具有一定的还原性,探究SO2气体还原Fe3+、I2可以使用的药品和装置如图所示:
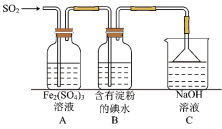
在上述装置中通入过量的SO2,为了验证A中SO2与Fe3+发生了氧化还原反应,取A中的溶液,分成两份,并设计了如下实验:
方案①:往第一份试液中加入少量酸性KMnO4溶液,紫红色褪去。
方案②:往第二份试液中加入KSCN溶液,不变红,再加入新制的氯水,溶液变红。
上述方案不合理的是_________ ,(填①或②)不合理的原因是____________ 。
(7)在上述装置中能表明SO2的还原性强于I2的现象是____________ 。

(1)装置A中发生的化学反应的化学方程式为
(2)装置B的作用是贮存多余的气体,B中广口瓶内应盛放的液体是
①水 ②饱和的NaHSO3溶液 ③NaOH溶液 ④酸性KMnO4
(3)装置C和D中产生的现象相同,但原因却不同。C中是由于SO2与溶液中的NaOH反应使碱性减弱,而D中则是由于SO2具有
(4)装置D中试管口塞一团棉花,棉花中应浸有一种液体,其作用是
(5)若实验中用一定质量的铜片和25.0 mL 18.0 mol·L-1的浓硫酸在加热条件充分反应,最终铜片与硫酸均有剩余。假定反应前后溶液的体积不变,设剩余硫酸的浓度为d mol·L-1,现向反应后溶液中缓慢加入硝酸钾固体,充分搅拌直到剩余铜片恰好完全反应,反应消耗硝酸钾
(6)SO2气体为无色气体,有强烈刺激性气味,是大气主要污染物之一,具有一定的还原性,探究SO2气体还原Fe3+、I2可以使用的药品和装置如图所示:

在上述装置中通入过量的SO2,为了验证A中SO2与Fe3+发生了氧化还原反应,取A中的溶液,分成两份,并设计了如下实验:
方案①:往第一份试液中加入少量酸性KMnO4溶液,紫红色褪去。
方案②:往第二份试液中加入KSCN溶液,不变红,再加入新制的氯水,溶液变红。
上述方案不合理的是
(7)在上述装置中能表明SO2的还原性强于I2的现象是
更新时间:2019-07-02 10:46:35
|
相似题推荐
解答题-无机推断题
|
较难
(0.4)
名校
解题方法
【推荐1】溶液A中存在Ba2+、Fe2+、Al3+、Fe3+、Cu2+、 、
、 、Cl-、
、Cl-、 、
、 中的五种离子,浓度均为0.01mol·L-1,溶液体积为1L。对溶液A进行以下实验,整个过程如图所示(部分产物省略),溶液B与溶液A中所含阴离子种类相同。
中的五种离子,浓度均为0.01mol·L-1,溶液体积为1L。对溶液A进行以下实验,整个过程如图所示(部分产物省略),溶液B与溶液A中所含阴离子种类相同。

已知:下表为相应阳离子形成氢氧化物沉淀时所对应的pH范围
请回答下列问题:
(1)溶液A中含有的离子为___________ 。
(2)反应①的离子方程式为___________ 。
(3)沉淀甲是___________ ,沉淀乙是___________ (填化学式)。
(4)固体C可能是___________ (填字母)。
a.CuO b.Cu(OH)2 c.CuSO4 d.CuCl2
(5)气体甲、气体乙都能造成环境问题,将等体积的气体甲和乙通入足量NaOH溶液中,被完全吸收,写出反应的离子方程式___________ 。
(6)若向原溶液A中加入足量的NaOH溶液,充分反应后将沉淀过滤、洗涤、干燥并灼烧至恒重,得到固体的质量为___________ g。
 、
、 、Cl-、
、Cl-、 、
、 中的五种离子,浓度均为0.01mol·L-1,溶液体积为1L。对溶液A进行以下实验,整个过程如图所示(部分产物省略),溶液B与溶液A中所含阴离子种类相同。
中的五种离子,浓度均为0.01mol·L-1,溶液体积为1L。对溶液A进行以下实验,整个过程如图所示(部分产物省略),溶液B与溶液A中所含阴离子种类相同。
已知:下表为相应阳离子形成氢氧化物沉淀时所对应的pH范围
| 阳离子 | 开始沉淀时pH | 沉淀完全时pH |
| Fe2+ | 5.9 | 8.4 |
| Fe3+ | 1.1 | 3.0 |
| Cu2+ | 4.2 | 6.7 |
| Al3+ | 3.0 | 4.7 |
(1)溶液A中含有的离子为
(2)反应①的离子方程式为
(3)沉淀甲是
(4)固体C可能是
a.CuO b.Cu(OH)2 c.CuSO4 d.CuCl2
(5)气体甲、气体乙都能造成环境问题,将等体积的气体甲和乙通入足量NaOH溶液中,被完全吸收,写出反应的离子方程式
(6)若向原溶液A中加入足量的NaOH溶液,充分反应后将沉淀过滤、洗涤、干燥并灼烧至恒重,得到固体的质量为
您最近一年使用:0次
解答题-无机推断题
|
较难
(0.4)
解题方法
【推荐2】有一瓶澄清溶液,其中可能含有NH4+、K+、Ba2+、Al3+、Fe3+、Mg2+、I-、NO3-、CO32-、SO42-、AlO2-。取该溶液进行以下实验:
①用pH试纸检验,溶液呈强酸性;
②取溶液适量,加入少量CCl4和数滴新制氯水,振荡,CCl4层呈紫红色;
③另取溶液适量,逐滴加入NaOH溶液:a.溶液从酸性变为碱性;b.溶液逐渐产生沉淀
c.沉淀完全溶解;d.最后加热溶液,有气体放出,该气体能使湿润的红色石蕊试纸变蓝。
其中产生沉淀的物质的量(n)与加入氢氧化钠溶液的体积(V)的关系如下图所示。
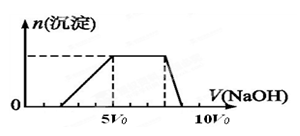
④取适量③得到的碱性溶液,加入Na2CO3溶液,有白色沉淀生成。
根据上述实验现象,回答下列问题。
(1)由①可以排除_______________________ 的存在。
(2)由②可以证明______________ 的存在;同时排除______________ 的存在;
(3)由①③可以推知该溶液中一定含有的阳离子是____________ ,它们的物质的量浓度比为_________________ 。
(4)由④可以证明______________ 的存在,同时排除___________________ 的存在。
①用pH试纸检验,溶液呈强酸性;
②取溶液适量,加入少量CCl4和数滴新制氯水,振荡,CCl4层呈紫红色;
③另取溶液适量,逐滴加入NaOH溶液:a.溶液从酸性变为碱性;b.溶液逐渐产生沉淀
c.沉淀完全溶解;d.最后加热溶液,有气体放出,该气体能使湿润的红色石蕊试纸变蓝。
其中产生沉淀的物质的量(n)与加入氢氧化钠溶液的体积(V)的关系如下图所示。

④取适量③得到的碱性溶液,加入Na2CO3溶液,有白色沉淀生成。
根据上述实验现象,回答下列问题。
(1)由①可以排除
(2)由②可以证明
(3)由①③可以推知该溶液中一定含有的阳离子是
(4)由④可以证明
您最近一年使用:0次
【推荐3】探究溶液中Ag+与单质S的反应。
资料:Ag2S不溶于6mol/L盐酸,Ag2SO3和Ag2SO4在6mol/L盐酸中均发生沉淀的转化
实验I:将10mL0.04mol/LAgNO3溶液与0.01gS粉混合,水浴加热,充分反应后,过滤,得到无色溶液a(pH≈1),沉淀除S、洗涤后得到黑色固体b。
(1)研究黑色固体b的组成
①根据S具有_______ 性,推测b中可能含有Ag2S、Ag、Ag2SO3或Ag2SO4。
②检验黑色固体b的成分
实验II:具体操作如图所示
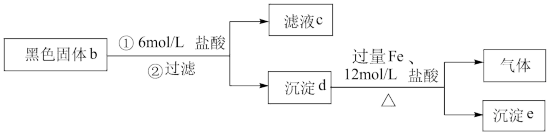
i.取少量滤液c,先加入足量稀盐酸,再滴加BaCl2溶液,未出现白色沉淀,判断黑色固体b中不含_______ 。
ii.用滤液c继续实验证明了黑色固体b中不含Ag2SO3,可选择的试剂是_______ (填序号)。
a.酸性KMnO4溶液 b.H2O2和BaCl2的混合溶液 c.溴水
iii.进一步实验证实了黑色固体b中不含Ag。根据沉淀e含有Ag、气体含有H2S,写出同时生成Ag和H2S的离子方程式:_______ 。
(2)研究无色溶液a的组成
结合上述实验结果,分析溶液a中可能存在 或H2SO3,依据是
或H2SO3,依据是_______ 。
实验III:具体操作如图所示

①说明溶液a中不含H2SO3的实验证据是_______ 。
②加入足量稀盐酸的作用是_______ 。
(3)在注射器中进行实验IV,探究Ag2SO4溶液与S的反应,所得产物与实验I相同。
①向注射器中加入的物质是_______ 。
②改用Ag2SO4溶液的目的是_______ 。
资料:Ag2S不溶于6mol/L盐酸,Ag2SO3和Ag2SO4在6mol/L盐酸中均发生沉淀的转化
实验I:将10mL0.04mol/LAgNO3溶液与0.01gS粉混合,水浴加热,充分反应后,过滤,得到无色溶液a(pH≈1),沉淀除S、洗涤后得到黑色固体b。
(1)研究黑色固体b的组成
①根据S具有
②检验黑色固体b的成分
实验II:具体操作如图所示

i.取少量滤液c,先加入足量稀盐酸,再滴加BaCl2溶液,未出现白色沉淀,判断黑色固体b中不含
ii.用滤液c继续实验证明了黑色固体b中不含Ag2SO3,可选择的试剂是
a.酸性KMnO4溶液 b.H2O2和BaCl2的混合溶液 c.溴水
iii.进一步实验证实了黑色固体b中不含Ag。根据沉淀e含有Ag、气体含有H2S,写出同时生成Ag和H2S的离子方程式:
(2)研究无色溶液a的组成
结合上述实验结果,分析溶液a中可能存在
 或H2SO3,依据是
或H2SO3,依据是实验III:具体操作如图所示

①说明溶液a中不含H2SO3的实验证据是
②加入足量稀盐酸的作用是
(3)在注射器中进行实验IV,探究Ag2SO4溶液与S的反应,所得产物与实验I相同。
①向注射器中加入的物质是
②改用Ag2SO4溶液的目的是
您最近一年使用:0次
解答题-实验探究题
|
较难
(0.4)
名校
解题方法
【推荐1】某化学兴趣小组在实验室用除去表面氧化物的铁钉(碳素钢)与浓硫酸共热制取 并完成相关性质探究(不考虑水蒸气)。
并完成相关性质探究(不考虑水蒸气)。
(1)有同学认为制得的 中可能混有杂质,其化学式为
中可能混有杂质,其化学式为___________ 和___________ 。
(2)为验证气体成分,兴趣小组同学设计了下图所示装置进行了实验探究。
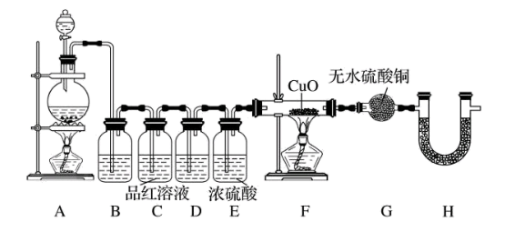
①为验证并吸收 ,装置B中加入的试剂为
,装置B中加入的试剂为___________ ,装置C中品红溶液的作用是___________ 。
②装置D中加入的试剂为___________ 。
③装置G中可能出现的现象为___________ 。
④装置H的作用为___________ 。
(3)兴趣小组设计如图装置验证二氧化硫的化学性质。
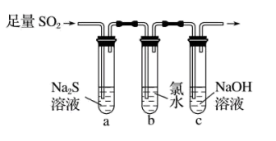
①能验证 具有氧化性的实验现象为
具有氧化性的实验现象为___________ 。
②为验证 的还原性,取试管b中充分反应后的溶液分成三份,分别进行如下实验:。
的还原性,取试管b中充分反应后的溶液分成三份,分别进行如下实验:。
方案Ⅰ:向第一份溶液加入品红溶液,红色褪去
方案Ⅱ:向第二份溶液加入 溶液,产生白色沉淀
溶液,产生白色沉淀
方案Ⅲ:向第三份溶液中加入 溶液,有白色沉淀生成
溶液,有白色沉淀生成
上述方案中合理的是___________ (填“Ⅰ”“Ⅱ”或“Ⅲ”);试管b中发生反应的离子方程式为___________ 。
 并完成相关性质探究(不考虑水蒸气)。
并完成相关性质探究(不考虑水蒸气)。(1)有同学认为制得的
 中可能混有杂质,其化学式为
中可能混有杂质,其化学式为(2)为验证气体成分,兴趣小组同学设计了下图所示装置进行了实验探究。

①为验证并吸收
 ,装置B中加入的试剂为
,装置B中加入的试剂为②装置D中加入的试剂为
③装置G中可能出现的现象为
④装置H的作用为
(3)兴趣小组设计如图装置验证二氧化硫的化学性质。

①能验证
 具有氧化性的实验现象为
具有氧化性的实验现象为②为验证
 的还原性,取试管b中充分反应后的溶液分成三份,分别进行如下实验:。
的还原性,取试管b中充分反应后的溶液分成三份,分别进行如下实验:。方案Ⅰ:向第一份溶液加入品红溶液,红色褪去
方案Ⅱ:向第二份溶液加入
 溶液,产生白色沉淀
溶液,产生白色沉淀方案Ⅲ:向第三份溶液中加入
 溶液,有白色沉淀生成
溶液,有白色沉淀生成上述方案中合理的是
您最近一年使用:0次
【推荐2】海水是资源丰富的大宝库,开发和利用海洋资源是当前科学研究的一项重要任务。海水中提取出的碘单质在医药学上有着重要作用,比如华素片又称西地碘含片,主要用于治疗慢性咽喉炎、口腔溃疡、慢性牙龈炎和牙周炎,其主要活性成分是分子碘。三个探究学习小组为研究华素片中的活性成分,进行如下实验,回答下列问题:
(1)甲组同学取2片华素片研细,置于锥形瓶中,加入约10mL蒸馏水溶解,再加入约2mL___________(填序号),溶液变为蓝色,证明含有活性成分。
(2)乙组同学取2片华素片研细,置于锥形瓶中,加入约10mL蒸馏水溶解,再加入约2mL___________ (填序号),溶液分层,且___________ 层为___________ 色,证明含有活性成分。
A.酒精 B. 溶液 C.淀粉溶液 D.四氯化碳
溶液 C.淀粉溶液 D.四氯化碳
(3)丙组同学用乙组同样方法验证后,将溶液转入___________ (仪器名),进行___________ 操作,将两层液体进行分离。
空气吹出法是海水提溴的常用方法,溴及其衍生物是制药业和制取阻燃剂、钻井液等的重要原料,海水提溴的一般流程如下:
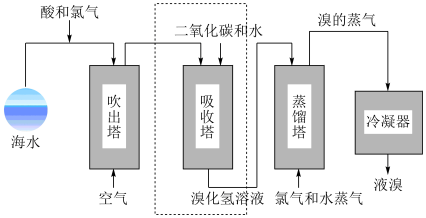
(4)吸收塔中用 的水溶液吸收
的水溶液吸收 ,吸收率可达95%,写出有关反应的化学方程式并标出电子转移的方向和数目
,吸收率可达95%,写出有关反应的化学方程式并标出电子转移的方向和数目___________ 。
(5)进行虚线框内的工艺流程的目的是___________ 。
(6)已知海水中 含量为
含量为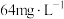 ,依据上述流程,若将
,依据上述流程,若将 海水中的溴元素转化为工业溴,至少需要标准状况下
海水中的溴元素转化为工业溴,至少需要标准状况下 的体积为
的体积为___________ L(忽略 的溶解)。
的溶解)。
海水提溴、海带提碘的工艺中,氯气起着重要的氧化作用,为验证与其他物质氧化性的相对强弱,小组分别进行如下实验:
一号小组用下图所示装置进行实验(夹持仪器和A中加热装置已略,气密性已检验),A装置用于制备,C装置用于制备 。
。
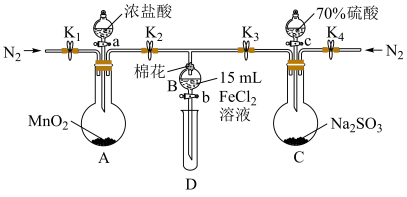
(7)若用100mL 的浓盐酸与足量的
的浓盐酸与足量的 制备
制备 ,则被氧化的HCI的物质的量为0.1mol,该说法
,则被氧化的HCI的物质的量为0.1mol,该说法___________ 。
A.正确 B.错误
(8)现将A中产生的气体通入B中,可以观察到溶液颜色变黄色,化学方程式为_________ 。
(9)若将制取的 通入氯化铁溶液,可以使溶液颜色变绿,写出反应的离子方程式:
通入氯化铁溶液,可以使溶液颜色变绿,写出反应的离子方程式:_____ 。
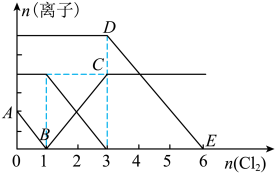
(10)二号小组向 、
、 的混合溶液,通入一定量氯气,溶液中各种离子物质的量的变化如图所示,线段BC表示
的混合溶液,通入一定量氯气,溶液中各种离子物质的量的变化如图所示,线段BC表示___________ (填离子符号)物质的量的变化,原混合溶液
___________ 。
(1)甲组同学取2片华素片研细,置于锥形瓶中,加入约10mL蒸馏水溶解,再加入约2mL___________(填序号),溶液变为蓝色,证明含有活性成分。
| A.酒精 | B. 溶液 溶液 | C.淀粉溶液 | D.四氯化碳 |
(2)乙组同学取2片华素片研细,置于锥形瓶中,加入约10mL蒸馏水溶解,再加入约2mL
A.酒精 B.
 溶液 C.淀粉溶液 D.四氯化碳
溶液 C.淀粉溶液 D.四氯化碳(3)丙组同学用乙组同样方法验证后,将溶液转入
空气吹出法是海水提溴的常用方法,溴及其衍生物是制药业和制取阻燃剂、钻井液等的重要原料,海水提溴的一般流程如下:

(4)吸收塔中用
 的水溶液吸收
的水溶液吸收 ,吸收率可达95%,写出有关反应的化学方程式并标出电子转移的方向和数目
,吸收率可达95%,写出有关反应的化学方程式并标出电子转移的方向和数目(5)进行虚线框内的工艺流程的目的是
(6)已知海水中
 含量为
含量为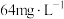 ,依据上述流程,若将
,依据上述流程,若将 海水中的溴元素转化为工业溴,至少需要标准状况下
海水中的溴元素转化为工业溴,至少需要标准状况下 的体积为
的体积为 的溶解)。
的溶解)。海水提溴、海带提碘的工艺中,氯气起着重要的氧化作用,为验证与其他物质氧化性的相对强弱,小组分别进行如下实验:
一号小组用下图所示装置进行实验(夹持仪器和A中加热装置已略,气密性已检验),A装置用于制备,C装置用于制备
 。
。
(7)若用100mL
 的浓盐酸与足量的
的浓盐酸与足量的 制备
制备 ,则被氧化的HCI的物质的量为0.1mol,该说法
,则被氧化的HCI的物质的量为0.1mol,该说法A.正确 B.错误
(8)现将A中产生的气体通入B中,可以观察到溶液颜色变黄色,化学方程式为
(9)若将制取的
 通入氯化铁溶液,可以使溶液颜色变绿,写出反应的离子方程式:
通入氯化铁溶液,可以使溶液颜色变绿,写出反应的离子方程式:(10)二号小组向
 、
、 的混合溶液,通入一定量氯气,溶液中各种离子物质的量的变化如图所示,线段BC表示
的混合溶液,通入一定量氯气,溶液中各种离子物质的量的变化如图所示,线段BC表示

您最近一年使用:0次
解答题-实验探究题
|
较难
(0.4)
名校
解题方法
【推荐3】某同学想利用图示装置(夹持装置已略去)实验,探究SO2与Na2O2反应的产物。
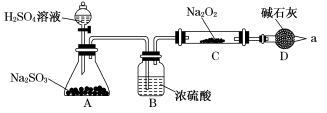
测得反应前C管的质量为m1g,反应后C管的质量为m2g,反应后装置D质量增加了ng。请分析:
I.装置B的作用___________ ;装置D的作用___________ 。
II.对C中固体产物提出如下假设:
假设1:只有Na2SO3
假设2:只有Na2SO4
假设3:___________ 。
(1)若Na2O2反应完全,为确定C中固体产物的成分,甲同学设计如下实验:将C中的固体配成溶液,加Ba(NO3)2溶液,得到白色沉淀,加足量稀硝酸,沉淀不溶解。得出结论:产物是Na2SO4。该方案是否合理___________ (填“是”或“否”),理由是___________ 。
(2)若假设1成立,某同学以反应前后C管的质量差(m2-m1)g为依据推断生成Na2SO3的质量为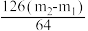 g。老师提示推算不合理,请你分析其中的缘由,
g。老师提示推算不合理,请你分析其中的缘由,___________ 。
(3)若假设2成立,则参加反应的Na2O2的物质的量为___________ mol(列计算式)。

测得反应前C管的质量为m1g,反应后C管的质量为m2g,反应后装置D质量增加了ng。请分析:
I.装置B的作用
II.对C中固体产物提出如下假设:
假设1:只有Na2SO3
假设2:只有Na2SO4
假设3:
(1)若Na2O2反应完全,为确定C中固体产物的成分,甲同学设计如下实验:将C中的固体配成溶液,加Ba(NO3)2溶液,得到白色沉淀,加足量稀硝酸,沉淀不溶解。得出结论:产物是Na2SO4。该方案是否合理
(2)若假设1成立,某同学以反应前后C管的质量差(m2-m1)g为依据推断生成Na2SO3的质量为
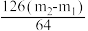 g。老师提示推算不合理,请你分析其中的缘由,
g。老师提示推算不合理,请你分析其中的缘由,(3)若假设2成立,则参加反应的Na2O2的物质的量为
您最近一年使用:0次
解答题-实验探究题
|
较难
(0.4)
【推荐1】某学习小组利用下图装置探究铜与浓H2SO4的反应(夹持装置和A中加热装置已略,气密性已检验)。
资料:微量Cu2+与过量NaOH溶液发生反应:Cu2++4OH− =[Cu(OH)4]2−,[Cu(OH)4]2−溶于甘油形成特征的绛蓝色溶液。
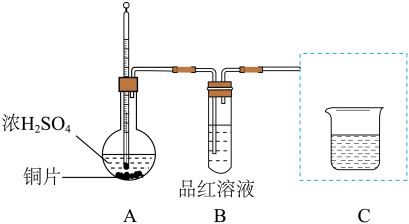
(1)A中反应的化学方程式是________ 。
(2)将装置C补充完整并标明所用试剂________ 。
(3)实验I中,铜片表面的黑色沉淀可能含CuO、Cu2S或CuS。为探究黑色沉淀的成分,取出反应后的铜片,用水小心冲洗后,进行下列操作:
甲认为通过上述两个实验证明黑色沉淀不含CuO,理由是________ 。
②乙同学认为仅通过颜色判断不能得出上述结论,理由是______ 。需要增加实验iii,说明黑色沉淀不含CuO,实验iii的操作和现象是_______ 。
(4)甲同学对黑色沉淀成分继续探究,补全实验方案:
(5)用仪器分析黑色沉淀的成分,数据如下:
230℃时黑色沉淀的成分是__________ 。
(6)为探究黑色沉淀消失的原因,取230℃时的黑色沉淀,加入浓H2SO4,加热至250℃时,黑色沉淀溶解,有刺激性气味的气体生成,试管底部出现淡黄色固体,溶液变蓝。用化学方程式解释原因____ 。
(7)综合上述实验过程,说明Cu和浓H2SO4除发生主反应外,还发生着其他副反应,为了避免副反应的发生,Cu和浓H2SO4反应的实验方案是______ 。
资料:微量Cu2+与过量NaOH溶液发生反应:Cu2++4OH− =[Cu(OH)4]2−,[Cu(OH)4]2−溶于甘油形成特征的绛蓝色溶液。

| 编号 | 实验用品 | 实验现象 | |
| I | 10mL 15mol/L 浓H2SO4溶液 | 过量铜片 | 剧烈反应,品红溶液褪色,150℃时铜片表面产生大量黑色沉淀,继续加热,250℃时黑色沉淀消失。 |
| II | 10mL 15mol/L 浓H2SO4溶液 | 适量铜片 | 剧烈反应,品红溶液褪色,150℃时铜片表面产生少量黑色沉淀,继续加热,250℃时黑色沉淀消失。 |
(1)A中反应的化学方程式是
(2)将装置C补充完整并标明所用试剂
(3)实验I中,铜片表面的黑色沉淀可能含CuO、Cu2S或CuS。为探究黑色沉淀的成分,取出反应后的铜片,用水小心冲洗后,进行下列操作:
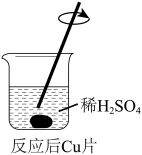 |  |
| i. 黑色沉淀脱落,一段时间后,上层溶液呈无色。 | ii. 开始时,上层溶液呈无色,一段时间后,上层溶液呈淡蓝色。 |
甲认为通过上述两个实验证明黑色沉淀不含CuO,理由是
②乙同学认为仅通过颜色判断不能得出上述结论,理由是
(4)甲同学对黑色沉淀成分继续探究,补全实验方案:
| 编号 | 实验操作 | 实验现象 |
| iv | 取洗净后的黑色沉淀,加入适量 | 黑色沉淀全部溶解,试管上部出现红棕色气体,底部有淡黄色固体生成。 |
(5)用仪器分析黑色沉淀的成分,数据如下:
| 150℃取样 | 230℃取样 |
| 铜元素3.2g,硫元0.96g。 | 铜元素1.28g,硫元0.64g。 |
230℃时黑色沉淀的成分是
(6)为探究黑色沉淀消失的原因,取230℃时的黑色沉淀,加入浓H2SO4,加热至250℃时,黑色沉淀溶解,有刺激性气味的气体生成,试管底部出现淡黄色固体,溶液变蓝。用化学方程式解释原因
(7)综合上述实验过程,说明Cu和浓H2SO4除发生主反应外,还发生着其他副反应,为了避免副反应的发生,Cu和浓H2SO4反应的实验方案是
您最近一年使用:0次
解答题-工业流程题
|
较难
(0.4)
名校
【推荐2】硝酸铜是一种重要的化工原料,可由工业含铜废料制备,含铜废料的主要成分为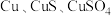 等,制备流程如图所示:
等,制备流程如图所示:
(1)焙烧时, 与空气中的
与空气中的 反应生成
反应生成 和
和 ,该反应的化学方程式为
,该反应的化学方程式为___________ 。
(2)“淘洗”所用的溶液A可以是___________ 。(填标号)。
a.稀硝酸 b.浓硝酸 c.稀硫酸 d.浓硫酸
(3)“反应”阶段所用的试剂是20%的 溶液和10%的
溶液和10%的 溶液,反应过程中无红棕色气体生成。
溶液,反应过程中无红棕色气体生成。
①理论上反应所消耗的 和
和 的物质的量之比为
的物质的量之比为___________ 。
②若不加10%的 溶液,只用20%的
溶液,只用20%的 溶液,随着反应的进行,温度上升并出现大量红棕色气体,反应的离子方程式为
溶液,随着反应的进行,温度上升并出现大量红棕色气体,反应的离子方程式为___________ 。
③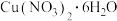 和
和 的溶解度如图所示。从“反应”阶段所得溶液中析出
的溶解度如图所示。从“反应”阶段所得溶液中析出 的方法是
的方法是___________ 。
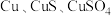 等,制备流程如图所示:
等,制备流程如图所示: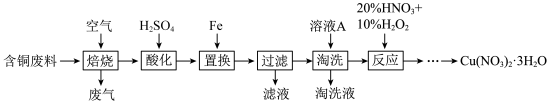
(1)焙烧时,
 与空气中的
与空气中的 反应生成
反应生成 和
和 ,该反应的化学方程式为
,该反应的化学方程式为(2)“淘洗”所用的溶液A可以是
a.稀硝酸 b.浓硝酸 c.稀硫酸 d.浓硫酸
(3)“反应”阶段所用的试剂是20%的
 溶液和10%的
溶液和10%的 溶液,反应过程中无红棕色气体生成。
溶液,反应过程中无红棕色气体生成。①理论上反应所消耗的
 和
和 的物质的量之比为
的物质的量之比为②若不加10%的
 溶液,只用20%的
溶液,只用20%的 溶液,随着反应的进行,温度上升并出现大量红棕色气体,反应的离子方程式为
溶液,随着反应的进行,温度上升并出现大量红棕色气体,反应的离子方程式为③
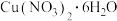 和
和 的溶解度如图所示。从“反应”阶段所得溶液中析出
的溶解度如图所示。从“反应”阶段所得溶液中析出 的方法是
的方法是
您最近一年使用:0次
解答题-实验探究题
|
较难
(0.4)
名校
解题方法
【推荐3】某校课外活动小组为了探究铜与稀硝酸反应产生的是NO气体,设计了如下实验。实验装置如图所示:
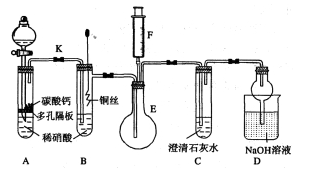
(1)设计装置A的目的是_____________________________________________ ,
为达此目的应进行的操作是______________________________________ ;
A中反应的化学方程式是_________________________________________ 。
(2)在(1)中的操作后将装置B中铜丝插入稀硝酸,并微热之,观察到装置B中的现象是__________________________________________ ;
B中反应的离子方程式是________________________________________ 。
(3)装置E和F的作用是____________________________________ ;
为实现此目的,操作方法是__________________________________________ 。
(4)D装置的作用是____________________________________ 。

(1)设计装置A的目的是
为达此目的应进行的操作是
A中反应的化学方程式是
(2)在(1)中的操作后将装置B中铜丝插入稀硝酸,并微热之,观察到装置B中的现象是
B中反应的离子方程式是
(3)装置E和F的作用是
为实现此目的,操作方法是
(4)D装置的作用是
您最近一年使用:0次
解答题-实验探究题
|
较难
(0.4)
名校
解题方法
【推荐1】某学习小组设计了如图装置用于制取SO2并验证其性质。

(1)仪器a的名称为___ ,实验时装置E中溶液的现象为___ 。
(2)若装置B中溶液无明显现象,装置C中溶液红色褪去,则使品红的水溶液褪色的含硫微粒一定不是___ (填化学式)。
(3)该实验小组的甲、乙两位同学为了进一步探究SO2的漂白性,按如图装置继续进行实验并记录相关实验现象。

①装置中浓硫酸的作用为___ 。
②根据表中实验现象做出合理解释。
(4)该实验小组的学生丙预测装置D中没有白色沉淀产生,但随着反应的进行,发现装置D中产生了少量白色沉淀。为进一步探究产生沉淀的原因,分别用煮沸和未煮沸过的蒸馏水配制的Ba(NO3)2和BaCl2溶液,进行如图实验:
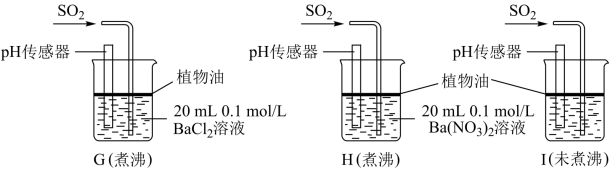
实验中G、H、I烧杯中观察到的现象如表:
①据G中现象推测D中产生的白色沉淀的化学式是___ 。
②写出H中白色沉淀产生的离子方程式___ 。
③据I中出现白色沉淀的速率比H中快很多 的现象,推测其根本原因可能是___ 。
(5)该实验小组的学生丁用200mL0.1mol•L-1酸性KMnO4溶液测定空气中SO2含量,若气体流速为acm3•min-1,当tmin时酸性KMnO4溶液恰好褪色,则空气中SO2的含量为___ (g•cm-3)。

(1)仪器a的名称为
(2)若装置B中溶液无明显现象,装置C中溶液红色褪去,则使品红的水溶液褪色的含硫微粒一定不是
(3)该实验小组的甲、乙两位同学为了进一步探究SO2的漂白性,按如图装置继续进行实验并记录相关实验现象。

①装置中浓硫酸的作用为
②根据表中实验现象做出合理解释。
| 组别 | 实验现象 | 合理解释 |
| 甲 | 品红溶液几乎不褪色 | 反应方程式为 |
| 乙 | 品红溶液随时间的推移变得越来越浅 | 原因可能是 |

实验中G、H、I烧杯中观察到的现象如表:
| 烧杯 | 实验现象 |
| G | 无白色沉淀产生,pH传感器测的溶液pH=5.3 |
| H | 有白色沉淀产生 |
| I | 有白色沉淀产生,I中出现白色沉淀比H中快很多 |
②写出H中白色沉淀产生的离子方程式
③据I中出现白色沉淀的速率比H中
(5)该实验小组的学生丁用200mL0.1mol•L-1酸性KMnO4溶液测定空气中SO2含量,若气体流速为acm3•min-1,当tmin时酸性KMnO4溶液恰好褪色,则空气中SO2的含量为
您最近一年使用:0次
解答题-实验探究题
|
较难
(0.4)
名校
【推荐2】某同学对教材中铜与浓硫酸的实验作出如下改进。实验装置如图所示(加热和夹持装置已略去)。

实验步骤:
①组装仪器,检查装置气密性;
②加入试剂,关闭旋塞E,加热A,观察C中溶液颜色变化;
③将铜丝上提离开液面,停止加热。
(1)检查虚线框内装置气密性的方法是____________________________ 。
(2)装置A的名称是________ ,装置B的作用是_________ ,装置D中所盛药品是__________ 。
(3)装置A中发生反应的化学方程式为____________________________ 。
(4)实验后,拆除装置前,为避免有害气体的泄漏,应当采取的操作是__________ 。
(5)实验后装置A中有白色固体产生,将装置A中固液混合物缓慢转移至盛有少量水的烧杯中,可观察到的现象是______________ ;不可直接向装置A中加水的原因是__________ 。

实验步骤:
①组装仪器,检查装置气密性;
②加入试剂,关闭旋塞E,加热A,观察C中溶液颜色变化;
③将铜丝上提离开液面,停止加热。
(1)检查虚线框内装置气密性的方法是
(2)装置A的名称是
(3)装置A中发生反应的化学方程式为
(4)实验后,拆除装置前,为避免有害气体的泄漏,应当采取的操作是
(5)实验后装置A中有白色固体产生,将装置A中固液混合物缓慢转移至盛有少量水的烧杯中,可观察到的现象是
您最近一年使用:0次
解答题-实验探究题
|
较难
(0.4)
名校
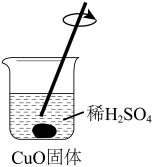
【推荐3】氧化铜是一种黑色固体,可溶于稀硫酸。某同学想知道稀硫酸中的哪种粒子(H2O、H+、SO42-)能使氧化铜溶解。请你和他一起通过下图所示Ⅰ、Ⅱ和Ⅲ三个实验完成这次探究活动。
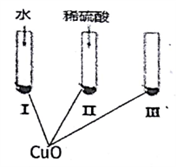
(1)通过实验I可以证明___________________ 。
(2)要证明另外两种粒子能否溶解氧化铜,还需要进行实验Ⅱ和Ⅲ,在Ⅱ中加入稀硫酸后氧化铜溶解,则进一步确认的实验操作是: 在Ⅲ中先加入__________ ,再加入_________ 。
(3)探究结果为__________ 。
(4)反应的离子方程式为__________ 。

(1)通过实验I可以证明
(2)要证明另外两种粒子能否溶解氧化铜,还需要进行实验Ⅱ和Ⅲ,在Ⅱ中加入稀硫酸后氧化铜溶解,则进一步确认的实验操作是: 在Ⅲ中先加入
(3)探究结果为
(4)反应的离子方程式为
您最近一年使用:0次



