氯碱厂电解饱和食盐水制取的工艺流程图如下:
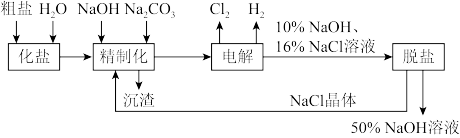
(1)在电解过程中,与电源正极相连的电极上所发生反应的电极反应式为______________ ,与电源负极相连的电极上所发生反应的电极反应式为__________________ 。
(2)工业食盐含Ca2+、Mg2+等杂质,精制过程中发生反应的离子方程式为________________________________________________________________________ 。
(3)如果粗盐中 含量较高,必须添加钡试剂除去
含量较高,必须添加钡试剂除去 ,该钡试剂可以是
,该钡试剂可以是______ (填字母)。
a、Ba(OH)2 b、Ba(NO3)2 c、BaCl2
(4)为有效除去Ca2+、Mg2+、 ,加入试剂的合理顺序为
,加入试剂的合理顺序为________ 。
a、先加NaOH,后加Na2CO3,再加钡试剂
b、先加NaOH,后加钡试剂,再加Na2CO3
c、先加钡试剂,后加NaOH,再加Na2CO3
(5)脱盐工序中利用NaOH和NaCl在溶解度上的差异,通过________ 、冷却、结晶、________ (填写操作名称)除去NaCl。

(1)在电解过程中,与电源正极相连的电极上所发生反应的电极反应式为
(2)工业食盐含Ca2+、Mg2+等杂质,精制过程中发生反应的离子方程式为
(3)如果粗盐中
 含量较高,必须添加钡试剂除去
含量较高,必须添加钡试剂除去 ,该钡试剂可以是
,该钡试剂可以是a、Ba(OH)2 b、Ba(NO3)2 c、BaCl2
(4)为有效除去Ca2+、Mg2+、
 ,加入试剂的合理顺序为
,加入试剂的合理顺序为a、先加NaOH,后加Na2CO3,再加钡试剂
b、先加NaOH,后加钡试剂,再加Na2CO3
c、先加钡试剂,后加NaOH,再加Na2CO3
(5)脱盐工序中利用NaOH和NaCl在溶解度上的差异,通过
更新时间:2019-08-25 15:28:35
|
相似题推荐
解答题-原理综合题
|
适中
(0.65)
解题方法
【推荐1】2016年冬季全国大部分地区出现雾霾现象,汽车尾气是造成雾霾的原因之一,汽车尾气含CO、NO等有毒气体。为了减少CO 对大气的污染,某研究性学习小组拟研究CO和H2O 反应转化为绿色能源H2。己如:
2CO(g)+O2(g)=2CO2(g); △H= -566kJ·moL-1
2H2(g)+O2(g)=2H2O(g); △H=-483.6kJ·moL-1
H2O(g)=H2O(l) △H= -44.0kJ·moL-1
(1)氢气燃烧热△H=_____________________ 。
(2)写出CO 和H2O(g)作用生成CO2 和H2的热化学方程式______________________ 。
(3)往1L 体积不变的容器中加入0.200molCO和1.00molH2O(g),在t℃时反应并达到平衡,若该反应的化学平衡常数K=1(方程式中各物质前化学计量数为最简整数比),则t℃时CO的转化率为____________ ;反应达到平衡后,升高温度,此时平衡常数将____________ (填“变大”、“ 不变”或“变 小”)。
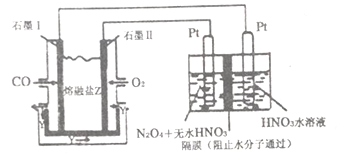
(4)从汽车尾气中分离出CO 与O2、与熔融盐Na2CO3组成燃料电池,同时采用电解法制备N2O5,装置如下图所示,其中Y为CO2。写出石墨Ⅰ电极上发生反应的电极反应式________________ 。在电解池中生成N2O5的电极反应式为______________________ 。
(5)已知氢氧化钙和钨酸钙(CaWO4)都是微溶电解质,两者的溶解度均随温度升高而减小。下图为不同温度下Ca(OH)2、CaWO4的沉淀溶解平衡曲线,则:
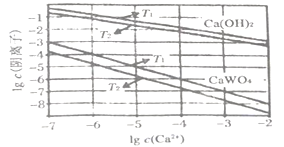
T1___________ T2 (填“>”或“<”),T1时Ksp (CaWO4)=________ 。
2CO(g)+O2(g)=2CO2(g); △H= -566kJ·moL-1
2H2(g)+O2(g)=2H2O(g); △H=-483.6kJ·moL-1
H2O(g)=H2O(l) △H= -44.0kJ·moL-1
(1)氢气燃烧热△H=
(2)写出CO 和H2O(g)作用生成CO2 和H2的热化学方程式
(3)往1L 体积不变的容器中加入0.200molCO和1.00molH2O(g),在t℃时反应并达到平衡,若该反应的化学平衡常数K=1(方程式中各物质前化学计量数为最简整数比),则t℃时CO的转化率为
(4)从汽车尾气中分离出CO 与O2、与熔融盐Na2CO3组成燃料电池,同时采用电解法制备N2O5,装置如下图所示,其中Y为CO2。写出石墨Ⅰ电极上发生反应的电极反应式

(5)已知氢氧化钙和钨酸钙(CaWO4)都是微溶电解质,两者的溶解度均随温度升高而减小。下图为不同温度下Ca(OH)2、CaWO4的沉淀溶解平衡曲线,则:

T1
您最近半年使用:0次
【推荐2】我国向国际社会承诺2030年“碳达峰”,2060年实现“碳中和”。研发CO2资源化利用技术,降低空气中CO2含量成为世界各国研究热点。
(1)CO2和CH4重整可制合成气(主要成分为CO和H2),其热化学反应方程式:
CO2(g)+CH4(g)=2CO(g)+2H2(g) ΔH=+247kJ·mol-1
已知下列热化学反应方程式:
反应1:C(s)+2H2(g) = CH4(g) ΔH1
反应2:CO(g)+H2O(g)=CO2(g)+H2(g) ΔH2 =-40.0kJ·mol-1
反应3:C(s)+H2O(g)=CO(g)+H2(g) ΔH3 =+132.0kJ·mol-1
①ΔH1 =_______ kJ·mol-1
②CO(g)+H2O(l)=CO2(g)+H2(g) ΔH_______ -40.0kJ·mol-1(填“<”“>”或“=”)
③反应3中加入催化剂,ΔH3_______ (填“减小”“增大”或“不变”)
(2)二甲醚(CH3OCH3)被认为是最具潜力的燃料。在密闭容器中充入CO2与H2反应可以制得CH3OCH3:2CO2(g)+6H2(g) CH3OCH3(g)+3H2O(g);采用催化剂A和催化剂B分别发生上述反应,测得反应进行相同时间时H2的转化率α(H2)随反应温度T的变化曲线如图所示(忽略温度对催化剂活性的影响):
CH3OCH3(g)+3H2O(g);采用催化剂A和催化剂B分别发生上述反应,测得反应进行相同时间时H2的转化率α(H2)随反应温度T的变化曲线如图所示(忽略温度对催化剂活性的影响):

①该反应为_______ 反应(填“吸热”或“放热”)
②下列哪种情况的活化能更大_______
a. 催化剂A作用下的反应 b. 催化剂B作用下的反应
③600K达到平衡时,反应在催化剂A作用下的转化率_______ (填“高于”、“低于”或“等于”)在催化剂B作用下的转化率。
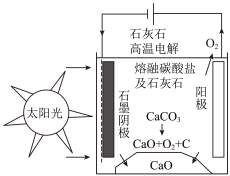
(3)研究出一种方法,可实现水泥生产时CO2零排放,其基本原理如图所示。温度小于900℃时进行电解反应,碳酸钙先分解为CaO和CO2,电解质为熔融碳酸钠,阳极的电极反应式为2CO - 4e-= 2CO2↑ + O2↑,则阴极的电极反应式为
- 4e-= 2CO2↑ + O2↑,则阴极的电极反应式为_______ 。
(1)CO2和CH4重整可制合成气(主要成分为CO和H2),其热化学反应方程式:
CO2(g)+CH4(g)=2CO(g)+2H2(g) ΔH=+247kJ·mol-1
已知下列热化学反应方程式:
反应1:C(s)+2H2(g) = CH4(g) ΔH1
反应2:CO(g)+H2O(g)=CO2(g)+H2(g) ΔH2 =-40.0kJ·mol-1
反应3:C(s)+H2O(g)=CO(g)+H2(g) ΔH3 =+132.0kJ·mol-1
①ΔH1 =
②CO(g)+H2O(l)=CO2(g)+H2(g) ΔH
③反应3中加入催化剂,ΔH3
(2)二甲醚(CH3OCH3)被认为是最具潜力的燃料。在密闭容器中充入CO2与H2反应可以制得CH3OCH3:2CO2(g)+6H2(g)
 CH3OCH3(g)+3H2O(g);采用催化剂A和催化剂B分别发生上述反应,测得反应进行相同时间时H2的转化率α(H2)随反应温度T的变化曲线如图所示(忽略温度对催化剂活性的影响):
CH3OCH3(g)+3H2O(g);采用催化剂A和催化剂B分别发生上述反应,测得反应进行相同时间时H2的转化率α(H2)随反应温度T的变化曲线如图所示(忽略温度对催化剂活性的影响):
①该反应为
②下列哪种情况的活化能更大
a. 催化剂A作用下的反应 b. 催化剂B作用下的反应
③600K达到平衡时,反应在催化剂A作用下的转化率
(3)研究出一种方法,可实现水泥生产时CO2零排放,其基本原理如图所示。温度小于900℃时进行电解反应,碳酸钙先分解为CaO和CO2,电解质为熔融碳酸钠,阳极的电极反应式为2CO
 - 4e-= 2CO2↑ + O2↑,则阴极的电极反应式为
- 4e-= 2CO2↑ + O2↑,则阴极的电极反应式为
您最近半年使用:0次
解答题-原理综合题
|
适中
(0.65)
名校
【推荐3】化学电源的应用领域广泛和美好的发展前景,化学电源分为一次电池、二次电池和燃料电池。
(1)锂( )—空气电池的工作原理如图所示。
)—空气电池的工作原理如图所示。
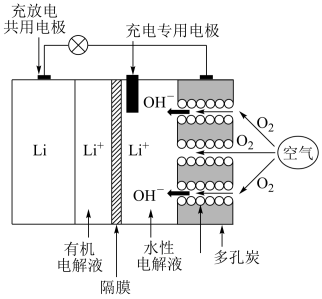
① 电极这侧不使用电解质水洗液的原因为
电极这侧不使用电解质水洗液的原因为___________ 。
②电池正极反应式为___________ 。
(2)镍镉电池是二次电池,其工作原理示意图如下( 为小灯泡,
为小灯泡, 、
、 为开关,
为开关, 、
、 为直流电源的两极)。
为直流电源的两极)。
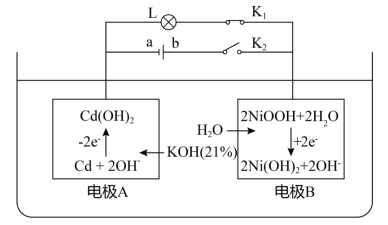
①断开 、合上
、合上 ,镍镉电池能量转化形式:
,镍镉电池能量转化形式:___________ ;
②断开 、合上
、合上 ,电极
,电极 反应式为:
反应式为:___________ ;
③电极 发生氧化反应过程中,溶液中
发生氧化反应过程中,溶液中 浓度
浓度___________ 。(填“增大”、“减小”“不变”)
(3) 燃料电池。研究
燃料电池。研究 燃料电池性能的装置如图所示,两电极区间用允许
燃料电池性能的装置如图所示,两电极区间用允许 、
、 通过的半透膜隔开。
通过的半透膜隔开。

①电池负极电极反应式为___________ ;放电过程中需补充的物质 为
为___________ (填化学式);
②根据物质流向,通过半透膜的离子是___________ 。
(1)锂(
 )—空气电池的工作原理如图所示。
)—空气电池的工作原理如图所示。
①
 电极这侧不使用电解质水洗液的原因为
电极这侧不使用电解质水洗液的原因为②电池正极反应式为
(2)镍镉电池是二次电池,其工作原理示意图如下(
 为小灯泡,
为小灯泡, 、
、 为开关,
为开关, 、
、 为直流电源的两极)。
为直流电源的两极)。
①断开
 、合上
、合上 ,镍镉电池能量转化形式:
,镍镉电池能量转化形式:②断开
 、合上
、合上 ,电极
,电极 反应式为:
反应式为:③电极
 发生氧化反应过程中,溶液中
发生氧化反应过程中,溶液中 浓度
浓度(3)
 燃料电池。研究
燃料电池。研究 燃料电池性能的装置如图所示,两电极区间用允许
燃料电池性能的装置如图所示,两电极区间用允许 、
、 通过的半透膜隔开。
通过的半透膜隔开。
①电池负极电极反应式为
 为
为②根据物质流向,通过半透膜的离子是
您最近半年使用:0次
解答题-工业流程题
|
适中
(0.65)
【推荐1】氯碱厂电解饱和食盐水制取NaOH的工艺流程如图所示:
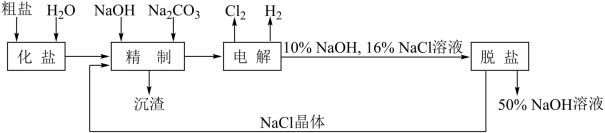
依据工艺流程,完成下列填空。
(1)在电解过程中,与电源正极相连的电极上所发生的电极反应方程式是___________ ;与电源负极相连的电极附近,溶液pH___________ (填“升高”、“下降”或“不变”)。
(2)工业食盐含Ca2+、Mg2+等杂质,精制过程发生反应的离子方程式分别是___________ ,___________ 。
(3)如果粗盐中 含量较高,必须添加钡试剂除去
含量较高,必须添加钡试剂除去 ,该钡试剂可以是
,该钡试剂可以是__________ 。
A.Ba(OH)2 B.Ba(NO3)2 C.BaCl2
(4)为有效除去Ca2+、Mg2+、 ,加入试剂的合理顺序是
,加入试剂的合理顺序是__________ 。
A.先加NaOH,后加Na2CO3,再加钡试剂
B.先加NaOH,后加钡试剂,再加Na2CO3
C.先加钡试剂,后加NaOH,再加Na2CO3
(5)用隔膜法电解食盐水,电解槽分隔为阳极区和阴极区,防止Cl2与NaOH反应。采用无隔膜电解冷的食盐水时,Cl2与NaOH充分接触,产物仅是NaClO和H2,相应的化学方程式是___________ 。

依据工艺流程,完成下列填空。
(1)在电解过程中,与电源正极相连的电极上所发生的电极反应方程式是
(2)工业食盐含Ca2+、Mg2+等杂质,精制过程发生反应的离子方程式分别是
(3)如果粗盐中
 含量较高,必须添加钡试剂除去
含量较高,必须添加钡试剂除去 ,该钡试剂可以是
,该钡试剂可以是A.Ba(OH)2 B.Ba(NO3)2 C.BaCl2
(4)为有效除去Ca2+、Mg2+、
 ,加入试剂的合理顺序是
,加入试剂的合理顺序是A.先加NaOH,后加Na2CO3,再加钡试剂
B.先加NaOH,后加钡试剂,再加Na2CO3
C.先加钡试剂,后加NaOH,再加Na2CO3
(5)用隔膜法电解食盐水,电解槽分隔为阳极区和阴极区,防止Cl2与NaOH反应。采用无隔膜电解冷的食盐水时,Cl2与NaOH充分接触,产物仅是NaClO和H2,相应的化学方程式是
您最近半年使用:0次
解答题-工业流程题
|
适中
(0.65)
【推荐2】氯碱工业是最基本的化学工业之一,离子膜电解法为目前普遍使用的生产方法,其生产流程如下图所示:
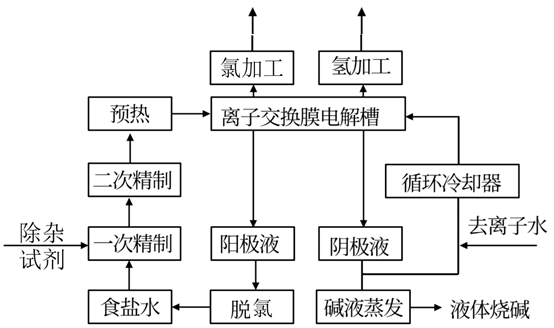
(1)该流程中可以循环的物质是__________________ 。
(2)电解法制碱的主要原料是饱和食盐水,由于粗盐水中含有Ca2+、Mg2+、 等无机杂质,所以在进入电解槽前需要进行两次精制,得到精制饱和食盐水。
等无机杂质,所以在进入电解槽前需要进行两次精制,得到精制饱和食盐水。
①第一次精制过程中所加除杂试剂顺序不合理的是_____________

②一次精制后的食盐水仍会有少量的Ca2+、Mg2+,需要送入阳离子交换塔进行二次精制,若不经过二次精制,直接进入离子膜电解槽,这样会产生什么后果_______ 。
(3)下图是工业上电解饱和食盐水的离子交换膜电解槽示意图(阳极用金属钛网制成,阴极由碳钢网制成),则A处产生的气体是_________ ,F电极的名称是___________ 。电解总反应的离子方程式为_________________________ 。
(4)从阳极槽出来的淡盐水中,往往含有少量的溶解氯,需要加入8%~9%的亚硫酸钠溶液将其彻底除去,该反应的化学方程式为_________________________ 。
已知在电解槽中,每小时通过1 A的直流电理论上可以产生1.492 g的烧碱,某工厂用300个电解槽串联生产8 h,制得32%的烧碱溶液(密度为1.342 t/m3)113 m3,电解槽的电流强度1.45 ×104 A,该电解槽的电解效率为_______________ (保留两位小数)。

(1)该流程中可以循环的物质是
(2)电解法制碱的主要原料是饱和食盐水,由于粗盐水中含有Ca2+、Mg2+、
 等无机杂质,所以在进入电解槽前需要进行两次精制,得到精制饱和食盐水。
等无机杂质,所以在进入电解槽前需要进行两次精制,得到精制饱和食盐水。①第一次精制过程中所加除杂试剂顺序不合理的是
| A.BaCl2、NaOH、Na2CO3、HCl |
| B.BaCl2、Na2CO3、NaOH、HCl |
| C.NaOH、BaCl2、Na2CO3、HCl |
| D.Na2CO3、BaCl2、NaOH、HCl |

②一次精制后的食盐水仍会有少量的Ca2+、Mg2+,需要送入阳离子交换塔进行二次精制,若不经过二次精制,直接进入离子膜电解槽,这样会产生什么后果
(3)下图是工业上电解饱和食盐水的离子交换膜电解槽示意图(阳极用金属钛网制成,阴极由碳钢网制成),则A处产生的气体是
(4)从阳极槽出来的淡盐水中,往往含有少量的溶解氯,需要加入8%~9%的亚硫酸钠溶液将其彻底除去,该反应的化学方程式为
已知在电解槽中,每小时通过1 A的直流电理论上可以产生1.492 g的烧碱,某工厂用300个电解槽串联生产8 h,制得32%的烧碱溶液(密度为1.342 t/m3)113 m3,电解槽的电流强度1.45 ×104 A,该电解槽的电解效率为
您最近半年使用:0次
解答题-原理综合题
|
适中
(0.65)
解题方法
【推荐3】氯化钠是重要的化工原料,有着广泛的应用。
(1)图a,b、c分别为氯化钠在不同状态下的导电实验的微观示意图模型(X、Y均表示石墨电极且与直流电源连接方式相同, 表示水分子)。
表示水分子)。
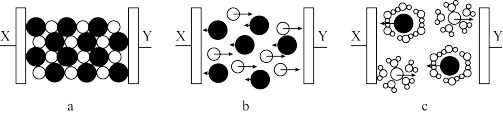
其中能观察到灯泡发亮的是_______ (填序号),原因是_______ (解释其中一个即可)。
(2)氯碱工业是化工产业的重要基础,其装置示意图如下。

①该原理的化学方程式为_______ 。
②生产过程中产生的氯酸盐副产物需要处理。已知当pH升高时, 易歧化为
易歧化为 和
和 ,下列关于
,下列关于 产生的说法中,不合理的是
产生的说法中,不合理的是_______ (填序号)。
a.阳离子交换膜破损导致 向阳极室迁移,可能产生
向阳极室迁移,可能产生
b. 在电极上放电,可能产生
在电极上放电,可能产生
c. 主要在阴极室产生
主要在阴极室产生
(1)图a,b、c分别为氯化钠在不同状态下的导电实验的微观示意图模型(X、Y均表示石墨电极且与直流电源连接方式相同,
 表示水分子)。
表示水分子)。
其中能观察到灯泡发亮的是
(2)氯碱工业是化工产业的重要基础,其装置示意图如下。

①该原理的化学方程式为
②生产过程中产生的氯酸盐副产物需要处理。已知当pH升高时,
 易歧化为
易歧化为 和
和 ,下列关于
,下列关于 产生的说法中,不合理的是
产生的说法中,不合理的是a.阳离子交换膜破损导致
 向阳极室迁移,可能产生
向阳极室迁移,可能产生
b.
 在电极上放电,可能产生
在电极上放电,可能产生
c.
 主要在阴极室产生
主要在阴极室产生
您最近半年使用:0次
【推荐1】硝酸锶可用于制造烟火及信号弹等。工业级硝酸锶[含Ca(NO3)2、Ba(NO3)2等杂质] 的提纯流程如下。(已知: 硝酸锶、硝酸钡不溶于浓硝酸)
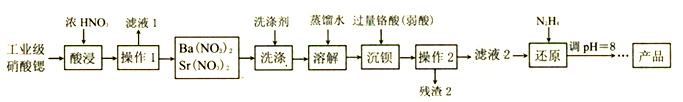
(1) 要加快“酸浸”速率所采取的措施是______ (写一条即可)。
(2)操作1的名称是_______ ,洗涤所用的洗涤剂是______ .
(3)“滤液2”中过量的H2CrO4被N2H4还原为Cr3+,同时放出无污染的气体,写出发生反应的离子方程式______ ;氧化产物与还原产物的物质的量之比为______ 。
(4)已知Cr(OH)3不溶于水,还原后调节pH=8 的目的是_______ 。
(5)为了测定“残渣2”中Cr元素的质量分数,进行以下实验。(已知: I2+2S2O32-=2I-+S4O62-)
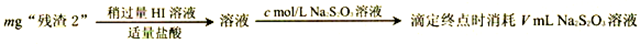
①“残渣2”中Cr元素的质量分数为______ (用代数式表示)。
②若加入的HI溶液过量太多,测定结果会是_____ (填“偏高”、“偏低”或“无影响”),其原因是__________________ 。

(1) 要加快“酸浸”速率所采取的措施是
(2)操作1的名称是
(3)“滤液2”中过量的H2CrO4被N2H4还原为Cr3+,同时放出无污染的气体,写出发生反应的离子方程式
(4)已知Cr(OH)3不溶于水,还原后调节pH=8 的目的是
(5)为了测定“残渣2”中Cr元素的质量分数,进行以下实验。(已知: I2+2S2O32-=2I-+S4O62-)
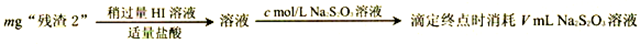
①“残渣2”中Cr元素的质量分数为
②若加入的HI溶液过量太多,测定结果会是
您最近半年使用:0次
解答题-实验探究题
|
适中
(0.65)
名校
【推荐2】海水是巨大的资源宝库。
Ⅰ.从海水中提取食盐和溴(海水中溴以溴化钠为主)的过程如下:

(1)步骤①工业上得到氯气的化学方程式为:_______________________________________________ 。
(2)步骤②的化学方程式为:________________________________________________ 。
(3)步骤③用SO2水溶液吸收Br2,可制得HBr和硫酸,离子方程式为:________________________ 。
Ⅱ.海洋植物如海带、海藻中含有丰富的碘元素,燃烧的灰烬中碘元素以I-的形式存在。实验室里从海藻中提取碘的流程如下:

(4)指出提取碘的过程中有关的实验操作名称:
①______________ ③______________ ④______________
(5)步骤③操作所需的玻璃仪器主要是______________________ 。
(6)提取碘的过程中,可供选择的有机试剂是______ (填字母)。
A.苯、酒精 B.汽油、醋酸 C.四氯化碳、苯
Ⅰ.从海水中提取食盐和溴(海水中溴以溴化钠为主)的过程如下:

(1)步骤①工业上得到氯气的化学方程式为:
(2)步骤②的化学方程式为:
(3)步骤③用SO2水溶液吸收Br2,可制得HBr和硫酸,离子方程式为:
Ⅱ.海洋植物如海带、海藻中含有丰富的碘元素,燃烧的灰烬中碘元素以I-的形式存在。实验室里从海藻中提取碘的流程如下:

(4)指出提取碘的过程中有关的实验操作名称:
①
(5)步骤③操作所需的玻璃仪器主要是
(6)提取碘的过程中,可供选择的有机试剂是
A.苯、酒精 B.汽油、醋酸 C.四氯化碳、苯
您最近半年使用:0次
解答题-工业流程题
|
适中
(0.65)
名校
解题方法
【推荐3】铁、镍及其化合物在工业上有广泛的应用。从某矿渣[成分为NiFe2O4(铁酸镍)、NiO、FeO、CaO、SiO2等]中回收NiSO4的工艺流程如图:
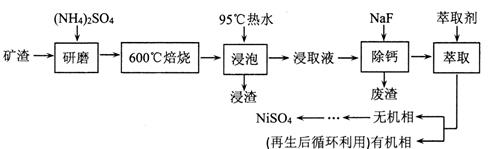
已知(NH4)2SO4在350℃分解生成NH3和H2SO4,回答下列问题:
(1)“浸渣”的成分有Fe2O3、FeO(OH)、CaSO4外,还含有_______ (写化学式)。
(2)矿渣中部分FeO在空气中焙烧时反应生成Fe2(SO4)3的化学方程式为_______ 。
(3)向“浸取液”中加入NaF以除去溶液中Ca2+(浓度为1.0×10-3mol·L-1),当溶液中c(F-)=2.0×10-3mol·L-1时,除钙率为_______ [Ksp(CaF2)=4.0×10-11]。
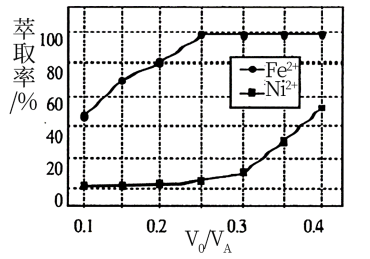
(4)溶剂萃取可用于对溶液中的金属离子进行富集与分离:Fe2+(水相) + 2RH(有机相) ⇌FeR2(有机相)+2H+(水相)萃取剂与溶液的体积比(V0/VA)对溶液中Ni2+、Fe2+的萃取率影响如图所示,V0/VA的最佳取值为_______ 。在_______ (填“强碱性”“强酸性”或“中性”)介质中“反萃取”能使有机相再生而循环利用。
(5)以Fe、Ni为电极制取Na2FeO4的原理如图所示。通电后,在铁电极附近生成紫红色的FeO ,同时会产生少量红褐色物质。
,同时会产生少量红褐色物质。
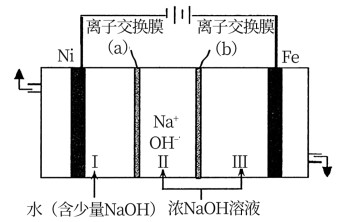
①电解时离子交换膜(b)为_______ (填“阴”或“阳”)离子交换膜。
②向铁电极区出现的红褐色物质中加入少量的NaClO溶液,沉淀溶解,进而提高了Na2FeO4的产率。该反应的离子方程式为_______ 。

已知(NH4)2SO4在350℃分解生成NH3和H2SO4,回答下列问题:
(1)“浸渣”的成分有Fe2O3、FeO(OH)、CaSO4外,还含有
(2)矿渣中部分FeO在空气中焙烧时反应生成Fe2(SO4)3的化学方程式为
(3)向“浸取液”中加入NaF以除去溶液中Ca2+(浓度为1.0×10-3mol·L-1),当溶液中c(F-)=2.0×10-3mol·L-1时,除钙率为
(4)溶剂萃取可用于对溶液中的金属离子进行富集与分离:Fe2+(水相) + 2RH(有机相) ⇌FeR2(有机相)+2H+(水相)萃取剂与溶液的体积比(V0/VA)对溶液中Ni2+、Fe2+的萃取率影响如图所示,V0/VA的最佳取值为

(5)以Fe、Ni为电极制取Na2FeO4的原理如图所示。通电后,在铁电极附近生成紫红色的FeO
 ,同时会产生少量红褐色物质。
,同时会产生少量红褐色物质。
①电解时离子交换膜(b)为
②向铁电极区出现的红褐色物质中加入少量的NaClO溶液,沉淀溶解,进而提高了Na2FeO4的产率。该反应的离子方程式为
您最近半年使用:0次



