I、化学反应中伴随着能量变化。下列属于吸热反应的是___________ (填序号)。
a.燃烧CO b.Ba(OH)2·8H2O晶体和NH4Cl晶体反应 c.铝和稀盐酸反应 d.NaOH溶液和稀盐酸反应 e.液态水变为水蒸气 f.水蒸气冷凝为液态水
II、用50mL0.50mol/L盐酸与50mL0.55mol/LNaOH溶液在如图所示的装置中进行中和反应。通过测定反应过程中所放出的热量可计算中和热。回答下列问题:
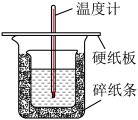
(1)从实验装置上看,图中尚缺少的一种玻璃仪器是_________________ 。
(2)烧杯间填满碎纸条的作用是_____________________________ 。
(3)大烧杯上如不盖硬纸板,求得的中和热数值_______ (填“偏大、偏小、无影响”)
(4)如果用60mL0.50mol/L盐酸与50mL0.55mol/LNaOH溶液进行反应,与上述实验相比,所放出的热量_______ (填“相等、不相等”),所求中和热_______ (填“相等、不相等”)
III、盖斯定律在生产和科学研究中有很重要的意义。有些反应的反应热虽然无法直接测得,但可通过间接的方法测定。现根据下列3个热化学反应方程式:
①Fe2O3(s)+3CO(g)=2Fe(s)+3CO2(g) ΔH=-25 kJ·mol-1
②3Fe2O3(s)+CO(g)=2Fe3O4(s)+CO2(g) ΔH=-47 kJ·mol-1
③Fe3O4(s)+CO(g)=3FeO(s)+CO2(g) ΔH=+19 kJ·mol-1
写出FeO(s)与CO反应生成Fe(s)和 的热化学方程式:
的热化学方程式:___________________________ 。
a.燃烧CO b.Ba(OH)2·8H2O晶体和NH4Cl晶体反应 c.铝和稀盐酸反应 d.NaOH溶液和稀盐酸反应 e.液态水变为水蒸气 f.水蒸气冷凝为液态水
II、用50mL0.50mol/L盐酸与50mL0.55mol/LNaOH溶液在如图所示的装置中进行中和反应。通过测定反应过程中所放出的热量可计算中和热。回答下列问题:

(1)从实验装置上看,图中尚缺少的一种玻璃仪器是
(2)烧杯间填满碎纸条的作用是
(3)大烧杯上如不盖硬纸板,求得的中和热数值
(4)如果用60mL0.50mol/L盐酸与50mL0.55mol/LNaOH溶液进行反应,与上述实验相比,所放出的热量
III、盖斯定律在生产和科学研究中有很重要的意义。有些反应的反应热虽然无法直接测得,但可通过间接的方法测定。现根据下列3个热化学反应方程式:
①Fe2O3(s)+3CO(g)=2Fe(s)+3CO2(g) ΔH=-25 kJ·mol-1
②3Fe2O3(s)+CO(g)=2Fe3O4(s)+CO2(g) ΔH=-47 kJ·mol-1
③Fe3O4(s)+CO(g)=3FeO(s)+CO2(g) ΔH=+19 kJ·mol-1
写出FeO(s)与CO反应生成Fe(s)和
 的热化学方程式:
的热化学方程式:
更新时间:2019-10-14 16:37:52
|
相似题推荐
填空题
|
适中
(0.65)
名校
【推荐1】400 ℃时,某密闭容器中有X、Y、Z三种气体,从反应开始到达到平衡时各物质浓度的变化如图甲所示(假定反应向正反应方向进行)。图乙为相应时刻仅改变反应体系中某一条件后正、逆反应速率随时间变化的情况。
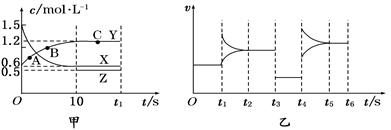
(1)反应从开始至平衡时v(X)=________________ ;A、B、C三点的逆反应速率由大到小的顺序为_______________________________________________ 。
(2)若t3 s时改变的条件是降低压强,则Z物质的起始浓度是________ ;400 ℃时该反应的平衡常数为________ 。
(3)t4 s时改变的条件是________ ,若该反应具有自发性,则此时平衡向________________ (填“正反应方向”或“逆反应方向”)移动。
(4)在图乙中绘制出t6 s时向容器中加入一定量X后建立新平衡的过程中(压强保持不变)正、逆反应速率的变化曲线并注明速率类型。____________________
(5)研究表明,该反应经过如下几个阶段:
3X(g) 2Q(s)+P(g) ΔH1 Q(s)===Y(g)+W(g) ΔH2 P(g)+2W(g)
2Q(s)+P(g) ΔH1 Q(s)===Y(g)+W(g) ΔH2 P(g)+2W(g) Z(g) ΔH3
Z(g) ΔH3
试写出X、Y、Z间反应的热化学方程式________________________________________ 。

(1)反应从开始至平衡时v(X)=
(2)若t3 s时改变的条件是降低压强,则Z物质的起始浓度是
(3)t4 s时改变的条件是
(4)在图乙中绘制出t6 s时向容器中加入一定量X后建立新平衡的过程中(压强保持不变)正、逆反应速率的变化曲线并注明速率类型。
(5)研究表明,该反应经过如下几个阶段:
3X(g)
 2Q(s)+P(g) ΔH1 Q(s)===Y(g)+W(g) ΔH2 P(g)+2W(g)
2Q(s)+P(g) ΔH1 Q(s)===Y(g)+W(g) ΔH2 P(g)+2W(g) Z(g) ΔH3
Z(g) ΔH3试写出X、Y、Z间反应的热化学方程式
您最近一年使用:0次
填空题
|
适中
(0.65)
解题方法
【推荐2】下图是氨氧燃料电池示意图,按照此图的提示,回答下列问题:
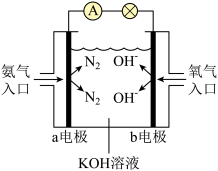
(1)a电极作_______ 极(填“正”、“负”或“阴”、“阳”),其电极反应式为_______ ;
(2)反应一段时间后,电解质溶液的PH将_______ (填“增大”、“减小”或“不变”);
(3)已知N2(g)+3H2(g)=2NH3(g) ΔH= -92.4 kJ·mol-1;2H2(g)+O2(g)=2H2O(g) ΔH= -483.6 kJ·mol-1,试写出氨气完全燃烧生成气态水的热化学方程式:_______ ;
(4)若用该燃料电池产生的电能在铁皮上镀锌(制白铁皮),某铁皮上现需要镀上97.5g锌,理论上至少需要消耗氨气_______ L(标准状况)。

(1)a电极作
(2)反应一段时间后,电解质溶液的PH将
(3)已知N2(g)+3H2(g)=2NH3(g) ΔH= -92.4 kJ·mol-1;2H2(g)+O2(g)=2H2O(g) ΔH= -483.6 kJ·mol-1,试写出氨气完全燃烧生成气态水的热化学方程式:
(4)若用该燃料电池产生的电能在铁皮上镀锌(制白铁皮),某铁皮上现需要镀上97.5g锌,理论上至少需要消耗氨气
您最近一年使用:0次
填空题
|
适中
(0.65)
名校
解题方法
【推荐3】(1)13 g C2H2(g)完全燃烧生成CO2和H2O(l)时,放出659 kJ的热量,写出表示该物质燃烧热的热化学方程式___________________________ 。
(2)已知反应:Cl2+2HBr===Br2+2HCl。
Ⅰ.当有0.2 mol HCl生成时放出8.1 kJ的热量。
Ⅱ.其能量变化示意图如图:

则该反应的热化学方程式为_____________________________________ 。由上述数据判断断开1 mol H—Cl 键与断开 1 mol H—Br键所需能量相差约为________ kJ。
(3)已知:①2CO(g)+O2(g) ===2CO2(g) ΔH=-566 kJ·mol-1
②Na2O2(s)+CO2(g) ===Na2CO3(s)+1/2O2(g) ΔH=-226 kJ·mol-1
则CO(g)与Na2O2(s)反应放出509 kJ热量时,电子转移数目为________ 。
(4)已知CO 、H2 、CH4 的燃烧热分别为283 kJ·mol-1、286 kJ·mol-1、890 kJ·mol-1。若将a mol CH4、CO和H2的混合气体完全燃烧,生成CO2气体和液态水,且CO2和水的物质的量相等时,则放出热量(Q)的取值范围是____ 。
(2)已知反应:Cl2+2HBr===Br2+2HCl。
Ⅰ.当有0.2 mol HCl生成时放出8.1 kJ的热量。
Ⅱ.其能量变化示意图如图:

则该反应的热化学方程式为
(3)已知:①2CO(g)+O2(g) ===2CO2(g) ΔH=-566 kJ·mol-1
②Na2O2(s)+CO2(g) ===Na2CO3(s)+1/2O2(g) ΔH=-226 kJ·mol-1
则CO(g)与Na2O2(s)反应放出509 kJ热量时,电子转移数目为
(4)已知CO 、H2 、CH4 的燃烧热分别为283 kJ·mol-1、286 kJ·mol-1、890 kJ·mol-1。若将a mol CH4、CO和H2的混合气体完全燃烧,生成CO2气体和液态水,且CO2和水的物质的量相等时,则放出热量(Q)的取值范围是
您最近一年使用:0次
填空题
|
适中
(0.65)
名校
【推荐1】按要求回答下列问题:
(1)已知H2和O2反应时放热,且断裂1molH-H键、1molO=O键、1molO-H键需要吸收的能量分别为Q1kJ、Q2kJ、Q3kJ。下列关系一定正确的是_________。
(2)下列变化中满足如图图示的是_________ (填选项字母)。
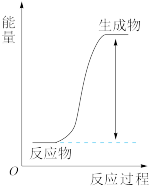
A镁和稀盐酸的反应 B.Ba(OH)2•8H2O与NH4Cl的反应 C.氯化铵固体加入水中 D.氢气燃烧 E.H-O-H→2H+O
(3)将铝片和铜片用导线相连,一组插入浓硝酸中,一组插入烧碱溶液中,分别形成了原电池,在这两个原电池中,负极分别为_________ (填选项字母)。
A铝片、铜片 B.铜片、铝片 C.铝片、铝片
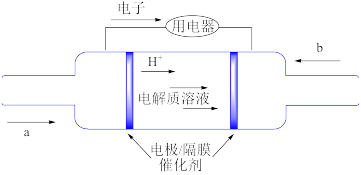
(4)2020年上海进博会展览中,诸多氢能源汽车纷纷亮相。氢燃料电池被誉为氢能源汽车的心脏。某种氢燃料电池的内部结构如图所示,a 处通入气体的是_________ ,左侧的电极为电池的_________ (填“正极”或“负极”), 右侧电极发生的反应为:_________ 。
(1)已知H2和O2反应时放热,且断裂1molH-H键、1molO=O键、1molO-H键需要吸收的能量分别为Q1kJ、Q2kJ、Q3kJ。下列关系一定正确的是_________。
| A.Q1+Q2>Q3 | B.2Q1+Q2>2Q3 | C.2Q1+Q2<4Q3 | D.2Q1+Q2>4Q3 |

A镁和稀盐酸的反应 B.Ba(OH)2•8H2O与NH4Cl的反应 C.氯化铵固体加入水中 D.氢气燃烧 E.H-O-H→2H+O
(3)将铝片和铜片用导线相连,一组插入浓硝酸中,一组插入烧碱溶液中,分别形成了原电池,在这两个原电池中,负极分别为
A铝片、铜片 B.铜片、铝片 C.铝片、铝片
(4)2020年上海进博会展览中,诸多氢能源汽车纷纷亮相。氢燃料电池被誉为氢能源汽车的心脏。某种氢燃料电池的内部结构如图所示,a 处通入气体的是

您最近一年使用:0次
填空题
|
适中
(0.65)
名校
解题方法
【推荐2】断开1 mol AB(g)分子中的化学键使其分别生成气态A原子和气态B原子所吸收的能量称为A—B的键能。下表列出了一些化学键的键能(E):
请回答下列问题:
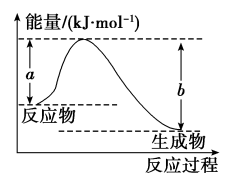
(1)如图表示某反应的能量变化关系,则此反应为_______ (填“吸热”或“放热”)反应,其中ΔH=_______ (用含有a、b的关系式表示)。
(2)若图示中表示反应H2(g)+ O2(g)=H2O(g) ΔH=-241.8 kJ·mol-1,则根据所给键能数据可得,b=
O2(g)=H2O(g) ΔH=-241.8 kJ·mol-1,则根据所给键能数据可得,b=_______ kJ·mol-1,x=_______ 。
(3)历史上曾用“地康法”制氯气,这一方法是用CuCl2作催化剂,在450 ℃时利用空气中的氧气与氯化氢反应制氯气。反应的化学方程式为_______ 。若忽略温度和压强对反应热的影响,根据题给有关数据及前面的计算结果,计算当反应中有1 mol电子转移时,反应的能量变化为_______ 。
| 化学键 | H—H | Cl—Cl | O=O | C—Cl | C—H | O—H | H—Cl |
| E/(kJ·mol-1) | 436 | 247 | x | 330 | 413 | 463 | 431 |
(1)如图表示某反应的能量变化关系,则此反应为

(2)若图示中表示反应H2(g)+
 O2(g)=H2O(g) ΔH=-241.8 kJ·mol-1,则根据所给键能数据可得,b=
O2(g)=H2O(g) ΔH=-241.8 kJ·mol-1,则根据所给键能数据可得,b=(3)历史上曾用“地康法”制氯气,这一方法是用CuCl2作催化剂,在450 ℃时利用空气中的氧气与氯化氢反应制氯气。反应的化学方程式为
您最近一年使用:0次
填空题
|
适中
(0.65)
解题方法
【推荐3】根据要求回答下列问题:
(1)下列过程不一定释放能量的是________ 。
A. 化合反应 B. 分解反应 C. 形成化学键 D. 燃料燃烧 E. 酸碱中和 F. 炸药爆炸
(2)等质量的下列物质分别完全燃烧生成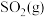 ,放出热量较多的是
,放出热量较多的是________ 。
A. 硫蒸气 B. 硫固体
(3)已知:通常条件下,强酸强碱稀溶液中和生成 水放出的热量为中和热。稀溶液中
水放出的热量为中和热。稀溶液中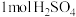 和
和 恰好完全反应时放出
恰好完全反应时放出 热量,则其中和热为
热量,则其中和热为________  。
。
(4)已知 和
和 反应生成
反应生成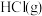 是放热反应,且断开
是放热反应,且断开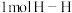 键、
键、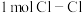 键、
键、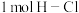 键需吸收的能量分别为
键需吸收的能量分别为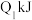 、
、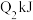 、
、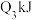 。由此可以推知下列关系正确的是
。由此可以推知下列关系正确的是________ (填序号)。
A.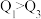 B.
B. 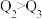 C.
C. 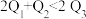
D.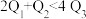 E.
E. 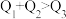 F.
F. 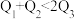
(1)下列过程不一定释放能量的是
A. 化合反应 B. 分解反应 C. 形成化学键 D. 燃料燃烧 E. 酸碱中和 F. 炸药爆炸
(2)等质量的下列物质分别完全燃烧生成
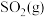 ,放出热量较多的是
,放出热量较多的是A. 硫蒸气 B. 硫固体
(3)已知:通常条件下,强酸强碱稀溶液中和生成
 水放出的热量为中和热。稀溶液中
水放出的热量为中和热。稀溶液中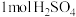 和
和 恰好完全反应时放出
恰好完全反应时放出 热量,则其中和热为
热量,则其中和热为 。
。(4)已知
 和
和 反应生成
反应生成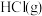 是放热反应,且断开
是放热反应,且断开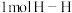 键、
键、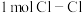 键、
键、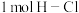 键需吸收的能量分别为
键需吸收的能量分别为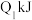 、
、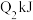 、
、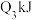 。由此可以推知下列关系正确的是
。由此可以推知下列关系正确的是A.
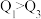 B.
B. 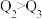 C.
C. 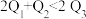
D.
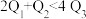 E.
E. 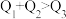 F.
F. 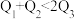
您最近一年使用:0次
填空题
|
适中
(0.65)
名校
【推荐1】某化学兴趣小组在实验室测定中和反应反应热的实验步骤如下:
①用量筒量取50mL 0.50 mol·L-1盐酸倒入小烧杯中,测出盐酸温度;
②用另量筒量取50 mL0.55 mol·L-1 NaOH溶液,并用同一温度计测出其温度;
③将NaOH溶液倒入实验装置中的小烧杯中,设法使之混合均匀,测得混合液的最高温度。
回答下列问题:
(1)为什么所用NaOH溶液要稍过量?___________ 。
(2)倒入NaOH溶液的正确操作是___________ (填字母),用于搅拌的仪器的名称___________ 。
A.沿玻璃棒缓慢倒入 B.分三次倒入 C.一次迅速倒入
(3)现将一定量的稀氢氧化钠溶液、稀氢氧化钙溶液、稀氨水分别和1L 1mol·L-1的稀盐酸恰好完全反应,其反应热分别为ΔH1、ΔH2、ΔH3,则ΔH1、ΔH2、ΔH3的大小关系为___________ 。
(4)实验过程中某同学使用铜丝搅拌反应液,则测得的中和热ΔH___________ (填“偏大”或“偏小”)。
(5)___________ (填“能”或“不能" )用Ba(OH)2溶液和硫酸代替氢氧化钠溶液和盐酸,理由是___________ 。
①用量筒量取50mL 0.50 mol·L-1盐酸倒入小烧杯中,测出盐酸温度;
②用另量筒量取50 mL0.55 mol·L-1 NaOH溶液,并用同一温度计测出其温度;
③将NaOH溶液倒入实验装置中的小烧杯中,设法使之混合均匀,测得混合液的最高温度。
回答下列问题:
(1)为什么所用NaOH溶液要稍过量?
(2)倒入NaOH溶液的正确操作是
A.沿玻璃棒缓慢倒入 B.分三次倒入 C.一次迅速倒入
(3)现将一定量的稀氢氧化钠溶液、稀氢氧化钙溶液、稀氨水分别和1L 1mol·L-1的稀盐酸恰好完全反应,其反应热分别为ΔH1、ΔH2、ΔH3,则ΔH1、ΔH2、ΔH3的大小关系为
(4)实验过程中某同学使用铜丝搅拌反应液,则测得的中和热ΔH
(5)
您最近一年使用:0次
填空题
|
适中
(0.65)
名校
【推荐2】Ⅰ. 盐酸跟
盐酸跟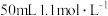 氢氧化钠溶液在下图所示装置中进行中和反应,并通过测定反应过程中所放出的热量来计算中和热。试回答下列问题:
氢氧化钠溶液在下图所示装置中进行中和反应,并通过测定反应过程中所放出的热量来计算中和热。试回答下列问题:

(1)___________ (填“能”或“不能”)将环形玻璃搅拌棒改为环形金属(如铜)棒。
(2)回答下列问题:
若将盐酸改为相同体积、相同浓度的醋酸,测得中和热为ΔH1,NaOH溶液与盐酸反应中和热为ΔH,则ΔH1___________ ΔH (填写<、>、=);若测得该反应放出的热量为2.84kJ,请写出盐酸与NaOH溶液反应的中和热的热化学方程式:___________
Ⅱ.已知1g的甲烷完全燃烧生成液态水放出akJ的热量。
(3)写出表示甲烷燃烧热的热化学方程式为___________ 。
(4)发射卫星可用肼做燃料,四氧化二氮做氧化剂,两者反应生成氮气和水蒸气。已知:
①2O2(g)+N2(g)=N2O4(l) ΔH1
②N2(g)+2H2(g)=N2H4(l) ΔH2
③O2(g)+2H2(g)=2H2O(g) ΔH3
④2N2H4(l)+N2O4(l)=3N2(g)+4H2O(g) ΔH4
上述反应热效应之间的关系式为ΔH4=___________ 。
(5)有科学家预言,氢能将成为21世纪的主要能源,而且是一种理想的绿色能源。若1mol氢气完全燃烧生成1mol气态水放出241kJ的热量,已知H-O键能为463kJ·mol-1,O=O键能为498kJ·mol-1,计算H-H键能为___________ kJ·mol-1。
 盐酸跟
盐酸跟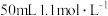 氢氧化钠溶液在下图所示装置中进行中和反应,并通过测定反应过程中所放出的热量来计算中和热。试回答下列问题:
氢氧化钠溶液在下图所示装置中进行中和反应,并通过测定反应过程中所放出的热量来计算中和热。试回答下列问题:
(1)
(2)回答下列问题:
若将盐酸改为相同体积、相同浓度的醋酸,测得中和热为ΔH1,NaOH溶液与盐酸反应中和热为ΔH,则ΔH1
Ⅱ.已知1g的甲烷完全燃烧生成液态水放出akJ的热量。
(3)写出表示甲烷燃烧热的热化学方程式为
(4)发射卫星可用肼做燃料,四氧化二氮做氧化剂,两者反应生成氮气和水蒸气。已知:
①2O2(g)+N2(g)=N2O4(l) ΔH1
②N2(g)+2H2(g)=N2H4(l) ΔH2
③O2(g)+2H2(g)=2H2O(g) ΔH3
④2N2H4(l)+N2O4(l)=3N2(g)+4H2O(g) ΔH4
上述反应热效应之间的关系式为ΔH4=
(5)有科学家预言,氢能将成为21世纪的主要能源,而且是一种理想的绿色能源。若1mol氢气完全燃烧生成1mol气态水放出241kJ的热量,已知H-O键能为463kJ·mol-1,O=O键能为498kJ·mol-1,计算H-H键能为
您最近一年使用:0次
填空题
|
适中
(0.65)
名校
【推荐3】Ⅰ.实验室测定中和热的步骤如下(如图)

第一步:量取40.0mL 0.25mol/L H2SO4溶液倒入小烧杯中,测量温度;
第二步:量取40.0mL 0.55mol/L NaOH溶液,测量温度;
第三步:将NaOH溶液倒入小烧杯中,混合均匀后测量混合液温度。
请回答:
(1)图中仪器A的名称是_______ 。
(2)NaOH溶液稍过量的原因_______ 。
(3)加入NaOH溶液的正确操作是_______(填字母)。
(4)若实验中若改用60 mL 0.50 mol/L的盐酸与50 mL 0.55 mol/L的氢氧化钠溶液进行反应, 与上述实验相比,所放出的热量_______ (填“相等”“不相等”),若实验操作均正确,则所求中和热_______ (填“相等”“不相等”)。
Ⅱ.
(5)已知拆开1 mol H-H、1 mol N-H、1 mol N≡N分别需要的能量是436 kJ、391 kJ、946 kJ,则N2与H2反应生成NH3的热化学方程式为_______ 。
(6)用NA表示阿伏加德罗常数的值,在C2H2(气态)完全燃烧生成CO2和液态水的反应中,每有5NA个电子转移时,放出650 kJ的热量。则C2H2燃烧热的热化学方程式为_______ 。
(7)已知两个氢气燃烧生成水的热化学方程式:
H2(g)+ O2(g)=H2O(g) ΔH=a kJ·mol-1
O2(g)=H2O(g) ΔH=a kJ·mol-1
2H2(g)+O2(g)=2H2O(l) ΔH=b kJ·mol-1
请回答下列问题(|b|表示b的绝对值):
①若2 mol H2(g)完全燃烧生成水蒸气,则放出的热量_______ (填“>”“<”或“=”)|b| kJ。
②反应热的关系:2a_______ (填“>”“<”或“=”)b。
③若已知H2(g)+ O2(g)=H2O(g) ΔH=-242 kJ·mol-1,且氧气中1 mol O=O完全断裂时吸收热量496 kJ,水蒸气中1 mol H-O形成时放出热量463 kJ,则氢气中1 mol H-H断裂时吸收的热量为
O2(g)=H2O(g) ΔH=-242 kJ·mol-1,且氧气中1 mol O=O完全断裂时吸收热量496 kJ,水蒸气中1 mol H-O形成时放出热量463 kJ,则氢气中1 mol H-H断裂时吸收的热量为_______ 。
(8)肼(N2H4)是一种用于火箭或燃料电池的原料,已知:
①2H2O(g)+O2(g)=2H2O2(l) ΔH1= +108.0 kJ·mol-1
②N2H4(l)+O2(g)=N2(g)+2H2O(g) ΔH2= -534.0 kJ·mol-1
则③N2H4(l)+2H2O2(l)=N2(g)+4H2O(g) ΔH3=_______ kJ·mol-1。

第一步:量取40.0mL 0.25mol/L H2SO4溶液倒入小烧杯中,测量温度;
第二步:量取40.0mL 0.55mol/L NaOH溶液,测量温度;
第三步:将NaOH溶液倒入小烧杯中,混合均匀后测量混合液温度。
请回答:
(1)图中仪器A的名称是
(2)NaOH溶液稍过量的原因
(3)加入NaOH溶液的正确操作是_______(填字母)。
| A.沿玻璃棒缓慢加入 | B.分三次均匀加入 | C.一次迅速加入 | D.用滴定管小心滴加 |
Ⅱ.
(5)已知拆开1 mol H-H、1 mol N-H、1 mol N≡N分别需要的能量是436 kJ、391 kJ、946 kJ,则N2与H2反应生成NH3的热化学方程式为
(6)用NA表示阿伏加德罗常数的值,在C2H2(气态)完全燃烧生成CO2和液态水的反应中,每有5NA个电子转移时,放出650 kJ的热量。则C2H2燃烧热的热化学方程式为
(7)已知两个氢气燃烧生成水的热化学方程式:
H2(g)+
 O2(g)=H2O(g) ΔH=a kJ·mol-1
O2(g)=H2O(g) ΔH=a kJ·mol-12H2(g)+O2(g)=2H2O(l) ΔH=b kJ·mol-1
请回答下列问题(|b|表示b的绝对值):
①若2 mol H2(g)完全燃烧生成水蒸气,则放出的热量
②反应热的关系:2a
③若已知H2(g)+
 O2(g)=H2O(g) ΔH=-242 kJ·mol-1,且氧气中1 mol O=O完全断裂时吸收热量496 kJ,水蒸气中1 mol H-O形成时放出热量463 kJ,则氢气中1 mol H-H断裂时吸收的热量为
O2(g)=H2O(g) ΔH=-242 kJ·mol-1,且氧气中1 mol O=O完全断裂时吸收热量496 kJ,水蒸气中1 mol H-O形成时放出热量463 kJ,则氢气中1 mol H-H断裂时吸收的热量为(8)肼(N2H4)是一种用于火箭或燃料电池的原料,已知:
①2H2O(g)+O2(g)=2H2O2(l) ΔH1= +108.0 kJ·mol-1
②N2H4(l)+O2(g)=N2(g)+2H2O(g) ΔH2= -534.0 kJ·mol-1
则③N2H4(l)+2H2O2(l)=N2(g)+4H2O(g) ΔH3=
您最近一年使用:0次



