碳酸钠俗称纯碱,其用途很广。实验室中,用碳酸氢铵和饱和食盐水可制得纯碱。
(1)饱和食盐水所用的原料粗盐主要来自于海洋,从海水中得到粗盐我们通常用的方法是_______ 。
(2)所得的粗盐(含Ca2+、Mg2+、SO42-)需要提纯,需要加入足量NaOH、BaCl2、Na2CO3溶液将杂质离子除去,随后过滤并加入盐酸调pH至7。其中先用BaCl2,再用Na2CO3的原因是______ 。
(3)饱和食盐水除用于制纯碱,也是氯碱工业的原料。氯碱工业中电解饱和食盐水的方程式为_______ 。
(4)测试纯碱产品中NaHCO3含量的方法是:用_______ (定量仪器)称取纯碱样品1.144g,用蒸馏水溶解,加入0.500mol/L的HCl溶液100mL,再加1-2滴酚酞,继续用0.500mol/L标准氢氧化钠溶液滴定。当滴定至溶液由_____ 色变_____ 色,半分钟不变色为滴定终点。
(5)若上述过程中共消耗氢氧化钠58.00mL,纯碱样品中NaHCO3质量分数为_____ 。(保留3位小数)
(6)如果装氢氧化钠的滴定管滴定结束读数时有漏液情况,会导致测定结果______ (选填“偏大”、“偏 小”、“不受影响”)。
(1)饱和食盐水所用的原料粗盐主要来自于海洋,从海水中得到粗盐我们通常用的方法是
(2)所得的粗盐(含Ca2+、Mg2+、SO42-)需要提纯,需要加入足量NaOH、BaCl2、Na2CO3溶液将杂质离子除去,随后过滤并加入盐酸调pH至7。其中先用BaCl2,再用Na2CO3的原因是
(3)饱和食盐水除用于制纯碱,也是氯碱工业的原料。氯碱工业中电解饱和食盐水的方程式为
(4)测试纯碱产品中NaHCO3含量的方法是:用
(5)若上述过程中共消耗氢氧化钠58.00mL,纯碱样品中NaHCO3质量分数为
(6)如果装氢氧化钠的滴定管滴定结束读数时有漏液情况,会导致测定结果
更新时间:2019-10-24 17:03:21
|
相似题推荐
填空题
|
适中
(0.65)
解题方法
【推荐1】有一磷酸酸式盐组成可视为Ca3(PO4)2·nH3PO4.·mH2O,准确称取0.2309g该盐样品,用0.04000mol·L-1的EDTA(Na2H2Y)标准溶液滴定其中的Ca2+(离子方程式为Ca2++Y4-=CaY2-),消耗EDTA标准溶液22.90mL;取该盐样品4.5372g加热至100°C以上全部失去结晶水,残余物质量为4.2129g。
(1)求该晶体组成中n、m的值;n=___________ 、m=___________ 。
(2)该酸式盐的最简化学式为___________ 。
(3)如果继续加热上述4.5372g样品至600℃,样品变为___________ ,其质量为___________ 。
(1)求该晶体组成中n、m的值;n=
(2)该酸式盐的最简化学式为
(3)如果继续加热上述4.5372g样品至600℃,样品变为
您最近一年使用:0次
填空题
|
适中
(0.65)
【推荐2】NaClO2广泛用于造纸工业、污水处理等。工业上生产NaClO2的工艺流程如下:
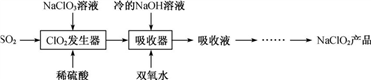
(1) ClO2发生器中发生反应的离子方程式为_________________ 。
(2) 吸收器中反应温度不能高于5 ℃的可能原因有____________ 。
(3) 查阅资料可知:
Ⅰ.ClO2能被I-还原为ClO2-或Cl-:
2ClO2+2I- 2ClO2-+I2
2ClO2-+I2
2ClO2+8H++10I- 2Cl-+5I2+4H2O
2Cl-+5I2+4H2O
ClO2的转化率与溶液pH的关系如图所示。

Ⅱ.pH≤2.0时,ClO2-能被I-完全还原为Cl-:ClO2-+4H++4I- Cl-+2I2+2H2O
Cl-+2I2+2H2O
取少量吸收液加水稀释至一定体积后得溶液Y,可通过下列步骤测定溶液Y中ClO2、ClO2-的浓度:
步骤1:准确量取25.00 mL溶液Y,调节溶液的pH为8.0,加入足量的KI晶体。滴入2滴淀粉溶液,滴加0.020 00 mol·L-1 Na2S2O3溶液,发生反应:2Na2S2O3+I2 Na2S4O6+2NaI。恰好完全反应时,消耗0.020 00 mol·L-1Na2S2O3溶液12.50 mL。
Na2S4O6+2NaI。恰好完全反应时,消耗0.020 00 mol·L-1Na2S2O3溶液12.50 mL。
步骤2:调节上述反应后溶液的pH为1.0,滴加0.250 0 mol·L-1 Na2S2O3溶液。恰好完全反应时,消耗0.250 0 mol·L-1 Na2S2O3溶液40.00 mL。
①判断Na2S2O3溶液与I2恰好完全反应时的实验现象是____________ 。
②请计算溶液Y中ClO2- 的物质的量浓度_____________ (写出计算过程)。

(1) ClO2发生器中发生反应的离子方程式为
(2) 吸收器中反应温度不能高于5 ℃的可能原因有
(3) 查阅资料可知:
Ⅰ.ClO2能被I-还原为ClO2-或Cl-:
2ClO2+2I-
 2ClO2-+I2
2ClO2-+I22ClO2+8H++10I-
 2Cl-+5I2+4H2O
2Cl-+5I2+4H2OClO2的转化率与溶液pH的关系如图所示。

Ⅱ.pH≤2.0时,ClO2-能被I-完全还原为Cl-:ClO2-+4H++4I-
 Cl-+2I2+2H2O
Cl-+2I2+2H2O取少量吸收液加水稀释至一定体积后得溶液Y,可通过下列步骤测定溶液Y中ClO2、ClO2-的浓度:
步骤1:准确量取25.00 mL溶液Y,调节溶液的pH为8.0,加入足量的KI晶体。滴入2滴淀粉溶液,滴加0.020 00 mol·L-1 Na2S2O3溶液,发生反应:2Na2S2O3+I2
 Na2S4O6+2NaI。恰好完全反应时,消耗0.020 00 mol·L-1Na2S2O3溶液12.50 mL。
Na2S4O6+2NaI。恰好完全反应时,消耗0.020 00 mol·L-1Na2S2O3溶液12.50 mL。步骤2:调节上述反应后溶液的pH为1.0,滴加0.250 0 mol·L-1 Na2S2O3溶液。恰好完全反应时,消耗0.250 0 mol·L-1 Na2S2O3溶液40.00 mL。
①判断Na2S2O3溶液与I2恰好完全反应时的实验现象是
②请计算溶液Y中ClO2- 的物质的量浓度
您最近一年使用:0次
填空题
|
适中
(0.65)
名校
【推荐3】白钠镁矾(mNa2SO4·nMgSO4·xH2O)俗称硝板,工业上用白钠镁矾制备碱式碳酸镁[4MgCO3·Mg(OH)2·4H2O]晶须的过程如下:向碳酸钠溶液中加入白钠镁矾,保持50℃加热0.5h,有大量的5MgCO3·3H2O生成,然后升高温度到85℃加热2h发生热解反应,过滤得碱式碳酸镁晶体。
(1)热解反应的方程式为________________ 。
(2)碱式碳酸镁可用作化学冷却剂,原因是________________ 。
(3)为测定白钠镁矾的组成,进行下列实验:
①取白钠镁矾3.340 g溶于水配成100.00 mL溶液A;
②取25.00 mL溶液A,加入足量的氯化钡溶液,得BaSO4 1.165 g;
③另取25.00 mL溶液A,调节pH=10,用浓度为0.1000 mol·L-1的EDTA标准溶液滴定Mg2+(离子方程式为Mg2+ + H2Y2-=MgY2-+ 2H+),滴定至终点,消耗标准溶液25.00 mL。通过计算确定白钠镁矾的化学式(写出计算过程)。___________________
(1)热解反应的方程式为
(2)碱式碳酸镁可用作化学冷却剂,原因是
(3)为测定白钠镁矾的组成,进行下列实验:
①取白钠镁矾3.340 g溶于水配成100.00 mL溶液A;
②取25.00 mL溶液A,加入足量的氯化钡溶液,得BaSO4 1.165 g;
③另取25.00 mL溶液A,调节pH=10,用浓度为0.1000 mol·L-1的EDTA标准溶液滴定Mg2+(离子方程式为Mg2+ + H2Y2-=MgY2-+ 2H+),滴定至终点,消耗标准溶液25.00 mL。通过计算确定白钠镁矾的化学式(写出计算过程)。
您最近一年使用:0次
填空题
|
适中
(0.65)
解题方法
【推荐1】按要求回答下列问题。
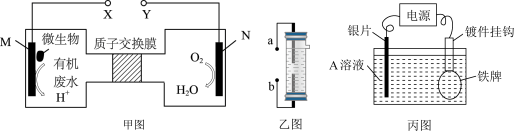
(1)甲图是一种利用微生物将有机废水中的有机物质转化为环境友好物质的原电池装置,若有机废水中主要含有甲醛(HCHO),则装置甲中M极发生的电极反应为___ 。当有300mg的甲醛参与反应时,通过质子交换膜的H+为___ mol。
(2)乙图是一种用惰性电极电解饱和食盐水的消毒液发生器。装置乙中的b极要与装置甲的____ 极(填“X”或“Y”)连接,该电极的电极反应式为___ 。
(3)丙图是一种可以在铁牌表面电镀一层银的电镀装置,装置丙中的A溶液为___ ,电镀一段时间后A溶液浓度___ (填“变大”、“变小”或“不变”)。

(1)甲图是一种利用微生物将有机废水中的有机物质转化为环境友好物质的原电池装置,若有机废水中主要含有甲醛(HCHO),则装置甲中M极发生的电极反应为
(2)乙图是一种用惰性电极电解饱和食盐水的消毒液发生器。装置乙中的b极要与装置甲的
(3)丙图是一种可以在铁牌表面电镀一层银的电镀装置,装置丙中的A溶液为
您最近一年使用:0次
填空题
|
适中
(0.65)
解题方法
【推荐2】氯气是一种重要的化学物质,在生产和生活中有多种用途:
(1)从海水中获得食盐的方法称为___________ 。NaCl的电子式是________ 。
(2)实验室电解饱和食盐水的装置如下图所示。下列判断正确的是_________ (选填编号)。

A.电极a为阴极
B.电极b上发生了还原反应
C.阳极附近溶液变红
D.阴极产生黄绿色气体
(3)工业上用电解饱和食盐水的方法制取氯气。写出该反应的化学方程式:________________________________________________________ ,若得到氯气1.12L(标准状况下)时,转移的电子数为______ mol。
(4)电解时应避免两极产物相互接触,否则可能发生副反应。写出产物中一种单质与一种化合物反应的化学方程式:_______________________________ 。
(5)氯气有毒,但是也可以用来消毒的原因是_________________________ 。
(6)某同学用氯气做了如下实验:
①向盛有KI溶液的试管中滴加少量氯水后再加入少许CCl4,振荡,静置后可观察到______________________________ 。
②如果继续 向试管中滴加氯水,振荡,CCl4层中颜色会逐渐变浅,最后变成无色。则下列说法正确 的是___________
a、CCl4层中溶质被氧化 b、CCl4被氧化
c、CCl4层中溶质被还原 d、CCl4被还原
(7)氢气是一种清洁能源,有人提议通过电解饱和食盐水大规模生产氢气。你是否同意该观点?请用文字作简要解释。______________________________________________
(1)从海水中获得食盐的方法称为
(2)实验室电解饱和食盐水的装置如下图所示。下列判断正确的是

A.电极a为阴极
B.电极b上发生了还原反应
C.阳极附近溶液变红
D.阴极产生黄绿色气体
(3)工业上用电解饱和食盐水的方法制取氯气。写出该反应的化学方程式:
(4)电解时应避免两极产物相互接触,否则可能发生副反应。写出产物中一种单质与一种化合物反应的化学方程式:
(5)氯气有毒,但是也可以用来消毒的原因是
(6)某同学用氯气做了如下实验:
①向盛有KI溶液的试管中滴加少量氯水后再加入少许CCl4,振荡,静置后可观察到
②如果
a、CCl4层中溶质被氧化 b、CCl4被氧化
c、CCl4层中溶质被还原 d、CCl4被还原
(7)氢气是一种清洁能源,有人提议通过电解饱和食盐水大规模生产氢气。你是否同意该观点?请用文字作简要解释。
您最近一年使用:0次
填空题
|
适中
(0.65)
解题方法
【推荐3】2010 年 1 月 4 日,所罗门群岛连续发生里氏 6.5 级和里氏 7.2 级地震以及多次余震,引发海啸,部分海域浪高 2.5 米,造成大约 1000 人无家可归.
(1)有人计算后表明,造成海啸的海底地震的能量相当于 3000 颗广岛原子弹爆炸的能量. 235U 是制 造原子弹的材料之一,它的质子数与中子数之差是____________ ,它与 238U 互称____________ 。
(2)随着灾民生活的渐渐稳定,工业生产也将逐渐恢复,现有一氯碱厂,按下面的流程生产:

上图的流程中,电解饱和食盐水的化学方程式是______________ ,请写出 Cl2的检验方法____________ ,在工业上,将电解饱和食盐水得到的气体通入______________ 中合成氯化氢,_____________ 燃烧时火焰呈_______________ 色。
(1)有人计算后表明,造成海啸的海底地震的能量相当于 3000 颗广岛原子弹爆炸的能量. 235U 是制 造原子弹的材料之一,它的质子数与中子数之差是
(2)随着灾民生活的渐渐稳定,工业生产也将逐渐恢复,现有一氯碱厂,按下面的流程生产:

上图的流程中,电解饱和食盐水的化学方程式是
您最近一年使用:0次
填空题
|
适中
(0.65)
【推荐1】海洋植物中富含一种人体必需的微量元素——碘。实验室模拟从海带中提取碘单质的流程图如下:
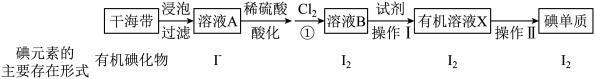
(1)提碘的原料一般选择海带或海藻,是因为_______ 。
(2)在实验室里把有机碘化物转化为碘离子往往需要灼烧操作,灼烧海带需要在_______ 中进行。
(3)若从绿色化学角度考虑,①处选 不好的原因是
不好的原因是_______ 。
(4)操作I中,实验室可用如图仪器将 富集到有机溶液X,该步操作的名称为
富集到有机溶液X,该步操作的名称为_______ ;如图中所选用的有机溶剂可以是_______ (选填编号)。
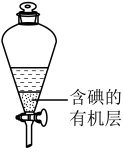
a.酒精b.醋酸c.四氯化碳d.苯
(5)操作I中具体实验步骤为:
A.把盛有溶液的分液漏斗放在铁架台的铁圈中;
B.检验分液漏斗旋塞和上口的瓶塞是否漏液;
C.把20mL碘水跟5mL四氯化碳加入分液漏斗中,并盖好玻璃塞;
D.倒转漏斗振荡,并不时旋开活塞放气,最后关闭活塞,把分液漏斗放正;
E.旋开活塞,用烧杯接收下层溶液;
F.将分液漏斗。上口的玻璃塞打开或使塞上的凹槽对准分液漏斗口上的小孔;
G.从分液漏斗上口倒出上层溶液;
H.静止、分层。
实验步骤的正确顺序为_______ ;_____→_____→_____→A→H→_____→_____→_____。
(6)为寻找氯水的替代品,某同学设计了如下实验来证明 能否代替氯水。实验操作:将
能否代替氯水。实验操作:将 作为氧化剂滴加入溶液A中,取少量反应后的溶液于试管中,
作为氧化剂滴加入溶液A中,取少量反应后的溶液于试管中,_______ ,则证明 能代替氯水。请写出此反应的离子方程式
能代替氯水。请写出此反应的离子方程式_______ 。

(1)提碘的原料一般选择海带或海藻,是因为
(2)在实验室里把有机碘化物转化为碘离子往往需要灼烧操作,灼烧海带需要在
(3)若从绿色化学角度考虑,①处选
 不好的原因是
不好的原因是(4)操作I中,实验室可用如图仪器将
 富集到有机溶液X,该步操作的名称为
富集到有机溶液X,该步操作的名称为
a.酒精b.醋酸c.四氯化碳d.苯
(5)操作I中具体实验步骤为:
A.把盛有溶液的分液漏斗放在铁架台的铁圈中;
B.检验分液漏斗旋塞和上口的瓶塞是否漏液;
C.把20mL碘水跟5mL四氯化碳加入分液漏斗中,并盖好玻璃塞;
D.倒转漏斗振荡,并不时旋开活塞放气,最后关闭活塞,把分液漏斗放正;
E.旋开活塞,用烧杯接收下层溶液;
F.将分液漏斗。上口的玻璃塞打开或使塞上的凹槽对准分液漏斗口上的小孔;
G.从分液漏斗上口倒出上层溶液;
H.静止、分层。
实验步骤的正确顺序为
(6)为寻找氯水的替代品,某同学设计了如下实验来证明
 能否代替氯水。实验操作:将
能否代替氯水。实验操作:将 作为氧化剂滴加入溶液A中,取少量反应后的溶液于试管中,
作为氧化剂滴加入溶液A中,取少量反应后的溶液于试管中, 能代替氯水。请写出此反应的离子方程式
能代替氯水。请写出此反应的离子方程式
您最近一年使用:0次
填空题
|
适中
(0.65)
解题方法
【推荐2】一种废旧磷酸铁锂正极片(主要成分为 、
、 、Al和石墨)的闭环回收工艺流程如图所示:
、Al和石墨)的闭环回收工艺流程如图所示: 为抗坏血酸,具有较强的还原性。
为抗坏血酸,具有较强的还原性。
②滤饼成分为 。
。
回答下列问题:
(1)将不同pH下得到的滤饼溶于盐酸,稀释至一定比例后测算Fe、P物质的量比 ,结果见下表,由此得出,沉淀的最佳pH为
,结果见下表,由此得出,沉淀的最佳pH为_______ 。
(2)调节pH时,氨水不宜加入过量,原因是随着氨水浓度的增大,会产生_______ 杂质;若该步骤中Fe元素沉淀完全,滤液③中除H、O外,还大量含有的元素有_______ 。
 、
、 、Al和石墨)的闭环回收工艺流程如图所示:
、Al和石墨)的闭环回收工艺流程如图所示:
 为抗坏血酸,具有较强的还原性。
为抗坏血酸,具有较强的还原性。②滤饼成分为
 。
。回答下列问题:
(1)将不同pH下得到的滤饼溶于盐酸,稀释至一定比例后测算Fe、P物质的量比
 ,结果见下表,由此得出,沉淀的最佳pH为
,结果见下表,由此得出,沉淀的最佳pH为| pH | 6.0 | 6.5 | 7.0 | 8.0 | 9.0 |
 | 1.54 | 1.50 | 1.49 | 1.47 | 1.47 |
(2)调节pH时,氨水不宜加入过量,原因是随着氨水浓度的增大,会产生
您最近一年使用:0次
填空题
|
适中
(0.65)
名校
解题方法
【推荐3】海水是宝贵的资源宝库,目前氯碱工业、海水提镁、海水提溴为人类提供了大量工业原料。如图是海水综合利用的部分流程图,据图回答问题:
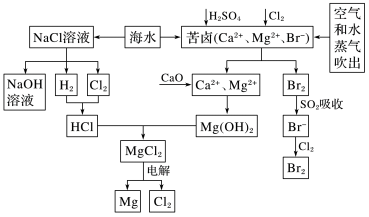
(1)由海水晒制的粗盐中含有Ca2+、Mg2+、 等离子,为除去这些离子,所加试剂及其先后顺序为(写化学式):
等离子,为除去这些离子,所加试剂及其先后顺序为(写化学式):________________________ 。
(2)①电解饱和食盐水的化学方程式为___________ 。
②海水提取的单质Mg可以在二氧化碳中燃烧,该反应的化学方程式为__________ 。
(3)苦卤中通入Cl2置换出Br2,吹出后用SO2吸收,写出用SO2吸收发生反应的离子方程式:_____________ ,由此判断Cl2、Br2、SO2的氧化性由强到弱的顺序为_____________ 。
(4)也有工艺是在吹出Br2后用碳酸钠溶液吸收,生成溴化钠和溴酸钠,同时有CO2放出,该反应的离子方程式是__________ ;最后再用H2SO4处理得到Br2,之后加入CCl4进行Br2的萃取,最终用________ 方法得到单质Br2。

(1)由海水晒制的粗盐中含有Ca2+、Mg2+、
 等离子,为除去这些离子,所加试剂及其先后顺序为(写化学式):
等离子,为除去这些离子,所加试剂及其先后顺序为(写化学式):(2)①电解饱和食盐水的化学方程式为
②海水提取的单质Mg可以在二氧化碳中燃烧,该反应的化学方程式为
(3)苦卤中通入Cl2置换出Br2,吹出后用SO2吸收,写出用SO2吸收发生反应的离子方程式:
(4)也有工艺是在吹出Br2后用碳酸钠溶液吸收,生成溴化钠和溴酸钠,同时有CO2放出,该反应的离子方程式是
您最近一年使用:0次



