NaClO2广泛用于造纸工业、污水处理等。工业上生产NaClO2的工艺流程如下:
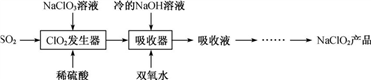
(1) ClO2发生器中发生反应的离子方程式为_________________ 。
(2) 吸收器中反应温度不能高于5 ℃的可能原因有____________ 。
(3) 查阅资料可知:
Ⅰ.ClO2能被I-还原为ClO2-或Cl-:
2ClO2+2I- 2ClO2-+I2
2ClO2-+I2
2ClO2+8H++10I- 2Cl-+5I2+4H2O
2Cl-+5I2+4H2O
ClO2的转化率与溶液pH的关系如图所示。

Ⅱ.pH≤2.0时,ClO2-能被I-完全还原为Cl-:ClO2-+4H++4I- Cl-+2I2+2H2O
Cl-+2I2+2H2O
取少量吸收液加水稀释至一定体积后得溶液Y,可通过下列步骤测定溶液Y中ClO2、ClO2-的浓度:
步骤1:准确量取25.00 mL溶液Y,调节溶液的pH为8.0,加入足量的KI晶体。滴入2滴淀粉溶液,滴加0.020 00 mol·L-1 Na2S2O3溶液,发生反应:2Na2S2O3+I2 Na2S4O6+2NaI。恰好完全反应时,消耗0.020 00 mol·L-1Na2S2O3溶液12.50 mL。
Na2S4O6+2NaI。恰好完全反应时,消耗0.020 00 mol·L-1Na2S2O3溶液12.50 mL。
步骤2:调节上述反应后溶液的pH为1.0,滴加0.250 0 mol·L-1 Na2S2O3溶液。恰好完全反应时,消耗0.250 0 mol·L-1 Na2S2O3溶液40.00 mL。
①判断Na2S2O3溶液与I2恰好完全反应时的实验现象是____________ 。
②请计算溶液Y中ClO2- 的物质的量浓度_____________ (写出计算过程)。

(1) ClO2发生器中发生反应的离子方程式为
(2) 吸收器中反应温度不能高于5 ℃的可能原因有
(3) 查阅资料可知:
Ⅰ.ClO2能被I-还原为ClO2-或Cl-:
2ClO2+2I-
 2ClO2-+I2
2ClO2-+I22ClO2+8H++10I-
 2Cl-+5I2+4H2O
2Cl-+5I2+4H2OClO2的转化率与溶液pH的关系如图所示。

Ⅱ.pH≤2.0时,ClO2-能被I-完全还原为Cl-:ClO2-+4H++4I-
 Cl-+2I2+2H2O
Cl-+2I2+2H2O取少量吸收液加水稀释至一定体积后得溶液Y,可通过下列步骤测定溶液Y中ClO2、ClO2-的浓度:
步骤1:准确量取25.00 mL溶液Y,调节溶液的pH为8.0,加入足量的KI晶体。滴入2滴淀粉溶液,滴加0.020 00 mol·L-1 Na2S2O3溶液,发生反应:2Na2S2O3+I2
 Na2S4O6+2NaI。恰好完全反应时,消耗0.020 00 mol·L-1Na2S2O3溶液12.50 mL。
Na2S4O6+2NaI。恰好完全反应时,消耗0.020 00 mol·L-1Na2S2O3溶液12.50 mL。步骤2:调节上述反应后溶液的pH为1.0,滴加0.250 0 mol·L-1 Na2S2O3溶液。恰好完全反应时,消耗0.250 0 mol·L-1 Na2S2O3溶液40.00 mL。
①判断Na2S2O3溶液与I2恰好完全反应时的实验现象是
②请计算溶液Y中ClO2- 的物质的量浓度
更新时间:2018-02-28 19:13:50
|
相似题推荐
填空题
|
适中
(0.65)
解题方法
【推荐1】碳酸钠俗称纯碱,是一种重要的化工原料。以碳酸氢铵和氯化钠为原料制备碳酸钠,并测定产品中少量碳酸氢钠的含量,过程如下:
步骤I. 的制备
的制备

步骤II.产品中 含量测定
含量测定
①称取产品2.500g,用蒸馏水溶解,定容于250mL容量瓶中;
②移取25.00mL上述溶液于锥形瓶,加入2滴指示剂M,用 盐酸标准溶液滴定,溶液由红色变至近无色(第一滴定终点),消耗盐酸
盐酸标准溶液滴定,溶液由红色变至近无色(第一滴定终点),消耗盐酸 ;
;
③在上述锥形瓶中再加入2滴指示剂N,继续用 盐酸标准溶液滴定至终点(第二滴定终点),又消耗盐酸
盐酸标准溶液滴定至终点(第二滴定终点),又消耗盐酸 ;
;
④平行测定三次, 平均值为22.45,
平均值为22.45, 平均值为23.51。
平均值为23.51。
(1)指示剂N为_______ ,描述第二滴定终点前后颜色变化_______ ;
(2)第一滴定终点时,某同学俯视读数,其他操作均正确,则 质量分数的计算结果
质量分数的计算结果_______ (填“偏大”“偏小”或“无影响”)。
步骤I.
 的制备
的制备
步骤II.产品中
 含量测定
含量测定①称取产品2.500g,用蒸馏水溶解,定容于250mL容量瓶中;
②移取25.00mL上述溶液于锥形瓶,加入2滴指示剂M,用
 盐酸标准溶液滴定,溶液由红色变至近无色(第一滴定终点),消耗盐酸
盐酸标准溶液滴定,溶液由红色变至近无色(第一滴定终点),消耗盐酸 ;
;③在上述锥形瓶中再加入2滴指示剂N,继续用
 盐酸标准溶液滴定至终点(第二滴定终点),又消耗盐酸
盐酸标准溶液滴定至终点(第二滴定终点),又消耗盐酸 ;
;④平行测定三次,
 平均值为22.45,
平均值为22.45, 平均值为23.51。
平均值为23.51。(1)指示剂N为
(2)第一滴定终点时,某同学俯视读数,其他操作均正确,则
 质量分数的计算结果
质量分数的计算结果
您最近一年使用:0次
填空题
|
适中
(0.65)
名校
解题方法
【推荐2】结合下表回答下列问题(均为常温下的数据):
(1)常温下,将a molCH3COONa溶于水配成溶液,向其中滴加等体积的b mol·L-1的盐酸使溶液呈中性(不考虑盐酸和醋酸的挥发),用含a和b的代数式表示醋酸的电离常数Ka=________________
(2)下列方法中,可以使0.10 mol·L-1 CH3COOH的电离程度增大的是___________ 。
a.加入少量0.10 mol·L-1的稀盐酸 b.加热CH3COOH溶液 c.加水稀释至0.010 mol·L-1
d.加入少量冰醋酸 e.加入少量镁粉 f.加入少量0.10 mol·L-1的NaOH溶液
(3)常温下0.1 mol·L-1的CH3COOH溶液在加水稀释过程中,下列表达式的数据一定变小的是______
A.c(H+) B.c(H+)/c(CH3COOH) C.c(H+)·c(OH-) D.c(H+)·c(CH3COO-)/c(CH3COOH)
(4)体积为10 mL pH=2的醋酸溶液与一元酸HX分别加水稀释至1000mL,稀释过程中pH 变化如图所示,则稀释至1000mL时,醋酸溶液中由水电离出来的c(H+)_______ (填“大于”、“等于”或“小于”)HX 溶液中由水电离出来的c(H+)。

(5)常温下0.1 mol/L NaHS的pH___ 7(填“>”“=”或“<”),理由是___________________
(6)将少量的氯气通入到足量的碳酸钠溶液中_____________________ 。
(7)向盐酸溶液中逐滴加入等体积等浓度的Na2CO3溶液,充分振荡,所得溶液中各离子浓度由大到小的顺序为:________________________________________
| 酸 | 电离常数(Ka) | 酸 | 电离常数(Ka) | 酸 | 电离常数(Ka) |
| HClO | 3×10-8 | H2CO3 | K1=4.4×10-7 K2=4.7×10-11 | H2S | K1=1.0×10-7 K2=7.0×10-15 |
(2)下列方法中,可以使0.10 mol·L-1 CH3COOH的电离程度增大的是
a.加入少量0.10 mol·L-1的稀盐酸 b.加热CH3COOH溶液 c.加水稀释至0.010 mol·L-1
d.加入少量冰醋酸 e.加入少量镁粉 f.加入少量0.10 mol·L-1的NaOH溶液
(3)常温下0.1 mol·L-1的CH3COOH溶液在加水稀释过程中,下列表达式的数据一定变小的是
A.c(H+) B.c(H+)/c(CH3COOH) C.c(H+)·c(OH-) D.c(H+)·c(CH3COO-)/c(CH3COOH)
(4)体积为10 mL pH=2的醋酸溶液与一元酸HX分别加水稀释至1000mL,稀释过程中pH 变化如图所示,则稀释至1000mL时,醋酸溶液中由水电离出来的c(H+)

(5)常温下0.1 mol/L NaHS的pH
(6)将少量的氯气通入到足量的碳酸钠溶液中
(7)向盐酸溶液中逐滴加入等体积等浓度的Na2CO3溶液,充分振荡,所得溶液中各离子浓度由大到小的顺序为:
您最近一年使用:0次
填空题
|
适中
(0.65)
名校
【推荐3】滴定分析法是物质检验与含量测定的重要方法之一,在实际生产中应用广泛。

(1) 时,利用
时,利用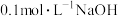 溶液滴定未知浓度的
溶液滴定未知浓度的 溶液,取
溶液,取 溶液进行实验,滴定过程中溶液的
溶液进行实验,滴定过程中溶液的 随滴加
随滴加 溶液体积的变化如图所示,a点为滴定的化学计量点。
溶液体积的变化如图所示,a点为滴定的化学计量点。
①以下哪种指示剂可用于本次滴定实验___________ (括号中为指示剂变色的 范围)。
范围)。
a.酚酞(8.2-10.0) b.甲基橙(3.1-4.4) c.甲基红(4.4-6.2)
② 溶液的浓度为
溶液的浓度为___________  。
。
③滴定过程中,加入 的体积为
的体积为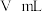 时,测得溶液
时,测得溶液 ,此时溶液中的溶质为
,此时溶液中的溶质为___________ (填物质的化学式),溶液中
___________  (用含V的计算式表示)。
(用含V的计算式表示)。
(2)在酸碱滴定中,还可以通过溶液的电导率判断化学计量点。 时,利用
时,利用 的
的 溶液滴定
溶液滴定 溶液,取
溶液,取 溶液进行实验,滴定过程中溶液电导率随滴加
溶液进行实验,滴定过程中溶液电导率随滴加 溶液体积的变化如图所示,测得
溶液体积的变化如图所示,测得 溶液的浓度为
溶液的浓度为 。
。

①到达滴定终点时,溶液电导率不为0,原因是___________ 。
②b点溶液的
___________ 。

(1)
 时,利用
时,利用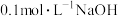 溶液滴定未知浓度的
溶液滴定未知浓度的 溶液,取
溶液,取 溶液进行实验,滴定过程中溶液的
溶液进行实验,滴定过程中溶液的 随滴加
随滴加 溶液体积的变化如图所示,a点为滴定的化学计量点。
溶液体积的变化如图所示,a点为滴定的化学计量点。①以下哪种指示剂可用于本次滴定实验
 范围)。
范围)。a.酚酞(8.2-10.0) b.甲基橙(3.1-4.4) c.甲基红(4.4-6.2)
②
 溶液的浓度为
溶液的浓度为 。
。③滴定过程中,加入
 的体积为
的体积为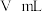 时,测得溶液
时,测得溶液 ,此时溶液中的溶质为
,此时溶液中的溶质为
 (用含V的计算式表示)。
(用含V的计算式表示)。(2)在酸碱滴定中,还可以通过溶液的电导率判断化学计量点。
 时,利用
时,利用 的
的 溶液滴定
溶液滴定 溶液,取
溶液,取 溶液进行实验,滴定过程中溶液电导率随滴加
溶液进行实验,滴定过程中溶液电导率随滴加 溶液体积的变化如图所示,测得
溶液体积的变化如图所示,测得 溶液的浓度为
溶液的浓度为 。
。
①到达滴定终点时,溶液电导率不为0,原因是
②b点溶液的

您最近一年使用:0次
填空题
|
适中
(0.65)
名校
【推荐1】某化学兴趣小组甲、乙两位同学为测定 和
和 混合物中
混合物中 的质量分数,分别进行实验。回答下列问题:
的质量分数,分别进行实验。回答下列问题:
(1)甲同学用如图装置进行测定。

称取一定质量的待测样品于锥形瓶中,反应前先打开弹簧夹,通入一段时间的 ,然后关闭弹簧夹,接上总质量为mg的干燥管,再打开分液漏斗的活塞,滴加稀硫酸进行反应。待锥形瓶中不再有气泡产生,关闭分液漏斗a的活塞,打开弹簧夹,再通入一段时间的
,然后关闭弹簧夹,接上总质量为mg的干燥管,再打开分液漏斗的活塞,滴加稀硫酸进行反应。待锥形瓶中不再有气泡产生,关闭分液漏斗a的活塞,打开弹簧夹,再通入一段时间的 ,然后取下干燥管称得其质量为
,然后取下干燥管称得其质量为 。
。
①洗气瓶b中盛放的液体是___________ (写名称)。
②锥形瓶中发生反应的离子方程式为___________ 。
③第二次通入 的目的是
的目的是___________ 。如果没有进行第一次通 操作,测量的结果将会
操作,测量的结果将会___________ (填“偏大”“偏小”或“不变”)。
④甲同学设计的实验装置中存在一不合理之处,会导致测定结果出现误差。如何改进?________ 。
(2)乙同学用下图所示方法和步骤进行实验:

乙同学测得样品中 的质量分数为
的质量分数为___________ (用含x和y的代数式表示)
 和
和 混合物中
混合物中 的质量分数,分别进行实验。回答下列问题:
的质量分数,分别进行实验。回答下列问题:(1)甲同学用如图装置进行测定。

称取一定质量的待测样品于锥形瓶中,反应前先打开弹簧夹,通入一段时间的
 ,然后关闭弹簧夹,接上总质量为mg的干燥管,再打开分液漏斗的活塞,滴加稀硫酸进行反应。待锥形瓶中不再有气泡产生,关闭分液漏斗a的活塞,打开弹簧夹,再通入一段时间的
,然后关闭弹簧夹,接上总质量为mg的干燥管,再打开分液漏斗的活塞,滴加稀硫酸进行反应。待锥形瓶中不再有气泡产生,关闭分液漏斗a的活塞,打开弹簧夹,再通入一段时间的 ,然后取下干燥管称得其质量为
,然后取下干燥管称得其质量为 。
。①洗气瓶b中盛放的液体是
②锥形瓶中发生反应的离子方程式为
③第二次通入
 的目的是
的目的是 操作,测量的结果将会
操作,测量的结果将会④甲同学设计的实验装置中存在一不合理之处,会导致测定结果出现误差。如何改进?
(2)乙同学用下图所示方法和步骤进行实验:

乙同学测得样品中
 的质量分数为
的质量分数为
您最近一年使用:0次
填空题
|
适中
(0.65)
名校
【推荐2】人们从化石燃料的燃烧过程中获得能量,同时也产生废气及颗粒等污染物,它们在太阳辐射等作用下,经过复杂变化形成次生污染物(如图所示),进而在一定的天气条件下造成酸雨、雾霾、光化学烟雾等污染现象。某班同学分成几个学习小组,以其中的SO2为例,进行了一系列的研究性学习:

(1)在空气、水蒸气的共同作用下,SO2最终会形成___________ (填化学式)随雨水落下,损伤农作物、加快建筑物腐蚀。
(2)实验室制备SO2的化学方程式___________
(3)甲组同学设计用生石灰进行燃煤脱硫工艺,如图所示,请写出脱硫生成X的总反应方程式:___________ 。

(4)乙组同学拟用碱液吸收的方法去除烟气中的SO2,设计了如下两种方案:
方案A

方案B

方案展示后,全班同学讨论后认为两种方案各有优势并可以进一步优化:

新方案的优点是:___________ (填物质名称)实现了循环利用,降低了成本,符合资源再利用的原则。
(5)为测定空气中SO2的含量,丙组同学将空气样品经过管道通入盛有200mL0.1mol·L-1酸性KMnO4溶液的密闭容器中,该反应的离子方程式为___________ ,若管道中空气流量为aL·min-1,经过bmin溶液恰好褪色,假定空气中的SO2可被溶液充分吸收,则该空气样品中的SO2含量为___________ g·L-1(用含a、b的代数式表示)。

(1)在空气、水蒸气的共同作用下,SO2最终会形成
(2)实验室制备SO2的化学方程式
(3)甲组同学设计用生石灰进行燃煤脱硫工艺,如图所示,请写出脱硫生成X的总反应方程式:

(4)乙组同学拟用碱液吸收的方法去除烟气中的SO2,设计了如下两种方案:
方案A

方案B

方案展示后,全班同学讨论后认为两种方案各有优势并可以进一步优化:

新方案的优点是:
(5)为测定空气中SO2的含量,丙组同学将空气样品经过管道通入盛有200mL0.1mol·L-1酸性KMnO4溶液的密闭容器中,该反应的离子方程式为
您最近一年使用:0次
填空题
|
适中
(0.65)
解题方法
【推荐3】化合物M是某种具有磁学性质的新型电子材料的主要成分,由两种元素组成。为了研究其组成,设计如下实验:

气体甲可使湿润红色石蕊试纸变蓝。请回答:
(1)M的化学式为______ ,气体甲的电子式为______ 。
(2)白色沉淀乙在空气中变成红褐色沉淀丙的原因是__________________ (用化学方程式表示)。
(3)高温条件下,丁与甲反应生成两种单质和水,该反应的化学方程式为__________________ 。

气体甲可使湿润红色石蕊试纸变蓝。请回答:
(1)M的化学式为
(2)白色沉淀乙在空气中变成红褐色沉淀丙的原因是
(3)高温条件下,丁与甲反应生成两种单质和水,该反应的化学方程式为
您最近一年使用:0次
填空题
|
适中
(0.65)
【推荐1】如图为某化工企业生产流程示意图:

(1)③中发生置换反应的化学方程式为______ ;③中通入氩气的作用是:_____ 。
(2)从MgCl2溶液中获取无水MgCl2的方法是_____ 。

(1)③中发生置换反应的化学方程式为
(2)从MgCl2溶液中获取无水MgCl2的方法是
您最近一年使用:0次
填空题
|
适中
(0.65)
【推荐2】 是一种难溶于水,易溶于硫酸的固体,可用作金属防腐剂。实验室利用
是一种难溶于水,易溶于硫酸的固体,可用作金属防腐剂。实验室利用 和
和 (第一级电离常数
(第一级电离常数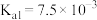 )制备
)制备 的流程如下:
的流程如下:

写出“反应”时总反应的离子方程式:_______ 。
 是一种难溶于水,易溶于硫酸的固体,可用作金属防腐剂。实验室利用
是一种难溶于水,易溶于硫酸的固体,可用作金属防腐剂。实验室利用 和
和 (第一级电离常数
(第一级电离常数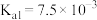 )制备
)制备 的流程如下:
的流程如下:
写出“反应”时总反应的离子方程式:
您最近一年使用:0次
填空题
|
适中
(0.65)
名校
【推荐3】工业上用菱锰矿(MnCO3)[含FeCO3、SiO2、Cu2(OH)2CO3等杂质]为原料制取二氧化锰,其流程示意图如下:

已知:生成氢氧化物沉淀的pH
Ksp(CuS)=6.3×10-16 Ksp(MnS)= 3×10-14
注:金属离子的起始浓度为0.1 mol/L
回答下列问题:
(1)含杂质的菱锰矿使用前需将其粉碎,主要目的是_________________________ 。滤渣1的成分是_________ ,盐酸溶解MnCO3的离子方程式是_________________________________ ;
(2)用生石灰而不用NaOH调节pH的原因是_______________________________ ;
(3)滤液2中加入某种物质X可以除去Cu2+,最适合的是_______________ ;
A.MnO2 B.NaOH C.MnS
该反应的离子方程式是____________________________ ;
(4)将MnCl2转化为MnO2的一种方法是将酸化的NaClO3溶液氧化Mn2+,请补充并配平下列方程;____Mn2++_____ClO3-+______=____Cl2↑+____MnO2+_________;_________________
(5)将MnCl2转化为MnO2的另一种方法是电解法。(填“正极”或“负极”或“阴极”或“阳极”)
① MnO2在电解池的__________________ (填“正极”或“负极”或“阴极”或“阳极”)生成;
② 若直接电解MnCl2溶液,生成MnO2的同时会产生少量Cl2。检验Cl2的操作是_______________ 。

已知:生成氢氧化物沉淀的pH
Mn(OH)2 | Fe(OH)2 | Fe(OH)3 | Cu(OH)2 | |
开始沉淀时 | 8.3 | 6.3 | 2.7 | 4.7 |
完全沉淀时 | 9.8 | 8.3 | 3.7 | 6.7 |
Ksp(CuS)=6.3×10-16 Ksp(MnS)= 3×10-14
注:金属离子的起始浓度为0.1 mol/L
回答下列问题:
(1)含杂质的菱锰矿使用前需将其粉碎,主要目的是
(2)用生石灰而不用NaOH调节pH的原因是
(3)滤液2中加入某种物质X可以除去Cu2+,最适合的是
A.MnO2 B.NaOH C.MnS
该反应的离子方程式是
(4)将MnCl2转化为MnO2的一种方法是将酸化的NaClO3溶液氧化Mn2+,请补充并配平下列方程;____Mn2++_____ClO3-+______=____Cl2↑+____MnO2+_________;
(5)将MnCl2转化为MnO2的另一种方法是电解法。(填“正极”或“负极”或“阴极”或“阳极”)
① MnO2在电解池的
② 若直接电解MnCl2溶液,生成MnO2的同时会产生少量Cl2。检验Cl2的操作是
您最近一年使用:0次



