Ⅰ.(1)室温下,pH=3的CH3COOH溶液加水稀释到原体积的10倍,溶液的pH值范围_____ ;
(2)室温下,pH=1和pH=3的硫酸等体积混合后溶液的pH=_____ (lg2=0.3、lg3=0.477、lg5=0.7)
(3)在25℃时,100ml 0.6mol/L的盐酸与等体积0.4mol/L的氢氧化钠溶液混合后,溶液pH=______
Ⅱ.某烧碱样品含少量不与酸作用的杂质,为了测定其纯度,进行以下滴定操作:
A.在250 mL的容量瓶中定容配成250 mL烧碱溶液
B.用移液管移取25 mL烧碱溶液于锥形瓶中并滴几滴指示剂甲基橙
C.在天平上准确称取烧碱样品Wg,在烧杯中用蒸馏水溶解
D.将物质的量浓度为c的标准盐酸溶液装入酸式滴定管调节液面,记下开始读数为V1
E.在锥形瓶下垫一张白纸,滴定至终点,记下读数V2
回答下列各问题:
(1)正确操作步骤的顺序是(用字母填写)_____ →_____ →_____ →D→_____ 。
(2)D步骤中尖嘴部分应_____________________ 。
(3)滴定终点时锥形瓶中颜色变化____________ 。
(4)若酸式滴定管不用标准盐酸润洗,在其他操作均正确的前提下,会对测定结果(指烧碱的纯度)有何影响?_____ (填“偏高”、“偏低”或“不变”)
(2)室温下,pH=1和pH=3的硫酸等体积混合后溶液的pH=
(3)在25℃时,100ml 0.6mol/L的盐酸与等体积0.4mol/L的氢氧化钠溶液混合后,溶液pH=
Ⅱ.某烧碱样品含少量不与酸作用的杂质,为了测定其纯度,进行以下滴定操作:
A.在250 mL的容量瓶中定容配成250 mL烧碱溶液
B.用移液管移取25 mL烧碱溶液于锥形瓶中并滴几滴指示剂甲基橙
C.在天平上准确称取烧碱样品Wg,在烧杯中用蒸馏水溶解
D.将物质的量浓度为c的标准盐酸溶液装入酸式滴定管调节液面,记下开始读数为V1
E.在锥形瓶下垫一张白纸,滴定至终点,记下读数V2
回答下列各问题:
(1)正确操作步骤的顺序是(用字母填写)
(2)D步骤中尖嘴部分应
(3)滴定终点时锥形瓶中颜色变化
(4)若酸式滴定管不用标准盐酸润洗,在其他操作均正确的前提下,会对测定结果(指烧碱的纯度)有何影响?
更新时间:2019-11-16 21:32:44
|
相似题推荐
解答题-实验探究题
|
适中
(0.65)
【推荐1】用0.2000 mol/L的标准NaOH溶液滴定未知浓度的盐酸,其操作可分为如下几步:
①用蒸馏水洗涤碱式滴定管,注入0.2000mol/L的标准NaOH溶液至“0”刻度线以上;
②调节液面至“ 0”或“0”刻度线稍下, 使滴定管尖嘴充满液体,并记下读数;
③量取20.00 mL待测液注入洁净的锥形瓶中,并加入3滴酚酞溶液;
④用标准液滴定至终点,记下滴定管液面读数。
⑤再重复以上滴定操作3次。
请回答:
(1)以上步骤有错误的是(填编号)__________ 。
(2)步骤③中,量取20.00mL待测液应使用__________ (填仪器名称)。
(3)步骤④滴定时眼睛应注视__________ ;判断到达滴定终点的现象是:__________ 。
(4)以下是实验数据记录表
从表中可以看出,第1次滴定记录的NaOH溶液体积明显多于后三次的体积,其可能的原因是__________ 。
A.锥形瓶装液前,留有少量蒸馏水
B.滴定结束时,俯视读数
C.锥形瓶用待测液润洗
D.滴定过程中,少量标准溶液滴到锥形瓶外的滴定台上
(5)根据表中第2、3、4次记录数据计算,该盐酸浓度为__________ mol/L
①用蒸馏水洗涤碱式滴定管,注入0.2000mol/L的标准NaOH溶液至“0”刻度线以上;
②调节液面至“ 0”或“0”刻度线稍下, 使滴定管尖嘴充满液体,并记下读数;
③量取20.00 mL待测液注入洁净的锥形瓶中,并加入3滴酚酞溶液;
④用标准液滴定至终点,记下滴定管液面读数。
⑤再重复以上滴定操作3次。
请回答:
(1)以上步骤有错误的是(填编号)
(2)步骤③中,量取20.00mL待测液应使用
(3)步骤④滴定时眼睛应注视
(4)以下是实验数据记录表
| 滴定次数 | 盐酸体积(mL) | NaOH溶液体积读数(mL) | |
| 滴定前 | 滴定后 | ||
| 1 | 20.00 | 0.00 | 16.80 |
| 2 | 20.00 | 0.02 | 16.22 |
| 3 | 20.00 | 0.02 | 16.20 |
| 4 | 20.00 | 0.00 | 16.20 |
A.锥形瓶装液前,留有少量蒸馏水
B.滴定结束时,俯视读数
C.锥形瓶用待测液润洗
D.滴定过程中,少量标准溶液滴到锥形瓶外的滴定台上
(5)根据表中第2、3、4次记录数据计算,该盐酸浓度为
您最近一年使用:0次
解答题-实验探究题
|
适中
(0.65)
名校
【推荐2】某化学小组为了研究外界条件对化学反应速率的影响,进行了如下实验:
(实验原理)2KMnO4 + 5H2C2O4 + 3H2SO4=K2SO4 + 2MnSO4 + 10CO2↑ + 8H2O
(实验内容及记录)
请回答:
(1)根据上表中的实验数据,可以得到的结论是__________________ 。
(2)该小组同学根据经验绘制了n(Mn2+)随时间变化趋势的示意图,如图1所示。但有同学查阅已有的实验资料发现,该实验过程中n(Mn2+) 随时间变化的趋势应如图2所示。该小组同学根据图2所示信息提出了新的假设,并继续进行实验探究。

该小组同学提出的假设是___________________________________________________ 。
(3)测血钙的含量时,进行如下实验:
①可将4mL血液用蒸馏水稀释后,向其中加入足量草酸铵(NH4)2C2O4晶体,反应生成CaC2O4沉淀,将沉淀用稀硫酸处理得H2C2O4溶液。
②将①得到的H2C2O4溶液,再用酸性KMnO4溶液滴定,氧化产物为CO2,还原产物为Mn2+。
③终点时用去20mL l.0×l0-4mol/L的KMnO4溶液。
Ⅰ、滴定终点的现象是_________________________________ 。
Ⅱ、下列操作会导致测定结果偏低的是______ 。
A.锥形瓶用待测草酸溶液润洗
B.滴定过程中,锥形瓶摇荡得太剧烈,锥形瓶内有液滴溅出
C.酸式滴定管尖嘴部分在滴定前没有气泡,滴定终点时发现气泡
D.达到滴定终点时,仰视读数
Ⅲ、计算:血液中含钙离子的浓度为______ mol/L。
(实验原理)2KMnO4 + 5H2C2O4 + 3H2SO4=K2SO4 + 2MnSO4 + 10CO2↑ + 8H2O
(实验内容及记录)
| 实验编号 | 室温下,试管中所加试剂及其用量/mL | 室温下溶液颜色褪至无色所需时间/min | |||
| 0.6 mol/L H2C2O4溶液 | H2O | 3 mol/L 稀硫酸 | 0.05mol/L KMnO4溶液 | ||
| 1 | 3.0 | 2.0 | 2.0 | 3.0 | 1.5 |
| 2 | 2.0 | 3.0 | 2.0 | 3.0 | 2.7 |
| 3 | 1.0 | 4.0 | 2.0 | 3.0 | 3.9 |
(1)根据上表中的实验数据,可以得到的结论是
(2)该小组同学根据经验绘制了n(Mn2+)随时间变化趋势的示意图,如图1所示。但有同学查阅已有的实验资料发现,该实验过程中n(Mn2+) 随时间变化的趋势应如图2所示。该小组同学根据图2所示信息提出了新的假设,并继续进行实验探究。

该小组同学提出的假设是
(3)测血钙的含量时,进行如下实验:
①可将4mL血液用蒸馏水稀释后,向其中加入足量草酸铵(NH4)2C2O4晶体,反应生成CaC2O4沉淀,将沉淀用稀硫酸处理得H2C2O4溶液。
②将①得到的H2C2O4溶液,再用酸性KMnO4溶液滴定,氧化产物为CO2,还原产物为Mn2+。
③终点时用去20mL l.0×l0-4mol/L的KMnO4溶液。
Ⅰ、滴定终点的现象是
Ⅱ、下列操作会导致测定结果偏低的是
A.锥形瓶用待测草酸溶液润洗
B.滴定过程中,锥形瓶摇荡得太剧烈,锥形瓶内有液滴溅出
C.酸式滴定管尖嘴部分在滴定前没有气泡,滴定终点时发现气泡
D.达到滴定终点时,仰视读数
Ⅲ、计算:血液中含钙离子的浓度为
您最近一年使用:0次
解答题-实验探究题
|
适中
(0.65)
解题方法
【推荐3】酸碱中和滴定原理也用在其他物质滴定,例如:下面是某化学学习小组的同学对草酸晶体进行的探究性学习的过程,请你参与并协助他们完成相关学习任务。该组同学研究课题是:探究测定草酸晶体(H2C2O4·xH2O)中的x值通过查阅资料知得,草酸易溶于水,水溶液可以用酸性KMnO4溶液进行滴定。2MnO4-+5H2C2O4+6H+=2Mn2++10CO2↑+8H2O
学习小组的同学设计了滴定的方法测定x值。
①称取2.52 g纯草酸晶体,将其配制成100.00 mL水溶液为待测液。
②取25.00 mL待测液放入锥形瓶中,再加入适量的稀H2SO4。
③用浓度为0.1000 mol·L-1的酸性KMnO4标准溶液进行滴定,达到终点时消耗20.00 mL。问:
(1)通过上述数据,计算x=_____________ 。
(2)滴定终点时俯视滴定管刻度,则由此测得的x值会_______ (填“偏大”、“偏小”或“不变”)
学习小组的同学设计了滴定的方法测定x值。
①称取2.52 g纯草酸晶体,将其配制成100.00 mL水溶液为待测液。
②取25.00 mL待测液放入锥形瓶中,再加入适量的稀H2SO4。
③用浓度为0.1000 mol·L-1的酸性KMnO4标准溶液进行滴定,达到终点时消耗20.00 mL。问:
(1)通过上述数据,计算x=
(2)滴定终点时俯视滴定管刻度,则由此测得的x值会
您最近一年使用:0次
解答题-实验探究题
|
适中
(0.65)
名校
解题方法
【推荐1】环境监测测定水中溶解氧的方法是:
①量取a mL水样,迅速加入固定剂MnSO4溶液和碱性KI溶液(含KOH),立即塞好瓶塞,反复振荡,使之充分反应,其反应式为:2Mn2++O2+4OH-=2MnO(OH)2(该反应极快)。
②测定:开塞后迅速加入1~2 mL浓硫酸(酸化,提供H+),使之生成I2,再用b mol/L的Na2S2O3溶液滴定(以淀粉为指示剂),消耗V mL。有关反应式为:MnO(OH)2+2I-+4H+=Mn2++I2+3H2O、I2+2S2O =2I-+S4O
=2I-+S4O 。
。
试回答:
(1)滴定操作时,左手控制滴定管,右手_________________ ,眼睛要注视__________________________ 。
(2)滴定(I2和S2O 反应)以淀粉为指示剂,终点时溶液颜色变化为
反应)以淀粉为指示剂,终点时溶液颜色变化为_________________ 。
(3)水中溶解氧的计算式是_______________ (以g/L为单位)。
(4)测定时,滴定管经蒸馏水洗涤后即加滴定剂Na2S2O3溶液,导致测定结果________ (填“偏高”“偏低”或“无影响”,下同)。
(5)记录测定结果时,滴定前仰视刻度线,滴定到达终点时又俯视刻度线,将导致滴定结果________ 。
①量取a mL水样,迅速加入固定剂MnSO4溶液和碱性KI溶液(含KOH),立即塞好瓶塞,反复振荡,使之充分反应,其反应式为:2Mn2++O2+4OH-=2MnO(OH)2(该反应极快)。
②测定:开塞后迅速加入1~2 mL浓硫酸(酸化,提供H+),使之生成I2,再用b mol/L的Na2S2O3溶液滴定(以淀粉为指示剂),消耗V mL。有关反应式为:MnO(OH)2+2I-+4H+=Mn2++I2+3H2O、I2+2S2O
 =2I-+S4O
=2I-+S4O 。
。试回答:
(1)滴定操作时,左手控制滴定管,右手
(2)滴定(I2和S2O
 反应)以淀粉为指示剂,终点时溶液颜色变化为
反应)以淀粉为指示剂,终点时溶液颜色变化为(3)水中溶解氧的计算式是
(4)测定时,滴定管经蒸馏水洗涤后即加滴定剂Na2S2O3溶液,导致测定结果
(5)记录测定结果时,滴定前仰视刻度线,滴定到达终点时又俯视刻度线,将导致滴定结果
您最近一年使用:0次
解答题-实验探究题
|
适中
(0.65)
【推荐2】I.某学生用 的标准NaOH溶液滴定未知浓度的盐酸,其操作可分为如下几步:
的标准NaOH溶液滴定未知浓度的盐酸,其操作可分为如下几步:
①用蒸馏水洗涤碱式滴定管,注入 的标准NaOH溶液至“0”刻度线以上;
的标准NaOH溶液至“0”刻度线以上;
②固定好滴定管并使滴定管尖嘴充满液体;
③调节液面至“0”或“0”刻度线稍下,并记录读数;
②量取20.00 mL待测液注入洁净的锥形瓶中,并加入2~3滴酚酞试液;
⑤用标准NaOH溶液滴定至终点,记下滴定管液面读数;
⑥重复以上滴定操作2~3次。
请回答下列问题:
(1)以上步骤有错误的是___________ (填编号),该步骤错误操作会导致测定结果___________ (填“偏大”“偏小”或“无影响”)。
(2)下列操作会导致上述所测盐酸溶液的浓度偏高的是___________(填正确答案标号)。
II.乙二酸俗名草酸,下面是化学学习小组的同学对草酸晶体(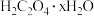 )进行的探究性学习的过程,请你参与并协助他们完成相关学习任务。
)进行的探究性学习的过程,请你参与并协助他们完成相关学习任务。
该组同学的研究课题是:探究测定草酸晶体(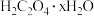 )中的x值。
)中的x值。
通过查阅资料和网络查询得,草酸易溶于水,水溶液可以用酸性 溶液进行滴定:
溶液进行滴定: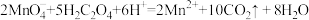
学习小组的同学设计了滴定的方法测定x值
①称取1.260g纯草酸晶体,将其制成100.00 mL水溶液为待测液
②取25.00 mL待测液放入锥形瓶中,再加入适量的稀
③用浓度为 的
的 标准溶液进行滴定,达到终点记录消耗体积。
标准溶液进行滴定,达到终点记录消耗体积。
(3)滴定时,将酸性 标准液装在如图中的
标准液装在如图中的___________ (填“甲”或“乙”)滴定管中。___________ 。
(5)本实验滴定达到终点的标志是___________ 。
(6)为了提高实验的准确性,学习小组共进行3次实验,记录数据如下表:
通过上述数据,可知消耗的 溶液体积为
溶液体积为___________ mL,该“一定质量”草酸晶体中含n(H2C2O4)=___________ mol,则草酸晶体(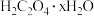 )中x值为
)中x值为___________ 。
 的标准NaOH溶液滴定未知浓度的盐酸,其操作可分为如下几步:
的标准NaOH溶液滴定未知浓度的盐酸,其操作可分为如下几步:①用蒸馏水洗涤碱式滴定管,注入
 的标准NaOH溶液至“0”刻度线以上;
的标准NaOH溶液至“0”刻度线以上;②固定好滴定管并使滴定管尖嘴充满液体;
③调节液面至“0”或“0”刻度线稍下,并记录读数;
②量取20.00 mL待测液注入洁净的锥形瓶中,并加入2~3滴酚酞试液;
⑤用标准NaOH溶液滴定至终点,记下滴定管液面读数;
⑥重复以上滴定操作2~3次。
请回答下列问题:
(1)以上步骤有错误的是
(2)下列操作会导致上述所测盐酸溶液的浓度偏高的是___________(填正确答案标号)。
| A.滴定达到终点时,俯视滴定管内液面读数 |
| B.碱式滴定管尖嘴部分开始有气泡,滴定后消失 |
| C.锥形瓶用蒸馏水洗净后未干燥就装入盐酸待测液 |
| D.滴定到终点读数时发现滴定管尖嘴处悬挂一滴溶液 |
II.乙二酸俗名草酸,下面是化学学习小组的同学对草酸晶体(
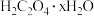 )进行的探究性学习的过程,请你参与并协助他们完成相关学习任务。
)进行的探究性学习的过程,请你参与并协助他们完成相关学习任务。该组同学的研究课题是:探究测定草酸晶体(
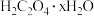 )中的x值。
)中的x值。通过查阅资料和网络查询得,草酸易溶于水,水溶液可以用酸性
 溶液进行滴定:
溶液进行滴定: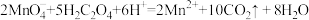
学习小组的同学设计了滴定的方法测定x值
①称取1.260g纯草酸晶体,将其制成100.00 mL水溶液为待测液
②取25.00 mL待测液放入锥形瓶中,再加入适量的稀

③用浓度为
 的
的 标准溶液进行滴定,达到终点记录消耗体积。
标准溶液进行滴定,达到终点记录消耗体积。(3)滴定时,将酸性
 标准液装在如图中的
标准液装在如图中的
(5)本实验滴定达到终点的标志是
(6)为了提高实验的准确性,学习小组共进行3次实验,记录数据如下表:
| 待测液/mL | 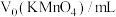 | 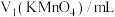 |
| 25.00 | 0.00 | 9.95 |
| 25.00 | 1.05 | 11.10 |
| 25.00 | 0.50 | 13.50 |
 溶液体积为
溶液体积为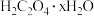 )中x值为
)中x值为
您最近一年使用:0次
解答题-实验探究题
|
适中
(0.65)
解题方法
【推荐3】某学生用0.1mol/L KOH溶液滴定未知浓度的盐酸溶液,其操作可分解为如下几步:
(A)移取20.00mL待测的盐酸溶液注入洁净的锥形瓶,并加入2-3滴酚酞
(B)用标准溶液润洗滴定管2-3次
(C)把盛有标准溶液的碱式滴定管固定好,调节液面使滴定管尖嘴充满溶液
(D)取标准KOH溶液注入碱式滴定管至0刻度以上2-3cm
(E)调节液面至0或0刻度以下,记下读数
(F)把锥形瓶放在滴定管的下面,用标准KOH溶液滴定至终点,记下滴定管液面的刻度
(1) 正确操作的顺序是(用序号字母填写)_________________ 。
(2) 上述(A)操作之前,如先用待测液润洗锥形瓶,则对测定结果的影响是(填偏大、偏小、不变,)________ 。判断到达终点的现象是________________ 。
(A)移取20.00mL待测的盐酸溶液注入洁净的锥形瓶,并加入2-3滴酚酞
(B)用标准溶液润洗滴定管2-3次
(C)把盛有标准溶液的碱式滴定管固定好,调节液面使滴定管尖嘴充满溶液
(D)取标准KOH溶液注入碱式滴定管至0刻度以上2-3cm
(E)调节液面至0或0刻度以下,记下读数
(F)把锥形瓶放在滴定管的下面,用标准KOH溶液滴定至终点,记下滴定管液面的刻度
(1) 正确操作的顺序是(用序号字母填写)
(2) 上述(A)操作之前,如先用待测液润洗锥形瓶,则对测定结果的影响是(填偏大、偏小、不变,)
您最近一年使用:0次
解答题-实验探究题
|
适中
(0.65)
名校
解题方法
【推荐1】用酸碱中和滴定法测定某烧碱的纯度。

(1)滴定管的使用:如图1是滴定管中的液面,其读数为_______ mL。
(2)配制待测液:将2.00g含有少量杂质(不与盐酸反应)的固体烧碱样品配制成200mL溶液。
(2)滴定
①盛装0.2000mol·L-1盐酸标准液应该用图2的_______ (甲或乙)滴定管。
②滴定时,先向锥形瓶中加2~3滴甲基橙作为指示剂。
③有关数据记录如下:
(3)纯度计算:烧碱样品的纯度为_______ 。
(4)滴定终点的现象为_______ 。
(5)对下列几种假定情况的讨论(填“偏高”“偏低”或“无影响”):
①若用蒸馏水冲洗锥形瓶,则会使测定的结果_______ 。
②若在滴定过程中不慎将数滴酸液滴在锥形瓶外,则会使测定结果_______ 。
③若到达滴定终点时俯视滴定管内液面读数,则会使测定结果_______ 。

(1)滴定管的使用:如图1是滴定管中的液面,其读数为
(2)配制待测液:将2.00g含有少量杂质(不与盐酸反应)的固体烧碱样品配制成200mL溶液。
(2)滴定
①盛装0.2000mol·L-1盐酸标准液应该用图2的
②滴定时,先向锥形瓶中加2~3滴甲基橙作为指示剂。
③有关数据记录如下:
| 滴定序号 | 待测液体积(mL) | 消耗盐酸标准液的体积(mL) | |
| 滴定前 | 滴定后 | ||
| 1 | 20.00 | 0.50 | 20.50 |
| 2 | 20.00 | 6.00 | 26.00 |
(4)滴定终点的现象为
(5)对下列几种假定情况的讨论(填“偏高”“偏低”或“无影响”):
①若用蒸馏水冲洗锥形瓶,则会使测定的结果
②若在滴定过程中不慎将数滴酸液滴在锥形瓶外,则会使测定结果
③若到达滴定终点时俯视滴定管内液面读数,则会使测定结果
您最近一年使用:0次
解答题-实验探究题
|
适中
(0.65)
名校
【推荐2】某烧碱溶液中含有少量杂质(不与盐酸反应),现用中和滴定测定其浓度。
(1)用_______ 式滴定管盛装c mol/L盐酸标准液。配制c mol/L盐酸标准液,必须使用的主要容器是____________ 如图表示某次滴定时50 mL滴定管中前后液面的位置。滴定管读数时应注意____________________________________ 。尖嘴部分应____________________________ 。用去的标准盐酸的体积是_____________ mL

(2)该实验应选用_____ 作指示剂;操作中如何确定终点?______________________________ 。
(3)对下列两种假定情况进行讨论:(填“无影响”、“偏高”、“偏低”)
a.若滴定前用蒸馏水冲洗锥形瓶,则会使测定结果__________ ;
b.若在滴定过程中不慎将数滴酸液滴在锥形瓶外,则会使测定结果__________ ;
(1)用

(2)该实验应选用
(3)对下列两种假定情况进行讨论:(填“无影响”、“偏高”、“偏低”)
a.若滴定前用蒸馏水冲洗锥形瓶,则会使测定结果
b.若在滴定过程中不慎将数滴酸液滴在锥形瓶外,则会使测定结果
您最近一年使用:0次
解答题-实验探究题
|
适中
(0.65)
名校
【推荐3】溶解氧(DO)是指每升水中溶解氧气的质量,环境监测部门测定水中溶解氧的方法是:
①量取10mL水样,迅速加入固定剂MnSO4溶液和碱性KI溶液(含KOH),立即塞好瓶塞,反复振荡,使之充分反应,其反应式为:2Mn2++O2+4OH-=2MnO(OH)2(该反应极快)。
②测定:打开瓶塞后迅速加入1〜2 mL硫酸酸化,发生反应:MnO(OH)2 +2I-+4H+=Mn2++I2+3H2O,加入指示剂再用2mol/L的Na2S2O3标准液滴定,消耗Na2S2O3溶液2.5mL。有关反应式为:I2+2S2O32-=2I-+S4O62-。
请回答:
(1)滴定管为什么要润洗?___
(2)该滴定反应选用的最佳指示剂为___ ,滴定终点的判断依据为___ 。
(3)水中溶解氧的量为__ (以g/L为单位)。
(4)下列操作导致测定结果偏高的是___ ,导致测定结果偏低的是___ 。
a.测定时滴定管经蒸馏水洗涤后即加Na2S2O3溶液
b.记录测定结果时,滴定前平视刻度线,滴定到达终点时俯视刻度线
c.滴定过程中向锥形瓶中加蒸馏水
d.达到滴定终点时发现滴定管尖嘴处悬有一滴标准液
e.滴定管中,滴定前无气泡,滴定后有气泡
f.锥形瓶用待测液润洗
①量取10mL水样,迅速加入固定剂MnSO4溶液和碱性KI溶液(含KOH),立即塞好瓶塞,反复振荡,使之充分反应,其反应式为:2Mn2++O2+4OH-=2MnO(OH)2(该反应极快)。
②测定:打开瓶塞后迅速加入1〜2 mL硫酸酸化,发生反应:MnO(OH)2 +2I-+4H+=Mn2++I2+3H2O,加入指示剂再用2mol/L的Na2S2O3标准液滴定,消耗Na2S2O3溶液2.5mL。有关反应式为:I2+2S2O32-=2I-+S4O62-。
请回答:
(1)滴定管为什么要润洗?
(2)该滴定反应选用的最佳指示剂为
(3)水中溶解氧的量为
(4)下列操作导致测定结果偏高的是
a.测定时滴定管经蒸馏水洗涤后即加Na2S2O3溶液
b.记录测定结果时,滴定前平视刻度线,滴定到达终点时俯视刻度线
c.滴定过程中向锥形瓶中加蒸馏水
d.达到滴定终点时发现滴定管尖嘴处悬有一滴标准液
e.滴定管中,滴定前无气泡,滴定后有气泡
f.锥形瓶用待测液润洗
您最近一年使用:0次
解答题-实验探究题
|
适中
(0.65)
名校
解题方法
【推荐1】某学生用0.2000 mol/L的标准NaOH溶液滴定未知浓度的盐酸,操作为如下几步:
①用蒸馏水洗涤碱式滴定管,并立即注入NaOH溶液至“0”刻度线以上
②固定好滴定管并使滴定管尖嘴充满液体
③调节液面至“0”或“0”刻度线以下某一刻度,并记下读数
④移取20.00 mL待测液注入洁净的锥形瓶中,并加入3滴酚酞溶液
⑤用标准液滴定至终点,记下滴定管液面读数
(1)以上步骤有错误的是___________ (填编号),该错误操作会导致测定结果___________ (填“偏大”“偏小”或“无影响”)。
(2)判断滴定终点的现象是___________ 。
(3)下图是某次滴定时滴定管的液面,其读数是___________ mL。

(4)所得数据如下:
请计算待测盐酸的浓度为___________ mol/L。
①用蒸馏水洗涤碱式滴定管,并立即注入NaOH溶液至“0”刻度线以上
②固定好滴定管并使滴定管尖嘴充满液体
③调节液面至“0”或“0”刻度线以下某一刻度,并记下读数
④移取20.00 mL待测液注入洁净的锥形瓶中,并加入3滴酚酞溶液
⑤用标准液滴定至终点,记下滴定管液面读数
(1)以上步骤有错误的是
(2)判断滴定终点的现象是
(3)下图是某次滴定时滴定管的液面,其读数是

(4)所得数据如下:
| 滴定次数 | 待测液体积(mL) | 标准NaOH溶液读数记录(mL) | |
| 滴定前读数 | 滴定后读数 | ||
| 第一次 | 20.00 | 0.38 | 20.40 |
| 第二次 | 20.00 | 4.00 | 23.98 |
| 第三次 | 20.00 | 2.00 | 24.10 |
您最近一年使用:0次
解答题-实验探究题
|
适中
(0.65)
【推荐2】用物质的量浓度为a mol·L-1的标准NaOH溶液去测定V mL盐酸的物质的量浓度,请填写下列空白:
(1)碱式滴定管用蒸馏水洗净后,接下来应该进行的操作是_______________________ 。
(2)用标准NaOH溶液滴定时,应将标准NaOH溶液注入________ (填“甲”或“乙”)中。
(3)取20.00 mL待测盐酸放入锥形瓶中,并滴加2~3滴酚酞作指示剂,用标准NaOH溶液进行滴定。重复上述滴定操作2~3次,记录数据如下。
①滴定达到终点的标志是_____________________ 。
②根据上述数据,可计算出该盐酸的浓度约为_____________ (保留两位有效数字)。
(4)若所测得盐酸浓度偏大,原因可能是________ 。
A.实验结束时俯视刻度线读取滴定终点时NaOH溶液的体积
B.滴定前滴定管尖嘴有气泡,滴定结束无气泡
C.盛装标准液的滴定管装液前用蒸馏水润洗过,未用标准液润洗
D.第一次滴定用的锥形瓶用待装液润洗过,后两次未润洗
E.滴加NaOH溶液过快,未充分振荡,刚看到溶液变色,立刻停止滴定
(1)碱式滴定管用蒸馏水洗净后,接下来应该进行的操作是
(2)用标准NaOH溶液滴定时,应将标准NaOH溶液注入

(3)取20.00 mL待测盐酸放入锥形瓶中,并滴加2~3滴酚酞作指示剂,用标准NaOH溶液进行滴定。重复上述滴定操作2~3次,记录数据如下。
| 实验编号 | NaOH溶液的浓度(mol·L-1) | 滴定完成时NaOH溶液滴入的体积(mL) | 待测盐酸的体积(mL) |
| 1 | 0.10 | 22.62 | 20.00 |
| 2 | 0.10 | 22.72 | 20.00 |
| 3 | 0.10 | 22.80 | 20.00 |
②根据上述数据,可计算出该盐酸的浓度约为
(4)若所测得盐酸浓度偏大,原因可能是
A.实验结束时俯视刻度线读取滴定终点时NaOH溶液的体积
B.滴定前滴定管尖嘴有气泡,滴定结束无气泡
C.盛装标准液的滴定管装液前用蒸馏水润洗过,未用标准液润洗
D.第一次滴定用的锥形瓶用待装液润洗过,后两次未润洗
E.滴加NaOH溶液过快,未充分振荡,刚看到溶液变色,立刻停止滴定
您最近一年使用:0次
解答题-原理综合题
|
适中
(0.65)
【推荐3】氢叠氮酸(HN3)和莫尔盐 是两种常用原料。
是两种常用原料。
(1)氢叠氮酸易溶于水,25℃时,该酸的电离常数为
①氢叠氮酸在水溶液中的电离方程式为___________ 。
②0.1 mol/L的HN3溶液与0.1 mol/L的NaOH溶液等体积混合后,恢复到25℃时溶液中质子守恒关系式为___________ 。
③已知T℃时, ,
, ,在此温度下,
,在此温度下, ,该反应正反应方向
,该反应正反应方向___________ (填“能”或“不能”)基本进行彻底,请通过计算说明___________ 。
(2)在FeSO4溶液中,加入(NH4)2SO4固体可制备莫尔盐晶体,为了测定产品纯度,称取ag产品溶于水,配制成500 mL溶液,用浓度为c mol/L的酸性高锰酸钾溶液滴定,每次所取待测液体积均为25.00 mL,实验结果记录如下(已知莫尔盐的相对分子质量为392):
滴定终点的现象是___________ ,通过实验数据,计算该产品的纯度为___________ (用含字母a、c的式子表示)。上表中第一次实验的记录数据明显大于后两次,其原因可能是___________ (填字母)。
A.第一次滴定时,锥形瓶用待装液润洗
B.该酸性高锰酸钾标准液保存时间过长,部分变质
C.滴定前酸式滴定管中尖嘴处有气泡,滴定结束后气泡消失
 是两种常用原料。
是两种常用原料。(1)氢叠氮酸易溶于水,25℃时,该酸的电离常数为

①氢叠氮酸在水溶液中的电离方程式为
②0.1 mol/L的HN3溶液与0.1 mol/L的NaOH溶液等体积混合后,恢复到25℃时溶液中质子守恒关系式为
③已知T℃时,
 ,
, ,在此温度下,
,在此温度下, ,该反应正反应方向
,该反应正反应方向(2)在FeSO4溶液中,加入(NH4)2SO4固体可制备莫尔盐晶体,为了测定产品纯度,称取ag产品溶于水,配制成500 mL溶液,用浓度为c mol/L的酸性高锰酸钾溶液滴定,每次所取待测液体积均为25.00 mL,实验结果记录如下(已知莫尔盐的相对分子质量为392):
| 实验次数 | 第一次 | 第二次 | 第三次 |
| 消耗KMnO4溶液体积/mL | 25.52 | 25.02 | 24.98 |
A.第一次滴定时,锥形瓶用待装液润洗
B.该酸性高锰酸钾标准液保存时间过长,部分变质
C.滴定前酸式滴定管中尖嘴处有气泡,滴定结束后气泡消失
您最近一年使用:0次



