某课外小组采用碘量法测定河水中的溶解氧。实验步骤及测定原理如下:
Ⅰ.取样、氧的固定
用溶解氧瓶采集水样。记录大气压及水体温度。将水样与Mn(OH)2碱性悬浊液(含有KI)混合,反应生成MnO(OH)2,实现氧的固定。
Ⅱ.酸化、滴定
将固氧后的水样酸化,MnO(OH)2被I−还原为Mn2+,在暗处静置5 min,然后用标准Na2S2O3溶液滴定生成的I2(2 +I2 = 2I−+
+I2 = 2I−+ )。
)。
回答下列问题:
(1)取水样时应尽量避免扰动水体表面,这样操作的主要目的是_____ 。
(2)“氧的固定”中发生反应的化学方程式为___________ 。
(3)Na2S2O3能水解,则滴定时Na2S2O3溶液应装在_____ (填下图中的仪器编号)。请补充润洗该仪器的操作方法:从滴定管____ 加入3~5mL所要盛装的溶液,__________ ,然后,一手控制活塞(酸式滴定管轻轻转动活塞;碱式滴定管轻轻挤压玻璃球),将液体从滴定管__ 放入预置的烧杯中。
(4)某次滴定前滴定管液面如图所示,读数为________ mL。

(5)量取100.00 mL水样经固氧、酸化后,从中取20.00 mL放入锥形瓶,用a mol·L−1Na2S2O3溶液滴定,以淀粉溶液作指示剂,终点现象为________________ ;若消耗Na2S2O3溶液的体积为b mL,则水样中溶解氧的含量为__ mg·L−1。
Ⅰ.取样、氧的固定
用溶解氧瓶采集水样。记录大气压及水体温度。将水样与Mn(OH)2碱性悬浊液(含有KI)混合,反应生成MnO(OH)2,实现氧的固定。
Ⅱ.酸化、滴定
将固氧后的水样酸化,MnO(OH)2被I−还原为Mn2+,在暗处静置5 min,然后用标准Na2S2O3溶液滴定生成的I2(2
 +I2 = 2I−+
+I2 = 2I−+ )。
)。回答下列问题:
(1)取水样时应尽量避免扰动水体表面,这样操作的主要目的是
(2)“氧的固定”中发生反应的化学方程式为
(3)Na2S2O3能水解,则滴定时Na2S2O3溶液应装在

(4)某次滴定前滴定管液面如图所示,读数为

(5)量取100.00 mL水样经固氧、酸化后,从中取20.00 mL放入锥形瓶,用a mol·L−1Na2S2O3溶液滴定,以淀粉溶液作指示剂,终点现象为
更新时间:2019-11-18 22:30:53
|
相似题推荐
解答题-工业流程题
|
较难
(0.4)
名校
【推荐1】亚铁氰化钾晶体,化学式为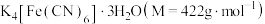 ,俗名黄血盐,可溶于水,不溶于乙醇,在电镀、食品添加剂等方面有广泛用途。用含NaCN的废液合成黄血盐的主要工艺流程如下:
,俗名黄血盐,可溶于水,不溶于乙醇,在电镀、食品添加剂等方面有广泛用途。用含NaCN的废液合成黄血盐的主要工艺流程如下:
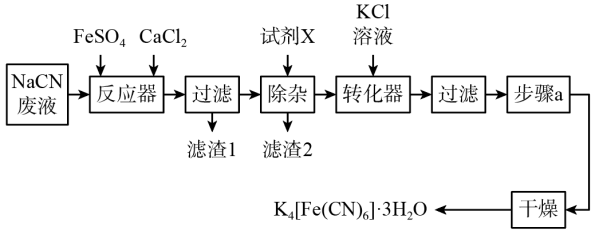
(1)实验室用绿矾晶体配制硫酸亚铁溶液时,为了防止其变质需要添加的试剂为___________ 。
(2)反应器中发生的主要反应的化学方程式为___________ 。
(3)在“除杂”步骤中,向体系中加入适量的试剂X为___________ (填字母)。
a.NaCl b. c.
c.
(4)转化器中发生反应的离子方程式___________ 。
(5)实验室进行步骤a的操作为___________ 。
(6)对所得样品进行纯度测定:
步骤1:准确称取8.884g黄血盐样品加入水中充分溶解,将所得溶液转移至容量瓶并配制成100.00mL溶液。
步骤2:量取25.00mL上述溶液,用 酸性
酸性 溶液滴定,达到滴定终点时,共消耗
溶液滴定,达到滴定终点时,共消耗 溶液30.50mL。该实验中所发生的反应如下:
溶液30.50mL。该实验中所发生的反应如下:
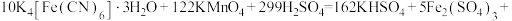
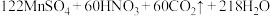
①通过计算确定该样品的纯度是___________ (保留3位有效数字)。
②下列操作会使测定结果偏高的是___________ (填字母)。
A.步骤1过程中黄血盐所含亚铁在空气中部分氧化
B.滴定前仰视滴定管读数,滴定后读数正确
C.滴定结束后,滴定管内壁附着液滴
D.滴定前滴定管尖嘴部分有气泡,滴定后尖嘴部分无气泡
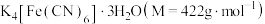 ,俗名黄血盐,可溶于水,不溶于乙醇,在电镀、食品添加剂等方面有广泛用途。用含NaCN的废液合成黄血盐的主要工艺流程如下:
,俗名黄血盐,可溶于水,不溶于乙醇,在电镀、食品添加剂等方面有广泛用途。用含NaCN的废液合成黄血盐的主要工艺流程如下:
(1)实验室用绿矾晶体配制硫酸亚铁溶液时,为了防止其变质需要添加的试剂为
(2)反应器中发生的主要反应的化学方程式为
(3)在“除杂”步骤中,向体系中加入适量的试剂X为
a.NaCl b.
 c.
c.
(4)转化器中发生反应的离子方程式
(5)实验室进行步骤a的操作为
(6)对所得样品进行纯度测定:
步骤1:准确称取8.884g黄血盐样品加入水中充分溶解,将所得溶液转移至容量瓶并配制成100.00mL溶液。
步骤2:量取25.00mL上述溶液,用
 酸性
酸性 溶液滴定,达到滴定终点时,共消耗
溶液滴定,达到滴定终点时,共消耗 溶液30.50mL。该实验中所发生的反应如下:
溶液30.50mL。该实验中所发生的反应如下: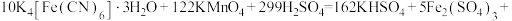
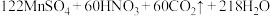
①通过计算确定该样品的纯度是
②下列操作会使测定结果偏高的是
A.步骤1过程中黄血盐所含亚铁在空气中部分氧化
B.滴定前仰视滴定管读数,滴定后读数正确
C.滴定结束后,滴定管内壁附着液滴
D.滴定前滴定管尖嘴部分有气泡,滴定后尖嘴部分无气泡
您最近一年使用:0次
解答题-工业流程题
|
较难
(0.4)
名校
解题方法
【推荐2】亚氯酸钠(NaClO2)和 ClO2 都是重要的漂白剂。通常情况下,NaClO2 也是一种重要的杀菌消毒剂;ClO2是一种具有强氧化性的黄色气体,常用于水的净化和纸浆、纺织品的漂白。
Ⅰ.NaClO2的一种生产工艺如下:
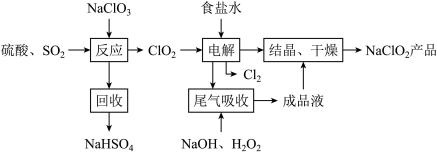
已知:NaClO2饱和溶液,在温度低于38℃时,析出的晶体是NaClO2•3H2O;高于38℃时析出的晶体是 NaClO2;高于 60℃时,NaClO2分解成NaClO3和NaCl。
(1)写出“反应”步骤中的还原产物:__________ 。
(2)“电解”所用食盐水由粗盐水精制而成,精制时,为除去Ca2+和 Mg2+,要加入的试剂分别为:____
(3)“尾气吸收”是吸收“电解”过程排出的少量ClO2。写出此吸收反应的离子方程式:___________
(4)“结晶、干燥”获得 NaClO2产品的操作步骤为:①减压,55℃蒸发结晶;②趁热过滤;③______ ;④38℃~60℃干燥,得到产品。
Ⅱ.检测自来水中残留ClO2方法如下:已知:①ClO2存在于pH为4~6的溶液中,ClO2—存在于中性溶液中;②2Na2S2O3+I2=Na2S4O6+2NaI。
(5)取 0.5L 水样,加入一定量的碘化钾,用氢氧化钠溶液调至中性,再加入淀粉溶液,溶液变蓝。写出ClO2与碘化钾反应的化学方程式:_________ 。
(6)向(5)所得溶液中滴加 5.00×10—5mol·L-1的Na2S2O3溶液至恰好反应,消耗Na2S2O3溶液 20.00mL,该水样中ClO2的浓度是_______ mg·L-1。
(7)滴定完成后,向(6)所得溶液中加硫酸调节水样pH至1~3。不同pH环境中粒子种类如下图所示:
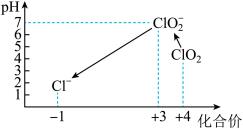
在步骤(3)过程中,溶液又呈蓝色,其原因是_________ 。
Ⅰ.NaClO2的一种生产工艺如下:

已知:NaClO2饱和溶液,在温度低于38℃时,析出的晶体是NaClO2•3H2O;高于38℃时析出的晶体是 NaClO2;高于 60℃时,NaClO2分解成NaClO3和NaCl。
(1)写出“反应”步骤中的还原产物:
(2)“电解”所用食盐水由粗盐水精制而成,精制时,为除去Ca2+和 Mg2+,要加入的试剂分别为:
(3)“尾气吸收”是吸收“电解”过程排出的少量ClO2。写出此吸收反应的离子方程式:
(4)“结晶、干燥”获得 NaClO2产品的操作步骤为:①减压,55℃蒸发结晶;②趁热过滤;③
Ⅱ.检测自来水中残留ClO2方法如下:已知:①ClO2存在于pH为4~6的溶液中,ClO2—存在于中性溶液中;②2Na2S2O3+I2=Na2S4O6+2NaI。
(5)取 0.5L 水样,加入一定量的碘化钾,用氢氧化钠溶液调至中性,再加入淀粉溶液,溶液变蓝。写出ClO2与碘化钾反应的化学方程式:
(6)向(5)所得溶液中滴加 5.00×10—5mol·L-1的Na2S2O3溶液至恰好反应,消耗Na2S2O3溶液 20.00mL,该水样中ClO2的浓度是
(7)滴定完成后,向(6)所得溶液中加硫酸调节水样pH至1~3。不同pH环境中粒子种类如下图所示:

在步骤(3)过程中,溶液又呈蓝色,其原因是
您最近一年使用:0次
解答题-实验探究题
|
较难
(0.4)
【推荐3】某研究小组为了更准确检测香菇中添加剂亚硫酸盐的含量,设计实验如下:
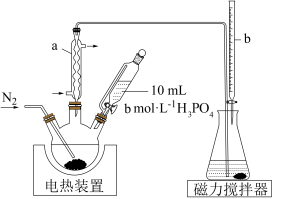
①三颈烧瓶中加入10.00g香菇样品和400mL水;锥形瓶中加入125mL水、1mL淀粉溶液,并预加0.30mL0.01000mol/L的碘标准溶液,搅拌。
②以0.2L/min流速通氮气,再加入过量磷酸,加热并保持微沸,同时用碘标准溶液滴定,至终点时滴定消耗了1.00mL碘标准溶液。
③做空白实验,消耗了0.10mL碘标准溶液。
④用适量Na2SO3替代香菇样品,重复上述步骤,测得SO2的平均回收率为95%。
已知:H3PO4+SO
 HPO
HPO +H2SO3
+H2SO3
回答下列问题:
(1)装置图中仪器a、b的名称分别为___________ 、___________ 。
(2)三颈烧瓶适宜的规格为___________ (填标号)。
A.250mL B.500mL C.1000mL
(3)解释加入H3PO4,能够生成SO2的原因:___________ 。
(4)滴定管在使用前需要___________ 、洗涤、润洗;滴定终点时溶液的颜色为___________ ;滴定反应的离子方程式为___________ 。
(5)若先加磷酸再通氮气,会使测定结果___________ (填“偏高”“偏低”或“无影响”)。
(6)该样品中亚硫酸盐含量为___________ mg/kg(以SO2计,结果保留三位有效数字)。

①三颈烧瓶中加入10.00g香菇样品和400mL水;锥形瓶中加入125mL水、1mL淀粉溶液,并预加0.30mL0.01000mol/L的碘标准溶液,搅拌。
②以0.2L/min流速通氮气,再加入过量磷酸,加热并保持微沸,同时用碘标准溶液滴定,至终点时滴定消耗了1.00mL碘标准溶液。
③做空白实验,消耗了0.10mL碘标准溶液。
④用适量Na2SO3替代香菇样品,重复上述步骤,测得SO2的平均回收率为95%。
已知:H3PO4+SO

 HPO
HPO +H2SO3
+H2SO3回答下列问题:
(1)装置图中仪器a、b的名称分别为
(2)三颈烧瓶适宜的规格为
A.250mL B.500mL C.1000mL
(3)解释加入H3PO4,能够生成SO2的原因:
(4)滴定管在使用前需要
(5)若先加磷酸再通氮气,会使测定结果
(6)该样品中亚硫酸盐含量为
您最近一年使用:0次
解答题-实验探究题
|
较难
(0.4)
名校
【推荐1】某学习小组通过如右图所示装置探究MnO2与FeCl3·6H2O能否反应产生Cl2。
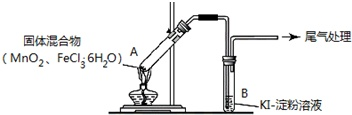
实验操作和现象:
(1)实验前要首先进行的操作是____________ .
(2)现象Ⅰ中白雾的成分是_________ (填名称),形成白雾的原因是________ .
(3)将现象Ⅰ中得到的黄色气体通入KSCN溶液,溶液变红。则现象Ⅱ中黄色气体除了Cl2还含有________ (填化学式);该物质能使B中KI-淀粉溶液变蓝,发生反应的离子方程式是______ .
(4)为了确认现象Ⅱ中黄色气体中含有Cl2,小组提出如下方案:
方案:将B中KI-淀粉溶液替换为NaBr溶液。
现象: B中溶液呈浅橙红色;未检出Fe2+。
a.写出用铁氰化钾溶液检验Fe2+原理的离子方程式:_________
b.方案中检验Fe2+的原因是____________ 。

实验操作和现象:
| 操作 | 现象 |
| 点燃酒精灯,加热 | i.A中部分固体溶解,上方出现白雾 ii.稍后,产生黄色气体,管壁附着黄色液滴 iii.B中溶液变蓝 |
(2)现象Ⅰ中白雾的成分是
(3)将现象Ⅰ中得到的黄色气体通入KSCN溶液,溶液变红。则现象Ⅱ中黄色气体除了Cl2还含有
(4)为了确认现象Ⅱ中黄色气体中含有Cl2,小组提出如下方案:
方案:将B中KI-淀粉溶液替换为NaBr溶液。
现象: B中溶液呈浅橙红色;未检出Fe2+。
a.写出用铁氰化钾溶液检验Fe2+原理的离子方程式:
b.方案中检验Fe2+的原因是
您最近一年使用:0次
解答题-实验探究题
|
较难
(0.4)
解题方法
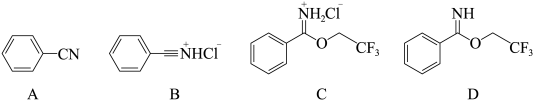
【推荐2】芳基亚胺酯是重要的有机反应中间体,受热易分解,可由腈在酸催化下与醇发生Pinner反应制备,原理如下图所示。
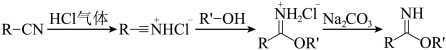
某实验小组以苯甲腈(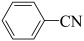 ,
,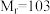 )和三氟乙醇(
)和三氟乙醇(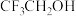 ,
,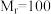 ) 为原料合成苯甲亚胺三氟乙酯。步骤如下:
) 为原料合成苯甲亚胺三氟乙酯。步骤如下:
I.将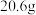 苯甲腈与
苯甲腈与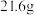 三氟乙醇置于容器中,冰浴降温至
三氟乙醇置于容器中,冰浴降温至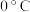 。
。
Ⅱ.向容器中持续通入 气体4小时,密封容器。
气体4小时,密封容器。
Ⅲ.室温下在 氛围中继续搅拌反应液24小时,冷却至
氛围中继续搅拌反应液24小时,冷却至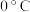 ,抽滤得白色固体,用乙腈洗涤。
,抽滤得白色固体,用乙腈洗涤。
IV.将洗涤后的白色固体加入饱和 溶液中,低温下反应,有机溶剂萃取3次,合并有机相。
溶液中,低温下反应,有机溶剂萃取3次,合并有机相。
V.向有机相中加入无水 ,过滤,蒸去溶剂得产品
,过滤,蒸去溶剂得产品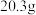 。
。
回答下列问题:
(1)实验室中可用浓盐酸和无水 制备干燥
制备干燥 气体,下列仪器中一定需要的为
气体,下列仪器中一定需要的为__________ (填仪器名称)。
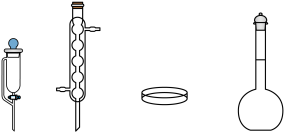
(2)第Ⅱ步通气完毕后,容器密封的原因为__________ 。
(3)第Ⅲ步中得到的白色固体主要成分为__________ 。
(4)第IV步中选择低温的原因为__________ 。
(5)第IV步萃取时可选用的有机溶剂为__________。
(6)第V步中无水 的作用为
的作用为____________________ 。
(7)本实验的产率为__________ 。
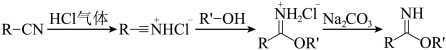
某实验小组以苯甲腈(
 ,
,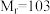 )和三氟乙醇(
)和三氟乙醇(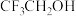 ,
,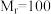 ) 为原料合成苯甲亚胺三氟乙酯。步骤如下:
) 为原料合成苯甲亚胺三氟乙酯。步骤如下:I.将
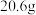 苯甲腈与
苯甲腈与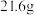 三氟乙醇置于容器中,冰浴降温至
三氟乙醇置于容器中,冰浴降温至 。
。Ⅱ.向容器中持续通入
 气体4小时,密封容器。
气体4小时,密封容器。Ⅲ.室温下在
 氛围中继续搅拌反应液24小时,冷却至
氛围中继续搅拌反应液24小时,冷却至 ,抽滤得白色固体,用乙腈洗涤。
,抽滤得白色固体,用乙腈洗涤。IV.将洗涤后的白色固体加入饱和
 溶液中,低温下反应,有机溶剂萃取3次,合并有机相。
溶液中,低温下反应,有机溶剂萃取3次,合并有机相。V.向有机相中加入无水
 ,过滤,蒸去溶剂得产品
,过滤,蒸去溶剂得产品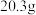 。
。回答下列问题:
(1)实验室中可用浓盐酸和无水
 制备干燥
制备干燥 气体,下列仪器中一定需要的为
气体,下列仪器中一定需要的为
(2)第Ⅱ步通气完毕后,容器密封的原因为
(3)第Ⅲ步中得到的白色固体主要成分为

(4)第IV步中选择低温的原因为
(5)第IV步萃取时可选用的有机溶剂为__________。
| A.丙酮 | B.乙酸 | C.乙酸乙酯 | D.甲醇 |
(6)第V步中无水
 的作用为
的作用为(7)本实验的产率为
您最近一年使用:0次
解答题-实验探究题
|
较难
(0.4)
解题方法
【推荐3】某化学兴趣小组在实验室进行从海带中提取碘的实验,实验流程如图所示。
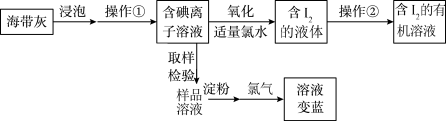
(1)操作①的名称是_______ ,操作②的主要仪器是_______ ;氧化步骤中发生反应的离子方程式是_______ 。
(2)取样检验时,部分同学没有观察到溶液变蓝。他们假设原因可能是通入的氯气过量,氧化了①碘、②淀粉、③碘和淀粉。他们在没有变蓝的溶液中,滴加_______ (填“四氯化碳”“碘水”或“淀粉溶液”)后,若溶液出现_______ 现象,即可证明假设①正确,同时排除假设②③。能同时排除假设②③的原因是_______ 。
(3)查阅资料; 可氧化I2,反应的化学方程式为
可氧化I2,反应的化学方程式为 。请用双线桥法标出电子转移的方向和数目
。请用双线桥法标出电子转移的方向和数目________ 。
(4)在盛有 溶液的试管中,滴入几滴KI溶液,反应一段时间后加入
溶液的试管中,滴入几滴KI溶液,反应一段时间后加入 苯(密度比水小),振荡后静置,出现
苯(密度比水小),振荡后静置,出现_______ (填实验现象),证明有 存在。
存在。
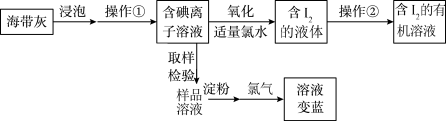
(1)操作①的名称是
(2)取样检验时,部分同学没有观察到溶液变蓝。他们假设原因可能是通入的氯气过量,氧化了①碘、②淀粉、③碘和淀粉。他们在没有变蓝的溶液中,滴加
(3)查阅资料;
 可氧化I2,反应的化学方程式为
可氧化I2,反应的化学方程式为 。请用双线桥法标出电子转移的方向和数目
。请用双线桥法标出电子转移的方向和数目(4)在盛有
 溶液的试管中,滴入几滴KI溶液,反应一段时间后加入
溶液的试管中,滴入几滴KI溶液,反应一段时间后加入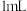 苯(密度比水小),振荡后静置,出现
苯(密度比水小),振荡后静置,出现 存在。
存在。
您最近一年使用:0次



