白磷、红磷是磷的两种同素异形体,在空气中燃烧得到磷的氧化物,空气不足时生成 P4O6,空气充足时生成 P4O10。
(1)已知 298K 时白磷、红磷完全燃烧的热化学方程式分别为
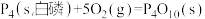 △H1 =-2983.2kJ/mol
△H1 =-2983.2kJ/mol
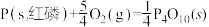 △H2 =-738.5kJ/mol
△H2 =-738.5kJ/mol
则该温度下白磷转化为红磷的热化学方程式为________________________ .
(2)已知 298K 时白磷不完全燃烧的热化学方程式为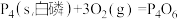 △H =-1638kJ/mol。在某密闭容器中加入 62g 白磷和50.4L氧气(标准状况),控制条件使之恰好完全反应。则所得到的P4O6 与P4O10 的物质的量之比为
△H =-1638kJ/mol。在某密闭容器中加入 62g 白磷和50.4L氧气(标准状况),控制条件使之恰好完全反应。则所得到的P4O6 与P4O10 的物质的量之比为________________ ,反应过程中放出的热为_________________
(3)已知白磷和 PCl3 的分子结构如图所示,现提供以下化学键的键能(KJ/mol):P-P:198, Cl-Cl:243, P-Cl :331 .
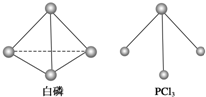
则反应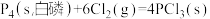 的反应热 △H2 =
的反应热 △H2 =__________ .
(1)已知 298K 时白磷、红磷完全燃烧的热化学方程式分别为
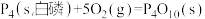 △H1 =-2983.2kJ/mol
△H1 =-2983.2kJ/mol 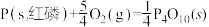 △H2 =-738.5kJ/mol
△H2 =-738.5kJ/mol 则该温度下白磷转化为红磷的热化学方程式为
(2)已知 298K 时白磷不完全燃烧的热化学方程式为
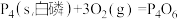 △H =-1638kJ/mol。在某密闭容器中加入 62g 白磷和50.4L氧气(标准状况),控制条件使之恰好完全反应。则所得到的P4O6 与P4O10 的物质的量之比为
△H =-1638kJ/mol。在某密闭容器中加入 62g 白磷和50.4L氧气(标准状况),控制条件使之恰好完全反应。则所得到的P4O6 与P4O10 的物质的量之比为(3)已知白磷和 PCl3 的分子结构如图所示,现提供以下化学键的键能(KJ/mol):P-P:198, Cl-Cl:243, P-Cl :331 .

则反应
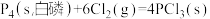 的反应热 △H2 =
的反应热 △H2 =
11-12高二·江西南昌·阶段练习 查看更多[12]
(已下线)2012-2013学年江西省南昌市第二中学高二第一次月考化学试卷(已下线)2014高考名师推荐化学盖斯定律及其应用2016-2017学年江苏省泰州中学高二上月考一化学试卷河南省鹤壁市淇滨高级中学2017-2018学年高二上学期第二次月考化学试题山西省朔州市平鲁区李林中学2018-2019学年高二上学期第一次月考化学试题【校级联考】福建省平和一中、南靖一中等五校2018-2019学年高二上学期第一次联考化学试题四川省遂宁市第二中学2019-2020学年高二上学期期中考试化学试题(已下线)解密08 化学反应与能量(讲义)-【高频考点解密】2021年高考化学二轮复习讲义+分层训练(浙江专版)(已下线)解密08 化学反应与能量(讲义)-【高频考点解密】2021年高考化学二轮复习讲义+分层训练(已下线)专题1 化学反应与能量(章末培优)-2021-2022学年高二化学课后培优练(苏教版2019选择性必修1)黑龙江省宾县第一中学校2021-2022学年高三上学期第一次月考化学试题黑龙江省哈尔滨市依兰县高级中学2021-2022学年高二上学期第一次月考化学试题
更新时间:2019-11-21 16:52:29
|
相似题推荐
填空题
|
适中
(0.65)
【推荐1】(1)丁烯是一种重要的化工原料,可由丁烷催化脱氢制备。回答下列问题:
正丁烷(C4H10)脱氢制1-丁烯(C4H8)的热化学方程式如下:
①C4H10(g)= C4H8(g)+H2(g) ΔH1
已知:②C4H10(g)+ O2(g)= C4H8(g)+H2O(g) ΔH2=−119 kJ·mol−1
O2(g)= C4H8(g)+H2O(g) ΔH2=−119 kJ·mol−1
③H2(g)+ O2(g)= H2O(g) ΔH3=−242kJ·mol−1
O2(g)= H2O(g) ΔH3=−242kJ·mol−1
反应①的ΔH1为________ kJ·mol−1。
(2)检验硫酸铁溶液中是否存在Fe2+的方法是_______________________________ 。
(3)干法制备高铁酸钠的主要反应为2FeSO4+6Na2O2= 2Na2FeO4+2Na2O+2Na2SO4+O2↑
该反应中的还原剂是_____________ ,每生成l mol Na2FeO4转移________ mol电子。
正丁烷(C4H10)脱氢制1-丁烯(C4H8)的热化学方程式如下:
①C4H10(g)= C4H8(g)+H2(g) ΔH1
已知:②C4H10(g)+
 O2(g)= C4H8(g)+H2O(g) ΔH2=−119 kJ·mol−1
O2(g)= C4H8(g)+H2O(g) ΔH2=−119 kJ·mol−1③H2(g)+
 O2(g)= H2O(g) ΔH3=−242kJ·mol−1
O2(g)= H2O(g) ΔH3=−242kJ·mol−1反应①的ΔH1为
(2)检验硫酸铁溶液中是否存在Fe2+的方法是
(3)干法制备高铁酸钠的主要反应为2FeSO4+6Na2O2= 2Na2FeO4+2Na2O+2Na2SO4+O2↑
该反应中的还原剂是
您最近一年使用:0次
填空题
|
适中
(0.65)
名校
解题方法
【推荐2】氮是地球上含量丰富的一种元素,氮及其化合物在工农业生产.生活中有着重要作用。
(1)如图是N2(g)和H2(g)反应生成1molNH3(g)过程中能量的变化示意图,请写出N2和H2反应的热化学方程式:_______ 。加入催化剂E1________ (填“增大”、“减小”或“不变”)。

(2)若已知下列数据:
试根据表中及图中数据计算N—H的键能:_______ kJ·mol−1。
(3)捕碳技术(主要指捕获CO2在降低温室气体排放中具有重要的作用。目前NH3和(NH4)2CO3已经被用作工业捕碳剂,它们与CO2可发生如下反应:
反应Ⅰ:2NH3(l)+H2O(l)+CO2(g)=(NH4)2CO3(aq) ΔH1
反应Ⅱ:NH3(l)+H2O(l)+CO2(g)=NH4HCO3(aq) ΔH2
反应Ⅲ:(NH4)2CO3(aq)+H2O(l)+CO2(g)=2NH4HCO3(aq) ΔH3
请回答下列问题:
ΔH3与ΔH1、ΔH2之间的关系是ΔH3=________ 。
(4)试比较下列两组ΔH的大小(填“>”、“<”或“=”)
①H2(g)+ O2(g)=H2O(g) ΔH1;H2(g)+
O2(g)=H2O(g) ΔH1;H2(g)+ O2(g)=H2O(l) ΔH2;则ΔH1
O2(g)=H2O(l) ΔH2;则ΔH1____ ΔH2。
②S(s)+O2(g)=SO2(g) ΔH3;Ba(OH)2·8H2O(s)+2NH4Cl(s)=BaCl2(s)+10H2O(l)+2NH3(g) ΔH4;则ΔH3_____ ΔH4。
(1)如图是N2(g)和H2(g)反应生成1molNH3(g)过程中能量的变化示意图,请写出N2和H2反应的热化学方程式:

(2)若已知下列数据:
| 化学键 | H—H | N≡N |
| 键能/kJ·mol-1 | 435 | 943 |
(3)捕碳技术(主要指捕获CO2在降低温室气体排放中具有重要的作用。目前NH3和(NH4)2CO3已经被用作工业捕碳剂,它们与CO2可发生如下反应:
反应Ⅰ:2NH3(l)+H2O(l)+CO2(g)=(NH4)2CO3(aq) ΔH1
反应Ⅱ:NH3(l)+H2O(l)+CO2(g)=NH4HCO3(aq) ΔH2
反应Ⅲ:(NH4)2CO3(aq)+H2O(l)+CO2(g)=2NH4HCO3(aq) ΔH3
请回答下列问题:
ΔH3与ΔH1、ΔH2之间的关系是ΔH3=
(4)试比较下列两组ΔH的大小(填“>”、“<”或“=”)
①H2(g)+
 O2(g)=H2O(g) ΔH1;H2(g)+
O2(g)=H2O(g) ΔH1;H2(g)+ O2(g)=H2O(l) ΔH2;则ΔH1
O2(g)=H2O(l) ΔH2;则ΔH1②S(s)+O2(g)=SO2(g) ΔH3;Ba(OH)2·8H2O(s)+2NH4Cl(s)=BaCl2(s)+10H2O(l)+2NH3(g) ΔH4;则ΔH3
您最近一年使用:0次
填空题
|
适中
(0.65)
名校
解题方法
【推荐3】I.按要求完成下列问题:
(1)同温同压下,H2(g)+Cl2(g)=2HCl(g),在光照和点燃条件下的△H(化学计量数相同)分别为△H1、△H2,△H1_______ △H2(填“>”“<”或“=”)。
(2)有机物M经过太阳光光照可转化成N,转化过程如下:
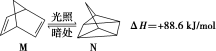
则M、N相比,较稳定的是_______ 。
(3)已知N2(g)+2O2(g)=2NO2(g) △H=+67.7kJ·mol-1
N2H4(g)+O2(g)=N2(g)+2H2O(g) △H=-534kJ·mol-1
则N2H4(g)与NO2(g)完全反应生成N2(g)和H2O(g)的热化学方程式为_______ 。
II.利用如图装置测定中和热的实验步骤如下:

①用量筒量取50mL0.25mol·L-1硫酸倒入小烧杯中,测出硫酸温度;
②用另一量筒量取50mL0.55mol·L-1NaOH溶液,并用另一温度计测出其温度;
③将NaOH溶液倒入小烧杯中,设法使之混合均匀,测出混合液最高温度。
回答下列问题:
(4)从实验装置上看,图中尚缺少的一种玻璃仪器是_______ 。
(5)倒入NaOH溶液的正确操作是_______ (从下列选项中选出)。
A.沿玻璃棒缓慢倒入 B.分三次少量倒入 C.一次迅速倒入
(6)实验数据如表:
近似认为0.55mol·L-1NaOH溶液和0.25mol·L-1硫酸溶液的密度都是1g·cm-3,中和后生成溶液的比热容c=4.18J·g-1·℃-1。则中和热ΔH=_______ (取小数点后一位)。
(1)同温同压下,H2(g)+Cl2(g)=2HCl(g),在光照和点燃条件下的△H(化学计量数相同)分别为△H1、△H2,△H1
(2)有机物M经过太阳光光照可转化成N,转化过程如下:

则M、N相比,较稳定的是
(3)已知N2(g)+2O2(g)=2NO2(g) △H=+67.7kJ·mol-1
N2H4(g)+O2(g)=N2(g)+2H2O(g) △H=-534kJ·mol-1
则N2H4(g)与NO2(g)完全反应生成N2(g)和H2O(g)的热化学方程式为
II.利用如图装置测定中和热的实验步骤如下:

①用量筒量取50mL0.25mol·L-1硫酸倒入小烧杯中,测出硫酸温度;
②用另一量筒量取50mL0.55mol·L-1NaOH溶液,并用另一温度计测出其温度;
③将NaOH溶液倒入小烧杯中,设法使之混合均匀,测出混合液最高温度。
回答下列问题:
(4)从实验装置上看,图中尚缺少的一种玻璃仪器是
(5)倒入NaOH溶液的正确操作是
A.沿玻璃棒缓慢倒入 B.分三次少量倒入 C.一次迅速倒入
(6)实验数据如表:
| 实验次数 | 起始温度t1℃ | 终止温度t2/℃ | ||
| H2SO4 | NaOH | 平均值 | ||
| 1 | 26.2 | 26.0 | 26.1 | 29.5 |
| 2 | 27.0 | 27.4 | 27.2 | 32.3 |
| 3 | 25.9 | 25.9 | 25.9 | 29.2 |
| 4 | 26.4 | 26.2 | 26.3 | 29.8 |
近似认为0.55mol·L-1NaOH溶液和0.25mol·L-1硫酸溶液的密度都是1g·cm-3,中和后生成溶液的比热容c=4.18J·g-1·℃-1。则中和热ΔH=
您最近一年使用:0次
填空题
|
适中
(0.65)
名校
解题方法
【推荐1】2013年12月2日,“嫦娥三号”探测器由长征三号乙运载火箭从西昌卫星发射中心发射,首次实现月球软着陆和月面巡视勘察。“长征”系列火箭用偏二甲肼(C2H8N2)作燃料,四氧化二氮作氧化剂,生成氮气和二氧化碳气体。
(1)写出反应的化学方程式:_____________________________________________ 。
(2)该反应是________ (填“放热”或“吸热”)反应,反应物的总能量________ (填“大于”“小于”或“等于”)生成物的总能量,断开化学键________ 的总能量小于形成化学键________ 的总能量(填“吸收”或“放出”)。
(3)如果一个反应可以分几步进行,则各分步反应的反应热之和与该反应一步完成时的反应热是相同的,这个规律称为盖斯定律。据此回答下列问题。
北京奥运会“祥云”火炬燃料是丙烷(C3H8),亚特兰大奥运会火炬燃料是丙烯(C3H6)。丙烷脱氢可得丙烯。
已知:C3H8(g)―→CH4(g)+HC≡CH(g)+H2(g) ΔH1=+156.6 kJ·mol-1
CH3CH=CH2(g)―→CH4(g)+HC≡CH(g) ΔH2=+32.4 kJ·mol-1
则相同条件下,丙烷脱氢得丙烯的热化学方程式为________________________________ 。
(2)已知:Na2CO3·10H2O(s)===Na2CO3(s)+10H2O(g)ΔH1=+532.36 kJ·mol-1
Na2CO3·10H2O(s)===Na2CO3·H2O(s)+9H2O(g) ΔH2=+473.63 kJ·mol-1
写出Na2CO3·H2O脱水反应的热化学方程式____________________ 。
(1)写出反应的化学方程式:
(2)该反应是
(3)如果一个反应可以分几步进行,则各分步反应的反应热之和与该反应一步完成时的反应热是相同的,这个规律称为盖斯定律。据此回答下列问题。
北京奥运会“祥云”火炬燃料是丙烷(C3H8),亚特兰大奥运会火炬燃料是丙烯(C3H6)。丙烷脱氢可得丙烯。
已知:C3H8(g)―→CH4(g)+HC≡CH(g)+H2(g) ΔH1=+156.6 kJ·mol-1
CH3CH=CH2(g)―→CH4(g)+HC≡CH(g) ΔH2=+32.4 kJ·mol-1
则相同条件下,丙烷脱氢得丙烯的热化学方程式为
(2)已知:Na2CO3·10H2O(s)===Na2CO3(s)+10H2O(g)ΔH1=+532.36 kJ·mol-1
Na2CO3·10H2O(s)===Na2CO3·H2O(s)+9H2O(g) ΔH2=+473.63 kJ·mol-1
写出Na2CO3·H2O脱水反应的热化学方程式
您最近一年使用:0次
填空题
|
适中
(0.65)
【推荐2】请根据要求回答问题:
(1)图1所示是1molNO2(g)和1molCO(g)反应生成CO2(g)和NO(g)过程中的能量变化示意图,已知E1=134kJ•mol-1、E2=368kJ•mol-1。若在反应体系中加入催化剂,反应速率增大,E1_____ (填“增大”“减小”或“不变”,后同),△H_____ 。请写出NO2(g)和CO(g)反应生成CO2(g)和NO(g)的热化学方程式:_____ 。

(2)已知:①CH3OH(g)+H2O(g)=CO2(g)+3H2(g) △H=+49.0kJ•mol-1
②CH3OH(g)+ O2(g)=CO2(g)+2H2(g) △H=-192.9kJ•mol-1
O2(g)=CO2(g)+2H2(g) △H=-192.9kJ•mol-1
③H2O(g)=H2O(l) △H=-44kJ•mol-1
则甲醇蒸气燃烧生成液态水的热化学方程式为_____ 。
(3)如表所示是部分化学键的键能:
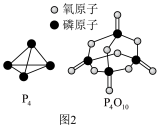
已知白磷的燃烧热为dkJ•mol-1,白磷及其完全燃烧的产物的结构如图2所示,则表中x=______ (用含a、b、c、d的代数式表示)。
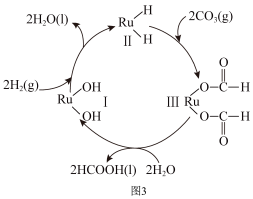
(4)钌及其化合物在合成工业上有广泛用途,如图3所示是用钌(Ru)基催化剂催化合成甲酸的过程示意图。每生成92g液态HCOOH放出62.4kJ的热量。根据图3写出生成1molHCOOH(l)的反应的热化学方程式:______ 。
(1)图1所示是1molNO2(g)和1molCO(g)反应生成CO2(g)和NO(g)过程中的能量变化示意图,已知E1=134kJ•mol-1、E2=368kJ•mol-1。若在反应体系中加入催化剂,反应速率增大,E1

(2)已知:①CH3OH(g)+H2O(g)=CO2(g)+3H2(g) △H=+49.0kJ•mol-1
②CH3OH(g)+
 O2(g)=CO2(g)+2H2(g) △H=-192.9kJ•mol-1
O2(g)=CO2(g)+2H2(g) △H=-192.9kJ•mol-1③H2O(g)=H2O(l) △H=-44kJ•mol-1
则甲醇蒸气燃烧生成液态水的热化学方程式为
(3)如表所示是部分化学键的键能:
| 化学键 | P-P | P-O | O=O | P=O |
| 键能/(kJ•mol-1) | a | b | c | x |

(4)钌及其化合物在合成工业上有广泛用途,如图3所示是用钌(Ru)基催化剂催化合成甲酸的过程示意图。每生成92g液态HCOOH放出62.4kJ的热量。根据图3写出生成1molHCOOH(l)的反应的热化学方程式:

您最近一年使用:0次
填空题
|
适中
(0.65)
真题
名校
【推荐3】Q、R、T、W四种短周期元素在元素周期表中的位置如图所示,其中T所处的周期序数与主族序数相等,请回答下列问题:
(1)T的原子结构示意图为_______ 。
(2)元素的非金属性为(原子的得电子能力):Q_______ W(填“强于”或“弱于”)。
(3)W的单质与其最高价氧化物的水化物浓溶液共热能发生反应,生成两种物质,其中一种是气体,反应的化学方程式为_______ 。
(4)原子序数比R多1的元素的一种氢化物A能分解为其另一种氢化物B,写出A的电子式_____ 。
(5)R有多种氧化物,其中甲的相对分子质量最小。在一定条件下,2L的甲气体与0.5L的氧气相混合,若该混合气体被足量的NaOH溶液完全吸收后没有气体残留,所生成的R的含氧酸盐的化学式是___ 。
(6)在298K下,Q、T的单质各1mol完全燃烧,分别放出热量aKJ和bKJ。又知一定条件下,T的单质能将Q从它的最高价氧化物中置换出来,若此置换反应生成3molQ的单质,则该反应在298K下的△H =_______ kJ/mol(注:题中所设单质均为最稳定单质)
Q | R | ||
T | W |
(1)T的原子结构示意图为
(2)元素的非金属性为(原子的得电子能力):Q
(3)W的单质与其最高价氧化物的水化物浓溶液共热能发生反应,生成两种物质,其中一种是气体,反应的化学方程式为
(4)原子序数比R多1的元素的一种氢化物A能分解为其另一种氢化物B,写出A的电子式
(5)R有多种氧化物,其中甲的相对分子质量最小。在一定条件下,2L的甲气体与0.5L的氧气相混合,若该混合气体被足量的NaOH溶液完全吸收后没有气体残留,所生成的R的含氧酸盐的化学式是
(6)在298K下,Q、T的单质各1mol完全燃烧,分别放出热量aKJ和bKJ。又知一定条件下,T的单质能将Q从它的最高价氧化物中置换出来,若此置换反应生成3molQ的单质,则该反应在298K下的△H =
您最近一年使用:0次
填空题
|
适中
(0.65)
【推荐1】化学反应都有能量变化,吸热或放热是化学反应中能量变化的主要形式之一。
(1)反应A(g)+B(g)=C(g)+D(g),反应过程中能量变化如下图所示,回答下列问题:
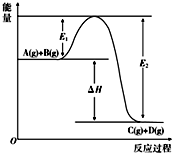
①化学反应中产生能量变化的本质原因是______________ ;
②该反应是_____ 反应(填“吸热或放热”)、ΔH=__________ (用E1、E2表示);
③加入催化剂对该反应的ΔH是否有影响?___________ 。
(2)已知:一定条件下,拆开1molH-H键、1molCl-Cl键、1molH-Cl键需要的能量分别是436kJ、243kJ、432kJ,则反应H2(g)+Cl2(g)=2HCl(g) 的ΔH=_____ 。
(3)已知:2CH3OH(l)+2O2(g)=2CO(g)+4H2O(g) ΔH1=-a kJ‧mol﹣1
2CO(g)+O2(g)=2CO2(g) ΔH2=-b kJ‧mol﹣1
H2O(g)=H2O(l) ΔH3=-c kJ‧mol﹣1
则表示CH3OH(l)燃烧热的热化学方程式为_________________________________ 。
(1)反应A(g)+B(g)=C(g)+D(g),反应过程中能量变化如下图所示,回答下列问题:

①化学反应中产生能量变化的本质原因是
②该反应是
③加入催化剂对该反应的ΔH是否有影响?
(2)已知:一定条件下,拆开1molH-H键、1molCl-Cl键、1molH-Cl键需要的能量分别是436kJ、243kJ、432kJ,则反应H2(g)+Cl2(g)=2HCl(g) 的ΔH=
(3)已知:2CH3OH(l)+2O2(g)=2CO(g)+4H2O(g) ΔH1=-a kJ‧mol﹣1
2CO(g)+O2(g)=2CO2(g) ΔH2=-b kJ‧mol﹣1
H2O(g)=H2O(l) ΔH3=-c kJ‧mol﹣1
则表示CH3OH(l)燃烧热的热化学方程式为
您最近一年使用:0次
填空题
|
适中
(0.65)
名校
解题方法
【推荐2】根据下列已知条件,写出相应的热化学方程式:
(1)2.0g C2H2(g)完全燃烧生成CO2和液态水,放出99.6kJ的热量,写出C2H2的燃烧热的热化学方程式:____________________________________________________________________ ;
(2)1mol N2(g)与适量O2(g)起反应生成NO2(g),吸收68kJ的热量,写出该反应的热化学方程式:__________________________________________________________________________ ;
(3)已知拆开1mol H-H键,1mol N-H键,1mol N≡N键分别需要的能量是436kJ、391kJ、947kJ,则N2与H2反应生成NH3的热化学方程式为:________________________________________________________________________________ ;
(4)已知下列热化学方程式:
① Fe2O3(s)+3CO(g)=2Fe(s)+3CO2(g); △H=-25kJ/mol
② 3Fe2O3(s)+CO(g)=2Fe3O4(s)+CO2(g);△H=-47kJ/mol
③ Fe3O4(s)+CO(g)=3FeO(s)+CO2(g); △H=+19kJ/mol
写出FeO(s)与CO反应生成Fe(s)和CO2的热化学方程式:_______________________________________________________________________________ ;
(1)2.0g C2H2(g)完全燃烧生成CO2和液态水,放出99.6kJ的热量,写出C2H2的燃烧热的热化学方程式:
(2)1mol N2(g)与适量O2(g)起反应生成NO2(g),吸收68kJ的热量,写出该反应的热化学方程式:
(3)已知拆开1mol H-H键,1mol N-H键,1mol N≡N键分别需要的能量是436kJ、391kJ、947kJ,则N2与H2反应生成NH3的热化学方程式为:
(4)已知下列热化学方程式:
① Fe2O3(s)+3CO(g)=2Fe(s)+3CO2(g); △H=-25kJ/mol
② 3Fe2O3(s)+CO(g)=2Fe3O4(s)+CO2(g);△H=-47kJ/mol
③ Fe3O4(s)+CO(g)=3FeO(s)+CO2(g); △H=+19kJ/mol
写出FeO(s)与CO反应生成Fe(s)和CO2的热化学方程式:
您最近一年使用:0次
填空题
|
适中
(0.65)
名校
【推荐1】完成下列问题
(1)天然气是一种清洁能源,主要成分为甲烷(CH4),已知在101kPa、273K时,1g甲烷燃烧生成 气体和液态水,放出55.6kJ的热量,则甲烷燃烧热的热化学方程式为
气体和液态水,放出55.6kJ的热量,则甲烷燃烧热的热化学方程式为_______ 。
(2)高温下,Al(s)与FeO(s)发生铝热反应的方程式为_______ ,每生成8.4gFe(s)放出的热量为_______ kJ(保留一位小数)。
已知: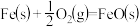
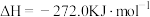
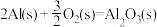
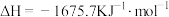
(1)天然气是一种清洁能源,主要成分为甲烷(CH4),已知在101kPa、273K时,1g甲烷燃烧生成
 气体和液态水,放出55.6kJ的热量,则甲烷燃烧热的热化学方程式为
气体和液态水,放出55.6kJ的热量,则甲烷燃烧热的热化学方程式为(2)高温下,Al(s)与FeO(s)发生铝热反应的方程式为
已知:
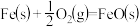
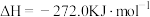
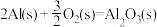
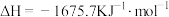
您最近一年使用:0次
填空题
|
适中
(0.65)
解题方法
【推荐2】合成气的主要成分是一氧化碳和氢气,可用于合成甲醇、二甲醚等清洁燃料。从天然气获得合成气过程中可能发生的反应有:
①CH4(g)+H2O(g) CO(g)+3H2(g) △H1=+206.1 kJ/mol
CO(g)+3H2(g) △H1=+206.1 kJ/mol
②CH4(g)+CO2(g) 2CO(g)+2H2(g) △H2=+247.3 kJ/mol
2CO(g)+2H2(g) △H2=+247.3 kJ/mol
③CO(g)+H2O(g) CO2(g)+H2(g) △H3
CO2(g)+H2(g) △H3
请回答下列问题:
(1)在一密闭容器中进行反应①,测得CH4的物质的量浓度随反应时间的变化如图所示:
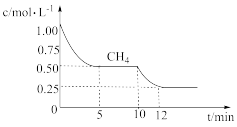
则反应前5min的平均反应速率v(H2)=______ 。10min时,改变的外界条件可能是_______ (填代号)。
A.压缩体积 B.增大体积 C.升高温度 D.加入催化剂
(2)如图所示,在甲、乙两容器中分别充入等物质的量的CH4和CO2,使甲、乙两容器初始容积相等。在相同温度下发生反应②,并维持反应过程中温度不变。
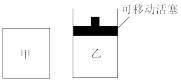
已知甲容器中CH4的转化率随时间变化的图象如图所示,请在图中画出乙容器中CH4的转化率随时间变化的图象_______ 。

(3)反应③中△H3=________ 。800℃时,反应③的化学平衡常数K=1.0,某时刻测得该温度下的密闭容器中各物质的物质的量见表:
此时反应③中正、逆反应速率的关系式是________ (填代号)。
a.v(正)>v(逆) b.v(正)<v(逆) c.v(正)=v(逆) d.无法判断
(4)800K时向下列三个密闭容器中各充入2 mol H2、1 mol CO,发生反应:2H2(g)+CO(g)⇌CH3OH(g) △H<0,若三容器初始体积相同,甲容器在反应过程中保持压强不变,乙容器保持体积不变,丙容器维持绝热,三容器各自建立化学平衡。
甲 乙.
乙.  丙.
丙.
①达到平衡时,平衡常数K(甲)________ K(乙);K(乙)________ K(丙)(填“>”、“<”或“=”)。
②达到平衡时H2的浓度c(H2)(甲)________ c(H2)(乙);c(H2)(乙)________ c(H2)(丙)(填“>”、“<”或“=”)。
(5)在以甲醇为燃料的电池中,电解质溶液为碱性,负极的电极反应式为_________ ,甲醇应用于燃料电池比甲醇直接用作燃料燃烧的优点是_______ (回答一条即可)。
①CH4(g)+H2O(g)
 CO(g)+3H2(g) △H1=+206.1 kJ/mol
CO(g)+3H2(g) △H1=+206.1 kJ/mol②CH4(g)+CO2(g)
 2CO(g)+2H2(g) △H2=+247.3 kJ/mol
2CO(g)+2H2(g) △H2=+247.3 kJ/mol③CO(g)+H2O(g)
 CO2(g)+H2(g) △H3
CO2(g)+H2(g) △H3请回答下列问题:
(1)在一密闭容器中进行反应①,测得CH4的物质的量浓度随反应时间的变化如图所示:

则反应前5min的平均反应速率v(H2)=
A.压缩体积 B.增大体积 C.升高温度 D.加入催化剂
(2)如图所示,在甲、乙两容器中分别充入等物质的量的CH4和CO2,使甲、乙两容器初始容积相等。在相同温度下发生反应②,并维持反应过程中温度不变。

已知甲容器中CH4的转化率随时间变化的图象如图所示,请在图中画出乙容器中CH4的转化率随时间变化的图象

(3)反应③中△H3=
| CO | H2O | CO2 | H2 |
| 0.5mol | 8.5mol | 2.0mol | 2.0mol |
此时反应③中正、逆反应速率的关系式是
a.v(正)>v(逆) b.v(正)<v(逆) c.v(正)=v(逆) d.无法判断
(4)800K时向下列三个密闭容器中各充入2 mol H2、1 mol CO,发生反应:2H2(g)+CO(g)⇌CH3OH(g) △H<0,若三容器初始体积相同,甲容器在反应过程中保持压强不变,乙容器保持体积不变,丙容器维持绝热,三容器各自建立化学平衡。
甲
 乙.
乙.  丙.
丙.
①达到平衡时,平衡常数K(甲)
②达到平衡时H2的浓度c(H2)(甲)
(5)在以甲醇为燃料的电池中,电解质溶液为碱性,负极的电极反应式为
您最近一年使用:0次
填空题
|
适中
(0.65)
【推荐3】合成气(CO+H2)是一种重要的化工原料,在化工生产中具有十分广泛的用途。 可以生产被称为21世纪的新型燃料——甲醇、二甲醚(CH3OCH3)等物质。其工艺流程如下:

(1)写出用合成气生产二甲醚的化学方程式______________________________ 。
(2)尾气循环中涉及到以下反应:CH4(g)+H2O(g) CO(g)+3H2(g),请写出某温度下该反应的平衡常数表达式
CO(g)+3H2(g),请写出某温度下该反应的平衡常数表达式_______________________ 。
(3)工业上一般采用下列两种反应合成甲醇:
反应Ⅰ: CO(g)+2H2(g) CH3OH(g)
CH3OH(g)
反应Ⅱ:CO2(g)+3H2(g) CH3OH(g)+H2O(g)
CH3OH(g)+H2O(g)
①下表所列数据是反应在不同温度下的化学平衡常数(K)。
由表中数据判断
_____ 0(填“>”、“=”、“<”)。
②已和:
CH3OH(g)+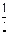 O2(g)= CO2(g)+2H2(g)
O2(g)= CO2(g)+2H2(g)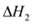 =-192.9kJ·mol-1
=-192.9kJ·mol-1
H2(g)+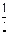 O2(g)= H2O(g)
O2(g)= H2O(g)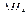 =-241.8kJ·mol-1
=-241.8kJ·mol-1
则 =
=____________ 。
(4)以二甲醚、空气、氢氧化钾溶液为原料,铂为电极构成燃料电池。写出该电池负极的电极反应式_______________________________________________________ 。

(1)写出用合成气生产二甲醚的化学方程式
(2)尾气循环中涉及到以下反应:CH4(g)+H2O(g)
 CO(g)+3H2(g),请写出某温度下该反应的平衡常数表达式
CO(g)+3H2(g),请写出某温度下该反应的平衡常数表达式(3)工业上一般采用下列两种反应合成甲醇:
反应Ⅰ: CO(g)+2H2(g)
 CH3OH(g)
CH3OH(g)
反应Ⅱ:CO2(g)+3H2(g)
 CH3OH(g)+H2O(g)
CH3OH(g)+H2O(g)
①下表所列数据是反应在不同温度下的化学平衡常数(K)。
| 温度 | 250 | 300 | 350 |
| K | 2.041 | 0.270 | 0.012 |
由表中数据判断

②已和:
CH3OH(g)+
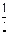 O2(g)= CO2(g)+2H2(g)
O2(g)= CO2(g)+2H2(g)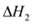 =-192.9kJ·mol-1
=-192.9kJ·mol-1H2(g)+
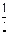 O2(g)= H2O(g)
O2(g)= H2O(g)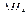 =-241.8kJ·mol-1
=-241.8kJ·mol-1则
 =
=(4)以二甲醚、空气、氢氧化钾溶液为原料,铂为电极构成燃料电池。写出该电池负极的电极反应式
您最近一年使用:0次

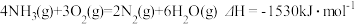 ,
,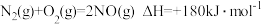 ,写出
,写出 还原
还原 的热化学方程式:
的热化学方程式:

