CH3OH是一种无色有刺激性气味的液体,在生产生活中有重要用途,同时也是一种重要的化工原料。
(1)已知CH3OH(g)+ O2(g) ⇌CO2(g)+2H2(g)的能量变化如图所示,下列说法正确的是
O2(g) ⇌CO2(g)+2H2(g)的能量变化如图所示,下列说法正确的是________ (填字母)。
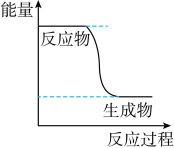
a.CH3OH转变成H2的过程是一个吸收能量的过程
b.H2的生成速率与CH3OH的消耗速率之比为1∶2
c.化学变化不仅有新物质生成,同时也一定有能量变化
d.1 mol H—O键断裂的同时2 mol C=O键断裂,则反应达最大限度
(2)某温度下,将5 mol CH3OH和2 mol O2充入2 L的密闭容器中,经过4 min反应达到平衡,测得c(O2)=0.2 mol·L-1,4 min内平均反应速率v(H2)=________ ,则CH3OH的转化率为_______________ 。
(3)CH3OH燃料电池是目前开发最成功的燃料电池之一,这种燃料电池由甲醇、空气(氧气)、KOH(电解质溶液)构成。则下列说法正确的是________ (填序号)。
①电池放电时通入空气的电极为负极
②电池放电时,电解质溶液的碱性逐渐减弱
③电池放电时每消耗6.4 g CH3OH转移1.2 mol电子
(4)写出CH3OH燃料电池在酸性条件下负极的反应式______________
(1)已知CH3OH(g)+
 O2(g) ⇌CO2(g)+2H2(g)的能量变化如图所示,下列说法正确的是
O2(g) ⇌CO2(g)+2H2(g)的能量变化如图所示,下列说法正确的是
a.CH3OH转变成H2的过程是一个吸收能量的过程
b.H2的生成速率与CH3OH的消耗速率之比为1∶2
c.化学变化不仅有新物质生成,同时也一定有能量变化
d.1 mol H—O键断裂的同时2 mol C=O键断裂,则反应达最大限度
(2)某温度下,将5 mol CH3OH和2 mol O2充入2 L的密闭容器中,经过4 min反应达到平衡,测得c(O2)=0.2 mol·L-1,4 min内平均反应速率v(H2)=
(3)CH3OH燃料电池是目前开发最成功的燃料电池之一,这种燃料电池由甲醇、空气(氧气)、KOH(电解质溶液)构成。则下列说法正确的是
①电池放电时通入空气的电极为负极
②电池放电时,电解质溶液的碱性逐渐减弱
③电池放电时每消耗6.4 g CH3OH转移1.2 mol电子
(4)写出CH3OH燃料电池在酸性条件下负极的反应式
更新时间:2019-12-11 18:15:42
|
相似题推荐
解答题-原理综合题
|
适中
(0.65)
解题方法
【推荐1】以CO2和H2为原料合成甲醇(CH3OH)对减少碳排放具有重要意义。CO2加氢制备甲醇的路线如下:
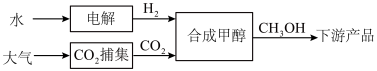
(1)乙醇胺(HOCH2CH2NH2)可用作CO2捕集剂。乙醇胺溶液能够吸收和释放CO2的原因是_______ 。
(2)氢气和二氧化碳在Cu/ZrO2催化剂作用下,在180-280℃温度条件下合成甲醇。该反应为放热反应。催化过程可解释为“吸附-活化-解离”的过程。催化反应机理如题图1所示。
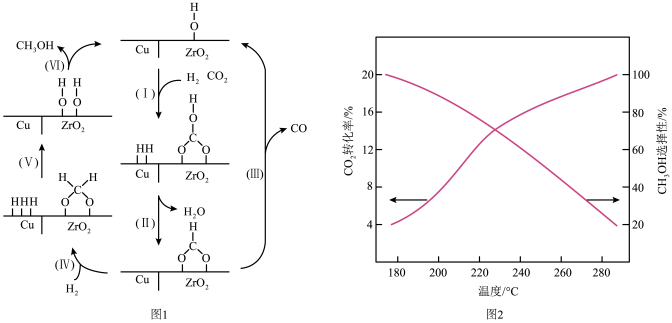
①合成甲醇的副反应是_______ 。
②根据元素电负性的变化规律,题图1中步骤(Ⅰ)可描述为_______ 。
③CO2的转化率和CH3OH的选择性随反应温度的变化如题图2所示。实验测得反应过程中CH3OH产率随温度升高先增大后减小,其原因可能是_______ 。
(3)甲醇作为一种高能量密度的能源载体,具有广阔的发展前景。
燃料的能量密度=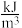
①甲醇作为燃料电池的燃料。某甲醇直接燃料单电池的部分结构如题图3所示。该电池的负极反应式为_______ 。
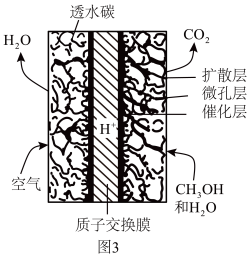
②甲醇催化重整制氢。在一定温度和催化剂作用下,车载甲醇可直接转变为氢气,从而为氢氧燃料电池提供氢源。已知氢气和甲醇的热值分别为143 kJ/g和23 kJ/g,与车载氢气供能模式相比,车载甲醇供能模式的优势是_______ 。

(1)乙醇胺(HOCH2CH2NH2)可用作CO2捕集剂。乙醇胺溶液能够吸收和释放CO2的原因是
(2)氢气和二氧化碳在Cu/ZrO2催化剂作用下,在180-280℃温度条件下合成甲醇。该反应为放热反应。催化过程可解释为“吸附-活化-解离”的过程。催化反应机理如题图1所示。

①合成甲醇的副反应是
②根据元素电负性的变化规律,题图1中步骤(Ⅰ)可描述为
③CO2的转化率和CH3OH的选择性随反应温度的变化如题图2所示。实验测得反应过程中CH3OH产率随温度升高先增大后减小,其原因可能是
(3)甲醇作为一种高能量密度的能源载体,具有广阔的发展前景。
燃料的能量密度=
①甲醇作为燃料电池的燃料。某甲醇直接燃料单电池的部分结构如题图3所示。该电池的负极反应式为

②甲醇催化重整制氢。在一定温度和催化剂作用下,车载甲醇可直接转变为氢气,从而为氢氧燃料电池提供氢源。已知氢气和甲醇的热值分别为143 kJ/g和23 kJ/g,与车载氢气供能模式相比,车载甲醇供能模式的优势是
您最近一年使用:0次
解答题-实验探究题
|
适中
(0.65)
名校
解题方法
【推荐2】某实验小组设计了下图所示的5组实验,探究化学能与热能的转化。___________ ,反应的化学方程式是___________ 。
(2)实验②中反应的能量变化可用下图中的_______ (填序号A或B)表示_______ (填序号)
(4)从微观角度分析实验⑤化学反应中能量变化的原因:___________ 、___________ (填“吸收”或“释放”)。氢气与氧气反应生成1mol水蒸气时,释放___________ kJ能量。
(5)当前,很多地区倡导用天然气替代煤作为家用燃料,从尽可能多的角度分析其原因是___________ 。已知:

(2)实验②中反应的能量变化可用下图中的

(4)从微观角度分析实验⑤化学反应中能量变化的原因:

(5)当前,很多地区倡导用天然气替代煤作为家用燃料,从尽可能多的角度分析其原因是
| 燃料 | 燃烧释放的能量(每1千克) |
| 天然气 | 55812kJ |
| 煤 | 20908kJ |
您最近一年使用:0次
解答题-原理综合题
|
适中
(0.65)
名校
【推荐3】合成氨技术的创立开辟了人工固氮的重要途径。回答下列问题:
(1)德国化学家F. Haber从1902年开始研究 和
和 直接合成
直接合成 。在
。在 、250℃时,将1
、250℃时,将1
 和1
和1
 加入aL刚性容器中充分反应,测得
加入aL刚性容器中充分反应,测得 体积分数为0.04;其他条件不变,温度升高至450℃,测得
体积分数为0.04;其他条件不变,温度升高至450℃,测得 体积分数为0.025,则可判断合成氨反应为
体积分数为0.025,则可判断合成氨反应为_______ (填“吸热”或“放热”)反应。
(2)在 250℃时,将2
250℃时,将2
 和2
和2
 加入aL密闭容器中充分反应,
加入aL密闭容器中充分反应, 平衡转化率可能为_______(填字母)。
平衡转化率可能为_______(填字母)。
(3)我国科学家结合实验与计算机模拟结果,研究了在铁掺杂W18049纳米反应器催化剂表面上实现常温低电位合成氨,获得较高的氨产量和法拉第效率。反应历程如图所示,其中吸附在催化剂表面的物种用*标注。
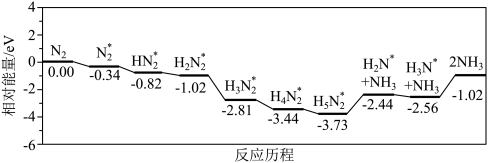
需要吸收能量最大的能垒(活化能)E=_______  ,该步骤的化学方程式为
,该步骤的化学方程式为_______ 。
(4)T℃时,在恒温恒容的密闭条件下发生反应 ,反应过程中各物质浓度的变化曲线如图所示。
,反应过程中各物质浓度的变化曲线如图所示。

①表示 浓度变化的曲线是
浓度变化的曲线是_______ (填“A”、“B”或“C”)。
②在0~25min内 的平均反应速率为
的平均反应速率为_______ 。在该条件下反应的平衡常数为_______ (保留两位有效数字)。
(1)德国化学家F. Haber从1902年开始研究
 和
和 直接合成
直接合成 。在
。在 、250℃时,将1
、250℃时,将1
 和1
和1
 加入aL刚性容器中充分反应,测得
加入aL刚性容器中充分反应,测得 体积分数为0.04;其他条件不变,温度升高至450℃,测得
体积分数为0.04;其他条件不变,温度升高至450℃,测得 体积分数为0.025,则可判断合成氨反应为
体积分数为0.025,则可判断合成氨反应为(2)在
 250℃时,将2
250℃时,将2
 和2
和2
 加入aL密闭容器中充分反应,
加入aL密闭容器中充分反应, 平衡转化率可能为_______(填字母)。
平衡转化率可能为_______(填字母)。A.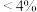 | B.11.5% | C.4%~11.5% | D.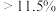 |
(3)我国科学家结合实验与计算机模拟结果,研究了在铁掺杂W18049纳米反应器催化剂表面上实现常温低电位合成氨,获得较高的氨产量和法拉第效率。反应历程如图所示,其中吸附在催化剂表面的物种用*标注。

需要吸收能量最大的能垒(活化能)E=
 ,该步骤的化学方程式为
,该步骤的化学方程式为(4)T℃时,在恒温恒容的密闭条件下发生反应
 ,反应过程中各物质浓度的变化曲线如图所示。
,反应过程中各物质浓度的变化曲线如图所示。
①表示
 浓度变化的曲线是
浓度变化的曲线是②在0~25min内
 的平均反应速率为
的平均反应速率为
您最近一年使用:0次
解答题-原理综合题
|
适中
(0.65)
名校
【推荐1】I.将气体A、B置于固定容积为2L的密闭容器中,发生如下反应:3A(g)+B(g) 2C(g)+2D(g),反应进行到10s末,达到平衡,测得A的物质的量为1.8mol,B的物质的量为0.6mol,C的物质的量为0.8mol。
2C(g)+2D(g),反应进行到10s末,达到平衡,测得A的物质的量为1.8mol,B的物质的量为0.6mol,C的物质的量为0.8mol。
(1)用C表示10s内反应的平均反应速率为___________ 。
(2)反应前A的物质的量浓度是___________ 。
(3)10s末,生成物D的浓度为___________ 。
(4)反应过程中容器内气体的平均相对分子质量变化情况是___________ (填“增大”、“减小”或“不变”,下同),气体的密度变化情况是___________ 。
(5)平衡后,若改变下列条件,生成D的速率如何变化(填“增大”、“减小”或“不变”):
①降低温度___________ ;
②恒容下充入氖气___________ 。
II.某化学反应:3A(g) 2B(g)+D(g)在四种不同条件下进行,B、D的起始浓度为0,反应物A的浓度c随时间t的变化情况如表:
2B(g)+D(g)在四种不同条件下进行,B、D的起始浓度为0,反应物A的浓度c随时间t的变化情况如表:
根据上述数据,完成下列填空:
(1)c2=___________ mol·L-1。
(2)在实验1和2中,有一个实验使用了催化剂,根据表中数据判断,使用催化剂的实验为___________ (填实验序号),理由是___________ 。
 2C(g)+2D(g),反应进行到10s末,达到平衡,测得A的物质的量为1.8mol,B的物质的量为0.6mol,C的物质的量为0.8mol。
2C(g)+2D(g),反应进行到10s末,达到平衡,测得A的物质的量为1.8mol,B的物质的量为0.6mol,C的物质的量为0.8mol。(1)用C表示10s内反应的平均反应速率为
(2)反应前A的物质的量浓度是
(3)10s末,生成物D的浓度为
(4)反应过程中容器内气体的平均相对分子质量变化情况是
(5)平衡后,若改变下列条件,生成D的速率如何变化(填“增大”、“减小”或“不变”):
①降低温度
②恒容下充入氖气
II.某化学反应:3A(g)
 2B(g)+D(g)在四种不同条件下进行,B、D的起始浓度为0,反应物A的浓度c随时间t的变化情况如表:
2B(g)+D(g)在四种不同条件下进行,B、D的起始浓度为0,反应物A的浓度c随时间t的变化情况如表:| 实验序号 | t/min C/mol·L-1 | 0 | 10 | 20 | 30 | 40 | 50 | 60 |
| 1 | 800℃ | 1.0 | 0.80 | 0.67 | 0.57 | 0.50 | 0.50 | 0.50 |
| 2 | 800℃ | C2 | 0.65 | 0.50 | 0.50 | 0.50 | 0.50 | 0.50 |
| 3 | 820℃ | 1.0 | 0.40 | 0.25 | 0.20 | 0.20 | 0.20 | 0.20 |
根据上述数据,完成下列填空:
(1)c2=
(2)在实验1和2中,有一个实验使用了催化剂,根据表中数据判断,使用催化剂的实验为
您最近一年使用:0次
【推荐2】氢能源是公认的环境友好型二次能源,对其开发和利用是科研领域研究的热点。
回答下列问题:
(1)甲烷与水蒸气的催化反应可制备 和
和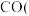 合成气
合成气 。
。
已知:Ⅰ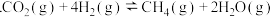
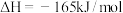 ;
;
Ⅱ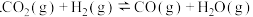
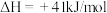 。
。
①制备合成气反应的热化学方程式为_________ 。
②制备合成气时,会因副反应
 而使合成气产率降低。有利于降低副反应的反应条件为
而使合成气产率降低。有利于降低副反应的反应条件为________  任写一点
任写一点 ;有利于提高制备合成气反应选择性的关键因素为
;有利于提高制备合成气反应选择性的关键因素为_____ 。
③一定温度下,向5L恒容密闭容器中充入 和
和 ,只发生反应Ⅱ。10min达到平衡时测得CO的体积分数为
,只发生反应Ⅱ。10min达到平衡时测得CO的体积分数为 。则0—10min内,用
。则0—10min内,用 浓度变化表示的平均反应速率
浓度变化表示的平均反应速率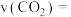
______ ;下列事实能说明该反应达到平衡状态的是____  填选项字母
填选项字母 。
。
A 混合气体密度不再改变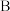 混合气体的平均相对分子质量不再改变
混合气体的平均相对分子质量不再改变
C 容器内气体压强不再改变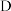 断裂
断裂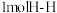 键同时断裂
键同时断裂 键
键
(2)部分合金可用于氢能源的存储。一定温度下,某储氢合金 的储氢效率
的储氢效率 固相中氢原子与金属原子的数目之比
固相中氢原子与金属原子的数目之比 与温度
与温度 和氢气的平衡压强
和氢气的平衡压强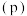 的关系如图所示。在OA段,氢溶解于M中形成固溶体
的关系如图所示。在OA段,氢溶解于M中形成固溶体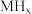 ;在AB段,发生氢化反应的化学方程式为
;在AB段,发生氢化反应的化学方程式为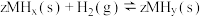 。
。

① 时,该反应的平衡常数
时,该反应的平衡常数
__________  用含
用含 的代数式表示,
的代数式表示, 为用分压表示的平衡常数
为用分压表示的平衡常数 。
。
②
_________________  填“
填“ ”“
”“ ”或“
”或“ ”
”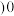 。
。
③当反应处于图中a点时,保持温度不变,向恒容体系中通入少量氢气,达到平衡后反应可能处于图中的______________ 点 填“b”“c”或“d”
填“b”“c”或“d” 。
。
(3)氢能源在电化学领域的一种存储和应用的原理为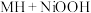

 ,充电时的阳极反应式为
,充电时的阳极反应式为_____________ 。
回答下列问题:
(1)甲烷与水蒸气的催化反应可制备
 和
和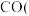 合成气
合成气 。
。已知:Ⅰ
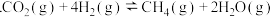
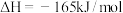 ;
;Ⅱ
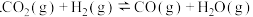
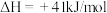 。
。①制备合成气反应的热化学方程式为
②制备合成气时,会因副反应

 而使合成气产率降低。有利于降低副反应的反应条件为
而使合成气产率降低。有利于降低副反应的反应条件为 任写一点
任写一点 ;有利于提高制备合成气反应选择性的关键因素为
;有利于提高制备合成气反应选择性的关键因素为③一定温度下,向5L恒容密闭容器中充入
 和
和 ,只发生反应Ⅱ。10min达到平衡时测得CO的体积分数为
,只发生反应Ⅱ。10min达到平衡时测得CO的体积分数为 。则0—10min内,用
。则0—10min内,用 浓度变化表示的平均反应速率
浓度变化表示的平均反应速率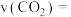
 填选项字母
填选项字母 。
。A 混合气体密度不再改变
 混合气体的平均相对分子质量不再改变
混合气体的平均相对分子质量不再改变C 容器内气体压强不再改变
 断裂
断裂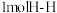 键同时断裂
键同时断裂 键
键(2)部分合金可用于氢能源的存储。一定温度下,某储氢合金
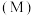 的储氢效率
的储氢效率 固相中氢原子与金属原子的数目之比
固相中氢原子与金属原子的数目之比 与温度
与温度 和氢气的平衡压强
和氢气的平衡压强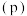 的关系如图所示。在OA段,氢溶解于M中形成固溶体
的关系如图所示。在OA段,氢溶解于M中形成固溶体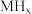 ;在AB段,发生氢化反应的化学方程式为
;在AB段,发生氢化反应的化学方程式为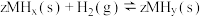 。
。
①
 时,该反应的平衡常数
时,该反应的平衡常数
 用含
用含 的代数式表示,
的代数式表示, 为用分压表示的平衡常数
为用分压表示的平衡常数 。
。②

 填“
填“ ”“
”“ ”或“
”或“ ”
”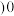 。
。③当反应处于图中a点时,保持温度不变,向恒容体系中通入少量氢气,达到平衡后反应可能处于图中的
 填“b”“c”或“d”
填“b”“c”或“d” 。
。(3)氢能源在电化学领域的一种存储和应用的原理为
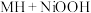

 ,充电时的阳极反应式为
,充电时的阳极反应式为
您最近一年使用:0次
解答题-原理综合题
|
适中
(0.65)
【推荐3】汽车尾气的氮氧化物是大气污染物的主要来源,研究汽车尾气处理是环境保护的重要课题。试回答下列问题:
(1)有关汽车尾气的生成
已知:①N2(g)+O2(g)=2NO(g) ΔH1=+180.50kJ•mol-1
②2NO(g)+O2(g)=2NO2(g) ΔH2=-144.14kJ•mol-1
③2N2O(g)⇌2N2(g)+O2(g) ΔH3=-244.10kJ•mol-1
则3NO(g)=N2O(g)+NO2(g) ΔH=_____ 。
(2)用CO消除汽车尾气
在催化剂a作用下将尾气转化为无污染的气体而除去。向密闭容器中充入10molCO(g)和8molNO(g)发生反应2NO(g)+2CO(g) N2(g)+2CO2(g) ΔH,测得平衡时NO体积分数与温度、压强的关系如图。
N2(g)+2CO2(g) ΔH,测得平衡时NO体积分数与温度、压强的关系如图。
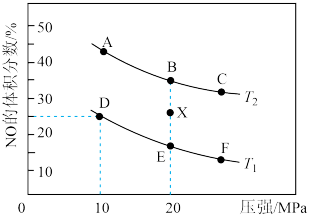
①已知T2>T1,则反应ΔH______ 0(填“>”、“=”或“<”)。
②该反应达到平衡后,为了同时提高反应速率和NO的平衡转化率,可采取的措施______ (填字母序号)。
a.改用高效催化剂
b.恒温恒容条件下,按投料比增大反应物浓度
c.移去CO2
d.升高温度
e.缩小反应容器的体积
③在温度为T1、容器体积为4L的条件下,反应进行到10min时恰好在D点达到平衡。则从反应开始到平衡时,NO平均反应速率v(NO)=_____ ;若其他条件不变,升高温度,用分压表示的平衡常数Kp_____ (填“变大”、“变小”或“不变”)。
④在X点,对反应容器升温的同时扩大体积使体系压强减小,重新达到平衡状态可能为图中_____ 点(填A~F)。
(3)用NH3消除汽车尾气
新型催化剂b在含有少量O2条件下,能催化NH3,和NOx,反应生成N2,且高温下活性很强。在盛有催化剂b的管式反应容器[如图(一)]中按一定比例匀速通入NH3、NOx、O2发生反应。NOx的除去率随反应温度变化曲线如图(二)所示。
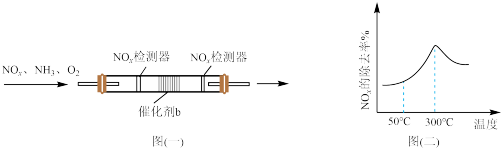
①在50℃之前,NOx的除去率随温度升高而缓慢上升的原因是_____ 。
②当温度高于300℃时,NOx除去率迅速下降的原因是_____ 。
(1)有关汽车尾气的生成
已知:①N2(g)+O2(g)=2NO(g) ΔH1=+180.50kJ•mol-1
②2NO(g)+O2(g)=2NO2(g) ΔH2=-144.14kJ•mol-1
③2N2O(g)⇌2N2(g)+O2(g) ΔH3=-244.10kJ•mol-1
则3NO(g)=N2O(g)+NO2(g) ΔH=
(2)用CO消除汽车尾气
在催化剂a作用下将尾气转化为无污染的气体而除去。向密闭容器中充入10molCO(g)和8molNO(g)发生反应2NO(g)+2CO(g)
 N2(g)+2CO2(g) ΔH,测得平衡时NO体积分数与温度、压强的关系如图。
N2(g)+2CO2(g) ΔH,测得平衡时NO体积分数与温度、压强的关系如图。
①已知T2>T1,则反应ΔH
②该反应达到平衡后,为了同时提高反应速率和NO的平衡转化率,可采取的措施
a.改用高效催化剂
b.恒温恒容条件下,按投料比增大反应物浓度
c.移去CO2
d.升高温度
e.缩小反应容器的体积
③在温度为T1、容器体积为4L的条件下,反应进行到10min时恰好在D点达到平衡。则从反应开始到平衡时,NO平均反应速率v(NO)=
④在X点,对反应容器升温的同时扩大体积使体系压强减小,重新达到平衡状态可能为图中
(3)用NH3消除汽车尾气
新型催化剂b在含有少量O2条件下,能催化NH3,和NOx,反应生成N2,且高温下活性很强。在盛有催化剂b的管式反应容器[如图(一)]中按一定比例匀速通入NH3、NOx、O2发生反应。NOx的除去率随反应温度变化曲线如图(二)所示。

①在50℃之前,NOx的除去率随温度升高而缓慢上升的原因是
②当温度高于300℃时,NOx除去率迅速下降的原因是
您最近一年使用:0次
解答题-原理综合题
|
适中
(0.65)
名校
解题方法
【推荐1】掺杂硒的纳米氧化亚铜催化剂可用于工业上合成甲醇,其反应为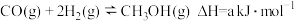 。已知:
。已知: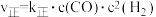 ,
,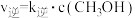 ,其中k正、k逆为速率常数,c为各组分的物质的量浓度。回答下列问题:
,其中k正、k逆为速率常数,c为各组分的物质的量浓度。回答下列问题:
(1)若按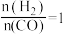 的投料比将
的投料比将 与CO充入VL的刚性恒容密闭容器中,在一定条件下发生反应,测定CO的平衡转化率与温度、压强的关系如图所示。
与CO充入VL的刚性恒容密闭容器中,在一定条件下发生反应,测定CO的平衡转化率与温度、压强的关系如图所示。
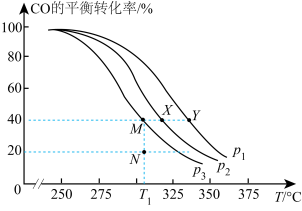
①压强P1、P2、P3由小到大的顺序是_______ 。
②T1℃,若向该容器中充入3.0 mol 和3.0 mol CO发生上述反应,5 min后反应达到平衡(M点),则0~5 min内,
和3.0 mol CO发生上述反应,5 min后反应达到平衡(M点),则0~5 min内,
_______  ,则N点的
,则N点的
_______ 。
③X、Y、M、N四点,平衡常数从大到小关系是_______ 。
(2)若向起始温度为325℃的10 L刚性恒容密闭容器中充入2 mol CO和3 mol ,发生反应,体系总压强
,发生反应,体系总压强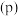 与时间
与时间 的关系如图中曲线Ⅰ所示;曲线Ⅱ为只改变某一条件的变化曲线,曲线中平衡温度与起始温度相同。
的关系如图中曲线Ⅰ所示;曲线Ⅱ为只改变某一条件的变化曲线,曲线中平衡温度与起始温度相同。
①曲线Ⅱ所对应的改变的条件可能为_______ 。
②体系总压强先增大后减小的原因为_______ 。
③该条件下 的平衡转化率为
的平衡转化率为_______ %(结果保留一位小数)。
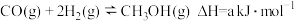 。已知:
。已知: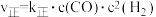 ,
,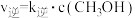 ,其中k正、k逆为速率常数,c为各组分的物质的量浓度。回答下列问题:
,其中k正、k逆为速率常数,c为各组分的物质的量浓度。回答下列问题:(1)若按
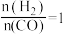 的投料比将
的投料比将 与CO充入VL的刚性恒容密闭容器中,在一定条件下发生反应,测定CO的平衡转化率与温度、压强的关系如图所示。
与CO充入VL的刚性恒容密闭容器中,在一定条件下发生反应,测定CO的平衡转化率与温度、压强的关系如图所示。
①压强P1、P2、P3由小到大的顺序是
②T1℃,若向该容器中充入3.0 mol
 和3.0 mol CO发生上述反应,5 min后反应达到平衡(M点),则0~5 min内,
和3.0 mol CO发生上述反应,5 min后反应达到平衡(M点),则0~5 min内,
 ,则N点的
,则N点的
③X、Y、M、N四点,平衡常数从大到小关系是
(2)若向起始温度为325℃的10 L刚性恒容密闭容器中充入2 mol CO和3 mol
 ,发生反应,体系总压强
,发生反应,体系总压强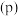 与时间
与时间 的关系如图中曲线Ⅰ所示;曲线Ⅱ为只改变某一条件的变化曲线,曲线中平衡温度与起始温度相同。
的关系如图中曲线Ⅰ所示;曲线Ⅱ为只改变某一条件的变化曲线,曲线中平衡温度与起始温度相同。
①曲线Ⅱ所对应的改变的条件可能为
②体系总压强先增大后减小的原因为
③该条件下
 的平衡转化率为
的平衡转化率为
您最近一年使用:0次
解答题-工业流程题
|
适中
(0.65)
解题方法
【推荐2】根据当地资源等情况,硫酸工业常用黄铁矿(主要成分为FeS2)作为原料。完成下列填空:
(1)将0.050mol SO2(g) 和0.030mol O2(g) 充入一个2L的密闭容器中,在一定条件下发生反应:2SO2(g)+O2(g) 2SO3(g)+Q 。经2分钟反应达到平衡,测得n(SO3) = 0.040mol,则O2的平均反应速率为
2SO3(g)+Q 。经2分钟反应达到平衡,测得n(SO3) = 0.040mol,则O2的平均反应速率为______________________ 。
(2)在容积不变时,下列措施中有利于提高SO2平衡转化率的有________ (选填编号)。
a.移出氧气
b.降低温度
c.减小压强
d.再充入0.050molSO2(g)和0.030molO2(g)
(3)在起始温度T1(673K)时SO2的转化率随反应时间(t)的变化如图。请在图中画出其他条件不变情况下,起始温度为T2(723K)时SO2的转化率随反应时间变化的示意图。________ 。

(1)将0.050mol SO2(g) 和0.030mol O2(g) 充入一个2L的密闭容器中,在一定条件下发生反应:2SO2(g)+O2(g)
 2SO3(g)+Q 。经2分钟反应达到平衡,测得n(SO3) = 0.040mol,则O2的平均反应速率为
2SO3(g)+Q 。经2分钟反应达到平衡,测得n(SO3) = 0.040mol,则O2的平均反应速率为(2)在容积不变时,下列措施中有利于提高SO2平衡转化率的有
a.移出氧气
b.降低温度
c.减小压强
d.再充入0.050molSO2(g)和0.030molO2(g)
(3)在起始温度T1(673K)时SO2的转化率随反应时间(t)的变化如图。请在图中画出其他条件不变情况下,起始温度为T2(723K)时SO2的转化率随反应时间变化的示意图。

您最近一年使用:0次
解答题-原理综合题
|
适中
(0.65)
名校
【推荐3】现代社会的一切活动都离不开能量,化学反应在发生物质变化的同时伴随有能量变化,能量、速率与限度是认识和研究化学反应的重要视角。
(1)氢氧燃料电池是符合绿色化学理念的新型发电装置。图为电池示意图,该电池电极表面镀了一层细小的铂粉,铂吸附气体的能力强,性质稳定。请回答:

①电池的负极反应式为:_______ 。
②电池工作时 向
向_______ 移动(填“正极”或“负极”)。
③正极上消耗标况下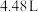 气体时,转移电子的数目为
气体时,转移电子的数目为_______ 。
(2)在2L绝热密闭容器中投入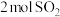 和
和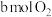 ,图是部分反应物随时间的变化曲线。
,图是部分反应物随时间的变化曲线。

① 时,
时,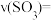
_______ 。
②反应达到平衡时, 的转化率为
的转化率为_______ 。
③下列情况能说明该反应达到化学平衡的是_______ 。
A.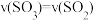
B.混合气体的密度保持不变
C.t时刻,体系的温度不再发生改变
D.混合气体的总物质的量不再改变
(1)氢氧燃料电池是符合绿色化学理念的新型发电装置。图为电池示意图,该电池电极表面镀了一层细小的铂粉,铂吸附气体的能力强,性质稳定。请回答:

①电池的负极反应式为:
②电池工作时
 向
向③正极上消耗标况下
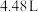 气体时,转移电子的数目为
气体时,转移电子的数目为(2)在2L绝热密闭容器中投入
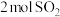 和
和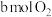 ,图是部分反应物随时间的变化曲线。
,图是部分反应物随时间的变化曲线。
①
 时,
时,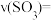
②反应达到平衡时,
 的转化率为
的转化率为③下列情况能说明该反应达到化学平衡的是
A.
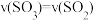
B.混合气体的密度保持不变
C.t时刻,体系的温度不再发生改变
D.混合气体的总物质的量不再改变
您最近一年使用:0次
解答题-原理综合题
|
适中
(0.65)
名校
【推荐1】目前工业上有一种方法是用CO2生产燃料甲醇。一定条件下发生反应:CO2(g)+3H2(g) CH3OH(g)+H2O(g),如图表示该反应进行过程中能量(单位为kJ·mol-1)的变化。
CH3OH(g)+H2O(g),如图表示该反应进行过程中能量(单位为kJ·mol-1)的变化。
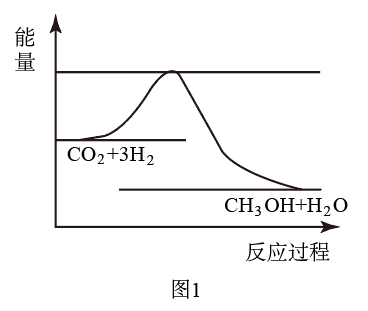
(1)关于该反应的下列说法中,正确的是___ 。(填字母)
A.△H>0,△S>0 B.△H>0,△S<0 C.△H<0,△S<0 D.△H<0,△S>0
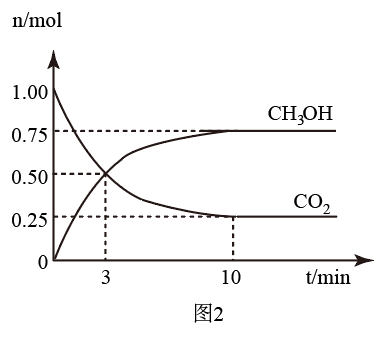
(2)为探究反应原理,现进行如下实验:在体积为3L的恒容密闭容器中,充入1molCO2和3molH2,测得CO2和CH3OH(g)的物质的量随时间变化如图所示。从反应开始到平衡,用氢气浓度变化表示的平均反应速率v(H2)为___ 。
(3)下列措施中能使(2)中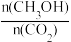 增大的有
增大的有___ 。(填字母)
a.升高温度
b.加入催化剂
c.将H2O(g)从体系中分离
d.再充入1molCO2和3molH2
e.充入He(g),使体系总压强增大
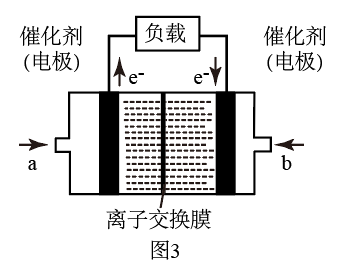
(4)如图是甲醇燃料电池(电解质溶液为KOH溶液)结构示意图,写出a处电极上发生的电极反应式___ 。
 CH3OH(g)+H2O(g),如图表示该反应进行过程中能量(单位为kJ·mol-1)的变化。
CH3OH(g)+H2O(g),如图表示该反应进行过程中能量(单位为kJ·mol-1)的变化。
(1)关于该反应的下列说法中,正确的是
A.△H>0,△S>0 B.△H>0,△S<0 C.△H<0,△S<0 D.△H<0,△S>0
(2)为探究反应原理,现进行如下实验:在体积为3L的恒容密闭容器中,充入1molCO2和3molH2,测得CO2和CH3OH(g)的物质的量随时间变化如图所示。从反应开始到平衡,用氢气浓度变化表示的平均反应速率v(H2)为

(3)下列措施中能使(2)中
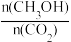 增大的有
增大的有a.升高温度
b.加入催化剂
c.将H2O(g)从体系中分离
d.再充入1molCO2和3molH2
e.充入He(g),使体系总压强增大
(4)如图是甲醇燃料电池(电解质溶液为KOH溶液)结构示意图,写出a处电极上发生的电极反应式

您最近一年使用:0次
解答题-原理综合题
|
适中
(0.65)
【推荐2】甲醇是结构最为简单的饱和一元醇,又称“木醇”或“木精”。甲醇是一碳化学基础的原料和优质的燃料,主要应用于精细化工、塑料、能源等领域。已知甲醇制备的有关化学反应如下:
反应①:CO(g)+2H2(g) CH3OH(g) ΔH1=﹣92kJ/mol
CH3OH(g) ΔH1=﹣92kJ/mol
反应②:CO2(g)+H2(g) CO(g)+H2O(g) ΔH2
CO(g)+H2O(g) ΔH2
反应③:CO2(g)+3H2(g) CH3OH(g)+H2O(g) ΔH3=﹣49kJ/mol
CH3OH(g)+H2O(g) ΔH3=﹣49kJ/mol
(1)反应②的ΔH2=___________ kJ/mol
(2)500℃时三个反应的平衡常数依次为K1、K2与K3,则K3=___________ (用K1、K2表示)。
已知500℃时,K1=2.5,K2=1.0,并测得该温度下反应③在某时刻H2(g)、CO2(g)、CH3OH(g)、H2O(g)的浓度(mol/L)分别为1.0、0.2、0.6、1.5,则此时 v正___________ v逆(填“>”、“=”或“<”)
(3)在2L密闭容器中充入8 mol CO2和7 mol H2发生反应②,10min后达到平衡,CO2的转化率为50%,则0~10 min内用CO表示该反应的速率v(CO)=___________ mol/(L• min),若要提高H2的平衡转化率可采取的措施___________ (写一点即可)
(4)甲醇燃料电池可能成为未来便携电子产品应用的主流。以甲醇燃料电池为电源电解足量的200 mL CuSO4溶液工作原理如下图所示(A、B均为石墨电极),则通甲醇一端的电极反应式为___________ ;当甲池消耗标况下112 mL的O2时,电解后乙池溶液的pH为___________ (忽略溶液体积变化)

反应①:CO(g)+2H2(g)
 CH3OH(g) ΔH1=﹣92kJ/mol
CH3OH(g) ΔH1=﹣92kJ/mol反应②:CO2(g)+H2(g)
 CO(g)+H2O(g) ΔH2
CO(g)+H2O(g) ΔH2反应③:CO2(g)+3H2(g)
 CH3OH(g)+H2O(g) ΔH3=﹣49kJ/mol
CH3OH(g)+H2O(g) ΔH3=﹣49kJ/mol(1)反应②的ΔH2=
(2)500℃时三个反应的平衡常数依次为K1、K2与K3,则K3=
已知500℃时,K1=2.5,K2=1.0,并测得该温度下反应③在某时刻H2(g)、CO2(g)、CH3OH(g)、H2O(g)的浓度(mol/L)分别为1.0、0.2、0.6、1.5,则此时 v正
(3)在2L密闭容器中充入8 mol CO2和7 mol H2发生反应②,10min后达到平衡,CO2的转化率为50%,则0~10 min内用CO表示该反应的速率v(CO)=
(4)甲醇燃料电池可能成为未来便携电子产品应用的主流。以甲醇燃料电池为电源电解足量的200 mL CuSO4溶液工作原理如下图所示(A、B均为石墨电极),则通甲醇一端的电极反应式为

您最近一年使用:0次
解答题-原理综合题
|
适中
(0.65)
名校
【推荐3】回答下列问题:
(1)一种燃料电池中发生的化学反应为:在酸性溶液中甲醇(CH3OH)与氧作用生成水和二氧化碳。该电池 负极发生的反应是_______ 。
(2)要实现铁上镀银,则阳极为_______ ,电极反应式为_______ ,阴极为_______ ,电极反应式为_______ ,电镀液为_______ 。
(3)电解原理在化学工业中有广泛应用。如图表示一个电解池,装有电解液a ;X、Y 是两块电极板,通过导线与直流电源相连。请回答以下问题:

①若X、Y 都是惰性电极,a 是饱和 NaCl 溶液,则电解池中 X 极上的电极反应 为_______ ,Y 电极上的电极反应式是_______ ,检验该电极反应产物的方法是 :_______ 。
③如果用电解方法精炼粗铜,电解液 a 选用 CuSO4溶液,则X 电极的材料是_______ ,电极反应式是_______ ,Y 电极的材料是_______ ,电极反应式是_______ 。(假设粗铜中含铁、锌、银、金)
(4)铅蓄电池是典型的可充型电池,它的正负极格板是惰性材料,电池总反应式为:Pb+PbO2+4H++2 SO
 2PbSO4+2H2O 请回答下列问题(不考虑氢、氧的氧化还原):放电时:正极的电极反应式是
2PbSO4+2H2O 请回答下列问题(不考虑氢、氧的氧化还原):放电时:正极的电极反应式是_______ ;电解液中 H2SO4的浓度将变_______ ;当外电路通过 1 mol 电子时,理论上负极板的质量增加_______ g。充电时:阴极的电极反应式是_______ 。
(1)一种燃料电池中发生的化学反应为:在酸性溶液中甲醇(CH3OH)与氧作用生成水和二氧化碳。该电池 负极发生的反应是
(2)要实现铁上镀银,则阳极为
(3)电解原理在化学工业中有广泛应用。如图表示一个电解池,装有电解液a ;X、Y 是两块电极板,通过导线与直流电源相连。请回答以下问题:

①若X、Y 都是惰性电极,a 是饱和 NaCl 溶液,则电解池中 X 极上的电极反应 为
③如果用电解方法精炼粗铜,电解液 a 选用 CuSO4溶液,则X 电极的材料是
(4)铅蓄电池是典型的可充型电池,它的正负极格板是惰性材料,电池总反应式为:Pb+PbO2+4H++2 SO

 2PbSO4+2H2O 请回答下列问题(不考虑氢、氧的氧化还原):放电时:正极的电极反应式是
2PbSO4+2H2O 请回答下列问题(不考虑氢、氧的氧化还原):放电时:正极的电极反应式是
您最近一年使用:0次



