某小组同学为了获取在Fe(OH)2制备过程中,沉淀颜色的改变与氧气有关的实验证据,用下图所示装置进行了如下实验(夹持装置已略去,气密性已检验)。
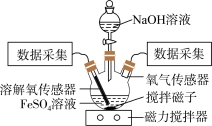
【进行实验】
实验步骤:Ⅰ.向瓶中加入饱和FeSO4溶液,按图1所示连接装置;
Ⅱ.打开磁力搅拌器,立即加入10% NaOH溶液;
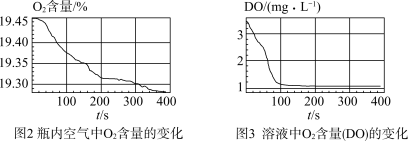
Ⅲ.采集瓶内空气中O2含量和溶液中O2含量(DO)的数据。
实验现象:生成白色絮状沉淀,白色沉淀迅速变为灰绿色,一段时间后部分变为红褐色。
【解释与结论】
(1)搅拌的目的是__________________________ 。
(2)生成白色沉淀的离子方程式是____________ 。
(3)红褐色沉淀是__________________________ 。(填化学式)
(4)通过上述实验,可得到“在Fe(OH)2制备过程中,沉淀颜色改变与氧气有关”的结论,其实验证据是______________________ 。
(5)写出白色沉淀最终生成红褐色转化的方程式:___________________________ 。

【进行实验】
实验步骤:Ⅰ.向瓶中加入饱和FeSO4溶液,按图1所示连接装置;
Ⅱ.打开磁力搅拌器,立即加入10% NaOH溶液;
Ⅲ.采集瓶内空气中O2含量和溶液中O2含量(DO)的数据。
实验现象:生成白色絮状沉淀,白色沉淀迅速变为灰绿色,一段时间后部分变为红褐色。
实验数据:

【解释与结论】
(1)搅拌的目的是
(2)生成白色沉淀的离子方程式是
(3)红褐色沉淀是
(4)通过上述实验,可得到“在Fe(OH)2制备过程中,沉淀颜色改变与氧气有关”的结论,其实验证据是
(5)写出白色沉淀最终生成红褐色转化的方程式:
更新时间:2019-12-12 14:17:39
|
相似题推荐
解答题-工业流程题
|
适中
(0.65)
【推荐1】一维纳米材料因其特殊的纳米结构,呈现出一系列独特的光、电、磁、催化等性能,具有十分广阔的应用前景。ZnS-C(ZnS纳米粒子分散在碳纳米材料上)是新型一维纳米材料,某科研小组用下列流程制备ZnS-C纳米材料。
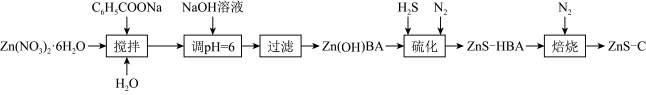
已知:BA表示C6H5COO
回答下列问题:
(1)“搅拌”后所得溶液显__________ (填“酸性”“中性”或“碱性”)。
(2)配制NaOH溶液时,蒸馏水要煮沸的原因是____________ 。
(3)向混合盐溶液中缓缓滴加NaOH溶液,促进相关离子的水解,出现Zn(OH)(C6H5COO)白色沉淀。
①写出生成沉淀的离子方程式_________ 。
②25℃,调pH=6,不产生Zn(OH)2沉淀,该溶液中c(Zn2+)<____ mol·L-1。[已知Ksp[Zn(OH)2]=1.2×10-17]
(4)“硫化”、“焙烧”过程,Zn(OH)BA通过原位固相反应制备ZnS-C纳米纤维的过程示意图如下:

①该过程中一直处于原位的离子是____________ ;
②在N2氛围中“焙烧”时,HBA(C6H5COOH)分解的化学方程式为___________ 。
(5)用N2吸附法对不同焙烧温度下制备得到的ZnS-C纳米纤维的比表面积进行测定,在不同温度(400℃-800℃)下焙烧所得ZnS-C纳米纤维的比表面积如下表:
① 随着温度的升高,ZnS纳米粒子__________ (填“变大”“不变”或“变小”)。
② ZnS-C纳米纤维可将N2吸附在其表面,形成均匀的单分子层。氮气分子横截面积为0.162 nm2,则在400℃焙烧所得的1g ZnS-C纳米纤维最大吸附的氮分子数为______ (保留3位有效数字)。

已知:BA表示C6H5COO
回答下列问题:
(1)“搅拌”后所得溶液显
(2)配制NaOH溶液时,蒸馏水要煮沸的原因是
(3)向混合盐溶液中缓缓滴加NaOH溶液,促进相关离子的水解,出现Zn(OH)(C6H5COO)白色沉淀。
①写出生成沉淀的离子方程式
②25℃,调pH=6,不产生Zn(OH)2沉淀,该溶液中c(Zn2+)<
(4)“硫化”、“焙烧”过程,Zn(OH)BA通过原位固相反应制备ZnS-C纳米纤维的过程示意图如下:

①该过程中一直处于原位的离子是
②在N2氛围中“焙烧”时,HBA(C6H5COOH)分解的化学方程式为
(5)用N2吸附法对不同焙烧温度下制备得到的ZnS-C纳米纤维的比表面积进行测定,在不同温度(400℃-800℃)下焙烧所得ZnS-C纳米纤维的比表面积如下表:
| t/℃ | 400 | 500 | 600 | 700 | 800 |
| 比表面积/m2 ·g-1 | 130.1 | 123.1 | 70.2 | 49.2 | 47.6 |
② ZnS-C纳米纤维可将N2吸附在其表面,形成均匀的单分子层。氮气分子横截面积为0.162 nm2,则在400℃焙烧所得的1g ZnS-C纳米纤维最大吸附的氮分子数为
您最近一年使用:0次
解答题-实验探究题
|
适中
(0.65)
解题方法
【推荐2】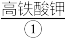 (K2FeO4)是一种高效多功能的新型绿色消毒剂。制备高铁酸钾的方法如下:将
(K2FeO4)是一种高效多功能的新型绿色消毒剂。制备高铁酸钾的方法如下:将 通入
通入 中生成饱和
中生成饱和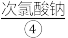 浓碱溶液,缓慢加入
浓碱溶液,缓慢加入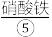 反应生成
反应生成 ,用
,用 使其转化成高铁酸钾,抽滤得粗品,再用氢氧化钾溶液溶解,重结晶,用
使其转化成高铁酸钾,抽滤得粗品,再用氢氧化钾溶液溶解,重结晶,用 和
和 进行脱碱、
进行脱碱、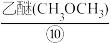 洗涤,干燥制得高铁酸钾。可用如图表示K2FeO4的制备过程:
洗涤,干燥制得高铁酸钾。可用如图表示K2FeO4的制备过程:
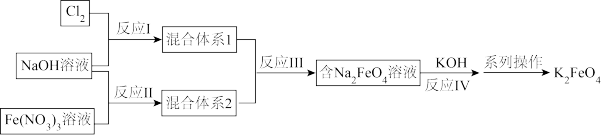
已知反应III的化学方程式为2Fe(OH)3+3NaClO+4NaOH=2Na2FeO4+3NaCl+5H2O。
请回答下列问题:
(1)在上述标有①~⑩序号的物质中,属于混合物的是____ (填序号,下同);属于盐的是____ ;属于有机物的是____ 。
(2)反应II的反应类型是____ (填四大基本反应类型之一)。
(3)写出Fe(NO3)3的电离方程式:_____ 。
(4)写出反应I的离子方程式:____ 。
(5)若生成166gNa2FeO4,则反应Ⅲ需要消耗4mol•L-1NaOH溶液的体积为____ mL。
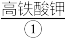 (K2FeO4)是一种高效多功能的新型绿色消毒剂。制备高铁酸钾的方法如下:将
(K2FeO4)是一种高效多功能的新型绿色消毒剂。制备高铁酸钾的方法如下:将 通入
通入 中生成饱和
中生成饱和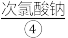 浓碱溶液,缓慢加入
浓碱溶液,缓慢加入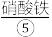 反应生成
反应生成 ,用
,用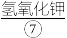 使其转化成高铁酸钾,抽滤得粗品,再用氢氧化钾溶液溶解,重结晶,用
使其转化成高铁酸钾,抽滤得粗品,再用氢氧化钾溶液溶解,重结晶,用 和
和 进行脱碱、
进行脱碱、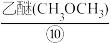 洗涤,干燥制得高铁酸钾。可用如图表示K2FeO4的制备过程:
洗涤,干燥制得高铁酸钾。可用如图表示K2FeO4的制备过程:
已知反应III的化学方程式为2Fe(OH)3+3NaClO+4NaOH=2Na2FeO4+3NaCl+5H2O。
请回答下列问题:
(1)在上述标有①~⑩序号的物质中,属于混合物的是
(2)反应II的反应类型是
(3)写出Fe(NO3)3的电离方程式:
(4)写出反应I的离子方程式:
(5)若生成166gNa2FeO4,则反应Ⅲ需要消耗4mol•L-1NaOH溶液的体积为
您最近一年使用:0次
解答题-实验探究题
|
适中
(0.65)
名校
解题方法
【推荐3】亚硝酸钙[ ]是水泥混凝土外加剂的主要原料,可配制成混凝土防冻剂、钢筋阻锈剂等。某学习小组用如图所示实验装置及药品来制备亚硝酸钙(夹持装置略去)。
]是水泥混凝土外加剂的主要原料,可配制成混凝土防冻剂、钢筋阻锈剂等。某学习小组用如图所示实验装置及药品来制备亚硝酸钙(夹持装置略去)。

①已知: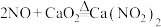 ;
;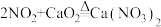 ;
;
②酸性条件下,NO能与 溶液反应生成
溶液反应生成 和
和 。
。
回答下列问题:
(1)检查装置的气密性,装入药品,实验开始前通入一段时间 ,然后关闭弹簧夹,再滴加稀硝酸,通入
,然后关闭弹簧夹,再滴加稀硝酸,通入 的作用是
的作用是___________ 。
(2)为达到实验目的,请把上述装置按气流方向进行连接:______
A→___________→B→___________→___________
(3)E装置的作用是___________ 。
(4)C装置中反应的离子方程式为___________ 。
(5)工业上可用石灰乳和硝酸工业的尾气(含 ,NO)反应,既能净化尾气,又能获得广泛的
,NO)反应,既能净化尾气,又能获得广泛的 ,反应原理为
,反应原理为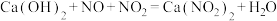 ,若
,若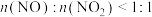 ,则会导致
,则会导致___________ 。
(6)将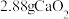 完全转化为
完全转化为 ,理论上需要铜的物质的量至少为
,理论上需要铜的物质的量至少为___________ mol。
 ]是水泥混凝土外加剂的主要原料,可配制成混凝土防冻剂、钢筋阻锈剂等。某学习小组用如图所示实验装置及药品来制备亚硝酸钙(夹持装置略去)。
]是水泥混凝土外加剂的主要原料,可配制成混凝土防冻剂、钢筋阻锈剂等。某学习小组用如图所示实验装置及药品来制备亚硝酸钙(夹持装置略去)。
①已知:
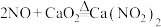 ;
;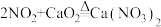 ;
;②酸性条件下,NO能与
 溶液反应生成
溶液反应生成 和
和 。
。回答下列问题:
(1)检查装置的气密性,装入药品,实验开始前通入一段时间
 ,然后关闭弹簧夹,再滴加稀硝酸,通入
,然后关闭弹簧夹,再滴加稀硝酸,通入 的作用是
的作用是(2)为达到实验目的,请把上述装置按气流方向进行连接:
A→___________→B→___________→___________
(3)E装置的作用是
(4)C装置中反应的离子方程式为
(5)工业上可用石灰乳和硝酸工业的尾气(含
 ,NO)反应,既能净化尾气,又能获得广泛的
,NO)反应,既能净化尾气,又能获得广泛的 ,反应原理为
,反应原理为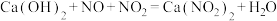 ,若
,若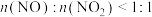 ,则会导致
,则会导致(6)将
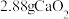 完全转化为
完全转化为 ,理论上需要铜的物质的量至少为
,理论上需要铜的物质的量至少为
您最近一年使用:0次
【推荐1】某课题组同学查阅文献知,3(NH4)2SO4(s)  4NH3↑ +3SO2↑+N2↑+6H2O。他们拟选择下列装置检验硫酸铵分解的产物(各装置中药品足量):
4NH3↑ +3SO2↑+N2↑+6H2O。他们拟选择下列装置检验硫酸铵分解的产物(各装置中药品足量):

回答下列问题:
(1)上述方程式涉及的物质中,属于电解质的是:_______ 。(写化学式)
(2)常温下,产物混合气体的平均相对分子质量为:_______ 。
(3)仪器A的名称是_______ 。
(4)甲组同学选择上述装置证明产物中是否有NH3。气体从左至右,装置的连接顺序为C→_______ →_______ 证明有NH3的实验现象是;_______ 。
(5)乙组同学设计方案:C→G→B→D→E证明产物中有H2O和SO2。
①能证明有水生成的实验现象是_______ ,B装置的作用是_______ 。
②实验中,观察到D装置产生白色沉淀。实验完毕后,过滤D装置中混合物得白色沉淀。欲验证白色沉淀是BaSO4还是BaSO3,请你设计简单的实验方案:_______ 。
③D装置中发生的反应与硝酸钡的量有关,若硝酸钡足量,则D中反应的离子方程式为_______ 。
 4NH3↑ +3SO2↑+N2↑+6H2O。他们拟选择下列装置检验硫酸铵分解的产物(各装置中药品足量):
4NH3↑ +3SO2↑+N2↑+6H2O。他们拟选择下列装置检验硫酸铵分解的产物(各装置中药品足量):
回答下列问题:
(1)上述方程式涉及的物质中,属于电解质的是:
(2)常温下,产物混合气体的平均相对分子质量为:
(3)仪器A的名称是
(4)甲组同学选择上述装置证明产物中是否有NH3。气体从左至右,装置的连接顺序为C→
(5)乙组同学设计方案:C→G→B→D→E证明产物中有H2O和SO2。
①能证明有水生成的实验现象是
②实验中,观察到D装置产生白色沉淀。实验完毕后,过滤D装置中混合物得白色沉淀。欲验证白色沉淀是BaSO4还是BaSO3,请你设计简单的实验方案:
③D装置中发生的反应与硝酸钡的量有关,若硝酸钡足量,则D中反应的离子方程式为
您最近一年使用:0次
解答题-实验探究题
|
适中
(0.65)
【推荐2】甲、乙两同学为探究SO2与可溶性钡的强酸盐能否反应生成白色BaSO3沉淀,用下图所示装置进行实验(夹持装置和A中加热装置已略,气密性已检验)。
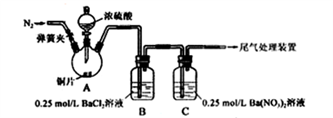
实验操作和现象:
(1)A中反应的化学方程式是_________________ ;
(2)C中生成白色沉淀的离子方程式为__________________ ;
(3)分析B中不溶于稀盐酸的沉淀产生的原因,甲认为是空气参与反应,乙认为是白雾参与反应。为证实各自的观点,在原实验基础上,甲、乙两同学分别作了如下实验:甲在原有操作之前通N2,一段时间,B中产生大量白色沉淀。乙在A、B间增加盛放饱和NaHSO3溶液的洗气瓶,B中有少量白色沉淀。产生少量沉淀的原因是_____________ 。
(4)结合(3)中两同学的实验现象。你认为原实验B中产生大量白色沉淀的主要原因是_____________ 。

实验操作和现象:
| 操作 | 现象 |
| 关闭弹簧夹,滴加一定量浓硫酸,加热 | A中有白雾生成,铜片表面产生气泡 B中有气泡冒出,产生大量白色沉淀 C中产生白色沉淀,液面上方略显浅棕色并逐渐消失 |
| 打开弹簧夹,通入N2,停止加热,一段时间后关闭 | |
| 从B、C中分别取少量白色沉淀,加稀盐酸 | 均未发现白色沉淀溶解 |
(2)C中生成白色沉淀的离子方程式为
(3)分析B中不溶于稀盐酸的沉淀产生的原因,甲认为是空气参与反应,乙认为是白雾参与反应。为证实各自的观点,在原实验基础上,甲、乙两同学分别作了如下实验:甲在原有操作之前通N2,一段时间,B中产生大量白色沉淀。乙在A、B间增加盛放饱和NaHSO3溶液的洗气瓶,B中有少量白色沉淀。产生少量沉淀的原因是
(4)结合(3)中两同学的实验现象。你认为原实验B中产生大量白色沉淀的主要原因是
您最近一年使用:0次
解答题-实验探究题
|
适中
(0.65)
解题方法
【推荐3】I.某化学兴趣小组利用如下装置制取氨气并探究氨气的有关性质。
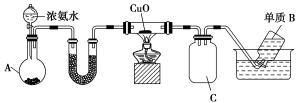
(1)图中,仪器A的名称是________ ,A中盛放的固体是________ 。
(2)已知单质B是空气中含量最多的成分,则玻璃管中发生反应的化学方程式为________ 。
(3)C装置的作用是___________ 。
II.将SO2分别通入下列四种溶液中
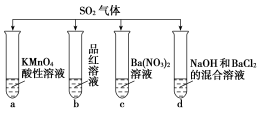
回答下列问题:
(1)试管a中的实验现象是:KMnO4溶液________ ,证明SO2具有________ 性;
(2)试管b中的实验现象是:品红溶液________ ,证明SO2具有________ 性;
(3)试管c中能产生白色沉淀,该沉淀是________ ;
(4)试管d中能产生白色沉淀,该沉淀是________ 。

(1)图中,仪器A的名称是
(2)已知单质B是空气中含量最多的成分,则玻璃管中发生反应的化学方程式为
(3)C装置的作用是
II.将SO2分别通入下列四种溶液中

回答下列问题:
(1)试管a中的实验现象是:KMnO4溶液
(2)试管b中的实验现象是:品红溶液
(3)试管c中能产生白色沉淀,该沉淀是
(4)试管d中能产生白色沉淀,该沉淀是
您最近一年使用:0次
解答题-实验探究题
|
适中
(0.65)
解题方法
【推荐1】黄铁矿是我国大多数硫酸厂制取硫酸的主要原料,某化学兴趣小组对某黄铁矿石(主要成分为FeS2)进行如下实验探究。
(1)将m1 g该黄铁矿样品放入如下图所示装置(夹持和加热装置省略)的石英管中,从a处不断地缓缓通入空气,高温灼烧石英管中的黄铁矿样品至反应完全得到红棕色固体和一种刺激性气味的气体。写出石英管中发生反应的化学方程式:______ 。

Ⅱ.反应结束后,将乙瓶中的溶液进行如下处理:

问题讨论:
(2)Ⅰ中,甲中所盛试剂是_____ ,乙中发生反应的离子方程式为_______ 。
(3)Ⅱ中,所加H2O2溶液需足量的目的是___________ 。
(4)该黄铁矿石中硫元素的质量分数为________ 。
【实验二】设计以下实验方案测定铁元素的含量

问题讨论:
(5)③中,需要用到的仪器除烧杯、玻璃棒、胶头滴管外,还有________ 。
(6)④中,若将稀释液久置后再用酸性KMnO4滴定,则所测得的铁元素的含量________ (填“偏大”“偏小”或“无影响”)。
(7)某同学一共进行了三次滴定实验,三次实验结果记录如下:
根据所给数据,计算该稀释液中Fe2+的物质的量浓度为c(Fe2+)=________ mol/L。
(提示:5Fe2++MnO +8H+=Mn2++5Fe3++4H2O)
+8H+=Mn2++5Fe3++4H2O)
(1)将m1 g该黄铁矿样品放入如下图所示装置(夹持和加热装置省略)的石英管中,从a处不断地缓缓通入空气,高温灼烧石英管中的黄铁矿样品至反应完全得到红棕色固体和一种刺激性气味的气体。写出石英管中发生反应的化学方程式:

Ⅱ.反应结束后,将乙瓶中的溶液进行如下处理:

问题讨论:
(2)Ⅰ中,甲中所盛试剂是
(3)Ⅱ中,所加H2O2溶液需足量的目的是
(4)该黄铁矿石中硫元素的质量分数为
【实验二】设计以下实验方案测定铁元素的含量

问题讨论:
(5)③中,需要用到的仪器除烧杯、玻璃棒、胶头滴管外,还有
(6)④中,若将稀释液久置后再用酸性KMnO4滴定,则所测得的铁元素的含量
(7)某同学一共进行了三次滴定实验,三次实验结果记录如下:
实验次数 | 第一次 | 第二次 | 第三次 |
消耗KMnO4溶液体积/mL | 26.42 | 25.05 | 24.95 |
(提示:5Fe2++MnO
 +8H+=Mn2++5Fe3++4H2O)
+8H+=Mn2++5Fe3++4H2O)
您最近一年使用:0次
解答题-实验探究题
|
适中
(0.65)
名校
【推荐2】某化学兴趣小组欲推测某气体为CO2和SO2的混合气体,设计如下装置图,已知:气体从a端通入,回答问题。
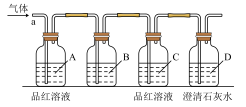
(1)B中试剂为_________ (填序号)。
①氯化钠溶液 ②酸性高锰酸钾溶液 ③盐酸 ④澄清石灰水
(2)A中品红溶液的作用是___________________ 。
(3)D中澄清石灰水的作用是_______________ 。
(4)若该气体确实为CO2和SO2的混合气体,则A、C、D中的现象分别为:
________________________ 、________________________ 、_____________________ 。

(1)B中试剂为
①氯化钠溶液 ②酸性高锰酸钾溶液 ③盐酸 ④澄清石灰水
(2)A中品红溶液的作用是
(3)D中澄清石灰水的作用是
(4)若该气体确实为CO2和SO2的混合气体,则A、C、D中的现象分别为:
您最近一年使用:0次
解答题-实验探究题
|
适中
(0.65)
名校
解题方法
【推荐3】对氯苯氧乙酸是一个常用的植物生长调节剂,俗称“防落素”,可以减少农作物或瓜果蔬菜的落花落果,有明显的增产作用。其实验原理为:

实验步骤:
①在反应器中,加入5.0g氯乙酸和5mL水,开动搅拌器,慢慢滴加饱和碳酸钠溶液,至溶液的pH=7~8,然后加入4.7g苯酚,再慢慢滴加35%氢氧化钠溶液至pH=12;
②将反应器置于水浴中缓慢加热,维持此温度20min;
③移去水浴,用浓盐酸调pH=4,析出固体,过滤,用水洗2~3次,再用乙醇洗涤;
④加入少量三氯化铁和10mL足量的浓盐酸。升温至60~70℃,缓慢滴加双氧水,保温反应20~30min,升温使固体溶解,慢慢冷却,析出固体,得到粗产品;将粗产品再次用热的乙醇溶解→煮沸→趁热过滤→加蒸馏水→自然冷却→过滤→洗涤→干燥→3.73g产品。

完成下列问题:
(1)装置中仪器A的名称是____ ,球形冷凝管的进水口是____ (a或b)。
(2)步骤①慢慢滴加饱和碳酸钠溶液过程中发生反应的化学方程式为____ 。
(3)步骤②中采用水浴加热,用水浴加热的优点是____ 。
(4)步骤③用乙醇洗涤的目的是____ 。
(5)步骤④中加入浓盐酸的目的是____ 。
(6)该实验所得对氯苯氧乙酸的产率为____ 。

实验步骤:
①在反应器中,加入5.0g氯乙酸和5mL水,开动搅拌器,慢慢滴加饱和碳酸钠溶液,至溶液的pH=7~8,然后加入4.7g苯酚,再慢慢滴加35%氢氧化钠溶液至pH=12;
②将反应器置于水浴中缓慢加热,维持此温度20min;
③移去水浴,用浓盐酸调pH=4,析出固体,过滤,用水洗2~3次,再用乙醇洗涤;
④加入少量三氯化铁和10mL足量的浓盐酸。升温至60~70℃,缓慢滴加双氧水,保温反应20~30min,升温使固体溶解,慢慢冷却,析出固体,得到粗产品;将粗产品再次用热的乙醇溶解→煮沸→趁热过滤→加蒸馏水→自然冷却→过滤→洗涤→干燥→3.73g产品。

完成下列问题:
(1)装置中仪器A的名称是
(2)步骤①慢慢滴加饱和碳酸钠溶液过程中发生反应的化学方程式为
(3)步骤②中采用水浴加热,用水浴加热的优点是
(4)步骤③用乙醇洗涤的目的是
(5)步骤④中加入浓盐酸的目的是
(6)该实验所得对氯苯氧乙酸的产率为
您最近一年使用:0次



