图 1 是课本“还原铁粉与水蒸气反应”的实验装置图。

(1)写出铁粉与水蒸气反应的化学方程式,并用“单线桥”标出电子转移方向及数目 :_____________ ;其中氧化剂为________________ (写化学式);标况下,生成气体2.24L,则消耗Fe的质量为__________ g。
(2)证明还原铁粉与水蒸气发生了反应的现象是:________________ 。 若将反应生成的固体产物溶于盐酸,其离子反应方程式为________________ 。

(1)写出铁粉与水蒸气反应的化学方程式,并用“单线桥”标出电子转移方向及数目 :
(2)证明还原铁粉与水蒸气发生了反应的现象是:
更新时间:2019-12-20 19:57:32
|
相似题推荐
解答题-原理综合题
|
较易
(0.85)
名校
解题方法
【推荐1】化学研究的物质多种多样,按要求回答下列问题:
(1)过二硫酸钠( )可以看成过氧化氢的衍生物,
)可以看成过氧化氢的衍生物, 分子中的两个H原子被磺酸基(
分子中的两个H原子被磺酸基(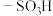 )取代后即为过二硫酸。
)取代后即为过二硫酸。
① 中硫元素的化合价为
中硫元素的化合价为_______ 。
②用 溶液可以检测废水中的
溶液可以检测废水中的 ,含有
,含有 的废水加入
的废水加入 溶液后会变为紫红色,
溶液后会变为紫红色, 被还原为稳定的
被还原为稳定的 。发生上述反应的氧化剂与还原剂的物质的量之比为
。发生上述反应的氧化剂与还原剂的物质的量之比为_______ 。
(2)硫代硫酸钠( )又名大苏打,造纸工业用作纸浆漂白后的除氯剂。
)又名大苏打,造纸工业用作纸浆漂白后的除氯剂。
① 在中性与碱性溶液中很稳定,遇酸则迅速反应。
在中性与碱性溶液中很稳定,遇酸则迅速反应。 溶液中加入稀硫酸时反应的离子方程式为
溶液中加入稀硫酸时反应的离子方程式为_______ 。
② 常用于防毒面具中吸收
常用于防毒面具中吸收 。若1 mol
。若1 mol  完全反应,失去8 mol电子,则其水溶液吸收
完全反应,失去8 mol电子,则其水溶液吸收 的离子方程式为
的离子方程式为_______ 。
(3)在室温下,化学反应 的反应物初始浓度、溶液中的
的反应物初始浓度、溶液中的 初始浓度及初始速率间的关系如下表所示。
初始浓度及初始速率间的关系如下表所示。
已知表中初始反应速率与有关离子浓度关系可以表示为: (温度一定时,k为常数)
(温度一定时,k为常数)
(1)计算b、c的值:b=_______ ,c=_______ 。
(2)若实验编号4的其他浓度不变,仅将溶液的酸碱值变更为 ,反应的初始速率v=
,反应的初始速率v=_______ mol⋅L ⋅s
⋅s 。
。
(1)过二硫酸钠(
 )可以看成过氧化氢的衍生物,
)可以看成过氧化氢的衍生物, 分子中的两个H原子被磺酸基(
分子中的两个H原子被磺酸基(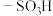 )取代后即为过二硫酸。
)取代后即为过二硫酸。①
 中硫元素的化合价为
中硫元素的化合价为②用
 溶液可以检测废水中的
溶液可以检测废水中的 ,含有
,含有 的废水加入
的废水加入 溶液后会变为紫红色,
溶液后会变为紫红色, 被还原为稳定的
被还原为稳定的 。发生上述反应的氧化剂与还原剂的物质的量之比为
。发生上述反应的氧化剂与还原剂的物质的量之比为(2)硫代硫酸钠(
 )又名大苏打,造纸工业用作纸浆漂白后的除氯剂。
)又名大苏打,造纸工业用作纸浆漂白后的除氯剂。①
 在中性与碱性溶液中很稳定,遇酸则迅速反应。
在中性与碱性溶液中很稳定,遇酸则迅速反应。 溶液中加入稀硫酸时反应的离子方程式为
溶液中加入稀硫酸时反应的离子方程式为②
 常用于防毒面具中吸收
常用于防毒面具中吸收 。若1 mol
。若1 mol  完全反应,失去8 mol电子,则其水溶液吸收
完全反应,失去8 mol电子,则其水溶液吸收 的离子方程式为
的离子方程式为(3)在室温下,化学反应
 的反应物初始浓度、溶液中的
的反应物初始浓度、溶液中的 初始浓度及初始速率间的关系如下表所示。
初始浓度及初始速率间的关系如下表所示。| 实验编号 |  的初始浓度(mol⋅L 的初始浓度(mol⋅L ) ) |  的初始浓度(mol⋅L 的初始浓度(mol⋅L ) ) |  的初始浓度(mol⋅L 的初始浓度(mol⋅L ) ) | 初始速率ν(mol⋅L ⋅s ⋅s ) ) |
| 1 | 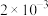 |  | 1.00 | 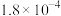 |
| 2 | a |  | 1.00 |  |
| 3 | 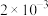 | 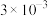 | 2.00 | 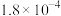 |
| 4 | 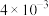 | 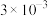 | 1.00 | 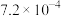 |
已知表中初始反应速率与有关离子浓度关系可以表示为:
 (温度一定时,k为常数)
(温度一定时,k为常数)(1)计算b、c的值:b=
(2)若实验编号4的其他浓度不变,仅将溶液的酸碱值变更为
 ,反应的初始速率v=
,反应的初始速率v= ⋅s
⋅s 。
。
您最近半年使用:0次
解答题-工业流程题
|
较易
(0.85)
名校
【推荐2】过氧化钙晶体(CaO2 8H2O)常用作医药消毒剂,可以轻质碳酸钙为原料,按以下实验方法来制备。
8H2O)常用作医药消毒剂,可以轻质碳酸钙为原料,按以下实验方法来制备。
轻质CaCO3粉末 滤液
滤液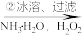 白色结晶体
白色结晶体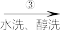 目标产物
目标产物
回答下列问题:
(1)CaO2电子式:_________________ 。
(2)反应①的离子方程式为_________________ ;过滤过程中用到的玻璃仪器有_________ 。
(3)用上述方法制取CaO2 8H2O的化学方程式为
8H2O的化学方程式为___________________________________ 。
(4)操作②温度不宜过高,其可能原因是___________________________________________ 。
(5)实验室常采用以酸为介质,用高锰酸钾溶液测定过氧化钙的含量。其原理为:5CaO2+8H2SO4+2KMnO4=5CaSO4+2MnSO4+5O2 +8H2O+K2SO4
+8H2O+K2SO4
,某同学准确称取ag产品于有塞锥形瓶中,用适量酸溶解,加入cmLbmol L-1的高锰酸钾溶液恰好完全反应,则该样品中过氧化钙的百分含量为
L-1的高锰酸钾溶液恰好完全反应,则该样品中过氧化钙的百分含量为________ (用含a、b、c的代数式表示)。
 8H2O)常用作医药消毒剂,可以轻质碳酸钙为原料,按以下实验方法来制备。
8H2O)常用作医药消毒剂,可以轻质碳酸钙为原料,按以下实验方法来制备。轻质CaCO3粉末
 滤液
滤液 白色结晶体
白色结晶体 目标产物
目标产物回答下列问题:
(1)CaO2电子式:
(2)反应①的离子方程式为
(3)用上述方法制取CaO2
 8H2O的化学方程式为
8H2O的化学方程式为(4)操作②温度不宜过高,其可能原因是
(5)实验室常采用以酸为介质,用高锰酸钾溶液测定过氧化钙的含量。其原理为:5CaO2+8H2SO4+2KMnO4=5CaSO4+2MnSO4+5O2
 +8H2O+K2SO4
+8H2O+K2SO4,某同学准确称取ag产品于有塞锥形瓶中,用适量酸溶解,加入cmLbmol
 L-1的高锰酸钾溶液恰好完全反应,则该样品中过氧化钙的百分含量为
L-1的高锰酸钾溶液恰好完全反应,则该样品中过氧化钙的百分含量为
您最近半年使用:0次
解答题-原理综合题
|
较易
(0.85)
解题方法
【推荐3】氢氧燃料电池是符合绿色化学理念的新型发电装置。下图为电池示意图,该电池电极表面镀一层细小的铂粉,铂吸附气体的能力强,性质稳定。请回答:
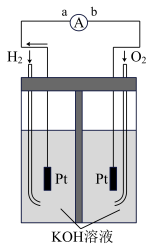
(1)氢氧燃料电池的在导线中电流的方向为由____ (用a、b表示)。
(2)负极反应式为___ 。
(3)该电池工作时,H2和O2连续由外部供给,电,池可连续不断提供电能。因此,大量安全储氢是关键技术之一。金属锂是一种重要的储氢材料,吸氢和放氢原理如下:
Ⅰ. 2Li+H2=2LiH Ⅱ. LiH+H2O=LiOH+H2↑
①反应Ⅰ中的还原剂是___ ,反应Ⅱ中的氧化剂是___ 。
②已知LiH固体密度为0.82g·cm-3,用锂吸收224 L(标准状况)H2,生成的LiH体积与被吸收的H2体积比为______ 。
③由②生成的LiH与H2O作用,放出的H2用作电池燃料,若能量转化率为80%,则导线中通过电子的物质的量为___ mol。

(1)氢氧燃料电池的在导线中电流的方向为由
(2)负极反应式为
(3)该电池工作时,H2和O2连续由外部供给,电,池可连续不断提供电能。因此,大量安全储氢是关键技术之一。金属锂是一种重要的储氢材料,吸氢和放氢原理如下:
Ⅰ. 2Li+H2=2LiH Ⅱ. LiH+H2O=LiOH+H2↑
①反应Ⅰ中的还原剂是
②已知LiH固体密度为0.82g·cm-3,用锂吸收224 L(标准状况)H2,生成的LiH体积与被吸收的H2体积比为
③由②生成的LiH与H2O作用,放出的H2用作电池燃料,若能量转化率为80%,则导线中通过电子的物质的量为
您最近半年使用:0次
解答题-实验探究题
|
较易
(0.85)
名校
解题方法
【推荐1】在没有氧气存在时,铁与水几乎不反应,但高温下,铁能与水蒸气反应。请设计实验,证明还原铁粉与水蒸气能够发生反应。
(1)铁粉与水蒸气反应的化学方程式是:__________________________________________
(2)证明还原铁粉与水蒸气发生了反应的方法是_________________________________________
(3)某同学用如图所示装置进行实验,请帮助该同学完成设计,用下列简图画出未完成的实验装置示意图(铁架台可省略,导气管的形状可根据需要选择)

__________
(4)停止反应,待装置冷却后,取出反应过的还原铁粉混合物,加入过量的稀硫酸充分反应,过滤。若混和物中既有Fe3+又有Fe2+,则证明该结论的实验方法:_________________________________________
(5)经检验上述滤液中不含Fe3+,这不能说明还原铁粉与水蒸气反应所得产物中不含+3价的Fe元素。原因是(结合离子方程式说明)___________________________________________
(6)某同学利用上述滤液制取白色的Fe(OH)2沉淀,向滤液中加入NaOH溶液后,观察至生成的白色沉淀迅速变成灰绿色,最后变成红褐色。沉淀由白色→红褐色的化学方程式是:_________________________
(1)铁粉与水蒸气反应的化学方程式是:
(2)证明还原铁粉与水蒸气发生了反应的方法是
(3)某同学用如图所示装置进行实验,请帮助该同学完成设计,用下列简图画出未完成的实验装置示意图(铁架台可省略,导气管的形状可根据需要选择)

(4)停止反应,待装置冷却后,取出反应过的还原铁粉混合物,加入过量的稀硫酸充分反应,过滤。若混和物中既有Fe3+又有Fe2+,则证明该结论的实验方法:
(5)经检验上述滤液中不含Fe3+,这不能说明还原铁粉与水蒸气反应所得产物中不含+3价的Fe元素。原因是(结合离子方程式说明)
(6)某同学利用上述滤液制取白色的Fe(OH)2沉淀,向滤液中加入NaOH溶液后,观察至生成的白色沉淀迅速变成灰绿色,最后变成红褐色。沉淀由白色→红褐色的化学方程式是:
您最近半年使用:0次
解答题-实验探究题
|
较易
(0.85)
【推荐2】某化学兴趣小组利用下图所示装置进行“铁与水蒸气反应”的实验,并检验气体产物。(部分夹持装置略去)
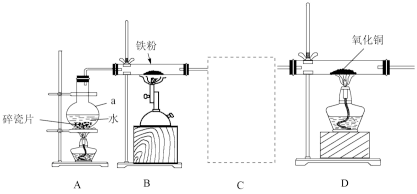
(1)铁与水蒸气反应的化学方程式是___________ 。
(2)仪器a的名称是___________ 。
(3)装置A的作用是___________ 。
(4)虚线框内宜选用下列装置中的____ (填数字序号),试管中浓硫酸的作用是______ 。
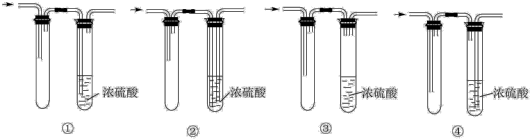
(5)实验时,先点燃装置A的酒精灯,后点燃装置B的酒精喷灯,可能的原因是___________ ﹔点燃装置D的酒精灯前,应进行的必要操作是___________ 。
(6)装置D中出现___________ 的现象,证明铁与水蒸气反应的气体产物是H2。

(1)铁与水蒸气反应的化学方程式是
(2)仪器a的名称是
(3)装置A的作用是
(4)虚线框内宜选用下列装置中的

(5)实验时,先点燃装置A的酒精灯,后点燃装置B的酒精喷灯,可能的原因是
(6)装置D中出现
您最近半年使用:0次
解答题-实验探究题
|
较易
(0.85)
解题方法
【推荐3】某同学按下图所示装置进行铁与水蒸气反应的实验探究。实验结束后,将玻璃管内固体物质冷却后,溶于稀硫酸,充分反应后,滴加KSCN溶液,溶液不变红,再滴入新制氯水,溶液变为红色。请回答:

(1)仪器C的名称为_________________________________________ 。
(2)该同学据实验得出结论:铁与水蒸气反应生成FeO和H2。该结论不严密,理由是_________ 。
(3)经检验,反应生成的固体具有磁性,写出铁与水蒸气反应的化学方程式:_______________ 。

(1)仪器C的名称为
(2)该同学据实验得出结论:铁与水蒸气反应生成FeO和H2。该结论不严密,理由是
(3)经检验,反应生成的固体具有磁性,写出铁与水蒸气反应的化学方程式:
您最近半年使用:0次



