某同学为测定烧碱样品(含有少量NaCl杂质)中NaOH的质量分数,进行如下实验操作:
a.将洁净的酸式滴定管和碱式滴定管分别用要盛装的酸、碱溶液润洗2遍
b.用碱式滴定管量取25.00 mL烧碱溶液于锥形瓶中,滴入2滴酚酞溶液
c.在天平上准确称取烧碱样品10.0 g,在烧杯中用蒸馏水溶解
d.将浓度为1.000 mol·L-1盐酸标准液装入酸式滴定管中,将烧碱溶液装入碱式滴定管中,并分别调节液面,记下开始时的读数
e.在锥形瓶下垫一张白纸,然后开始滴定,边滴加边振荡,至滴定终点,记下读数
f.在250 mL的容量瓶中定容,配制成250 mL烧碱溶液
请回答下列问题:
(1)正确操作步骤的顺序是(用字母填空)____ →____ →____ →d→b→____ 。
(2)下列仪器,实验中不需要的是(填序号)_________________
①托盘天平(带砝码,镊子) ②酸式滴定管 ③碱式滴定管 ④250 mL容量瓶
⑤烧杯 ⑥漏斗 ⑦锥形瓶 ⑧铁架台(带滴定管夹) ⑨药匙
实验中除上述仪器外,还缺少的仪器有(填名称)_______________________ 。
(3)滴定至终点,溶液由____ 色变为________ 色,且30秒内不褪色。
(4)重复四次的实验数据如下表所示:
根据以上数据,待测烧碱溶液物质的量浓度是_________ mol/L,该样品中NaOH的质量分数是__________ (精确到0.01%)。
(5)上述实验中,下列操作可能会造成结果偏高的是____________
A.f操作中,定容时俯视
B.滴定终点读数时仰视
C.使用前,碱式滴定管未用待装液润洗
D.锥形瓶水洗后未干燥就直接盛待测溶液
a.将洁净的酸式滴定管和碱式滴定管分别用要盛装的酸、碱溶液润洗2遍
b.用碱式滴定管量取25.00 mL烧碱溶液于锥形瓶中,滴入2滴酚酞溶液
c.在天平上准确称取烧碱样品10.0 g,在烧杯中用蒸馏水溶解
d.将浓度为1.000 mol·L-1盐酸标准液装入酸式滴定管中,将烧碱溶液装入碱式滴定管中,并分别调节液面,记下开始时的读数
e.在锥形瓶下垫一张白纸,然后开始滴定,边滴加边振荡,至滴定终点,记下读数
f.在250 mL的容量瓶中定容,配制成250 mL烧碱溶液
请回答下列问题:
(1)正确操作步骤的顺序是(用字母填空)
(2)下列仪器,实验中不需要的是(填序号)
①托盘天平(带砝码,镊子) ②酸式滴定管 ③碱式滴定管 ④250 mL容量瓶
⑤烧杯 ⑥漏斗 ⑦锥形瓶 ⑧铁架台(带滴定管夹) ⑨药匙
实验中除上述仪器外,还缺少的仪器有(填名称)
(3)滴定至终点,溶液由
(4)重复四次的实验数据如下表所示:
| 实验序号 | 盐酸溶液 /mol·L-1 | 滴定完成时消耗盐酸 溶液体积/mL | 待测烧碱溶液 体积/mL |
| 1 | 1.000 | 19.96 | 25.00 |
| 2 | 1.000 | 19.00 | 25.00 |
| 3 | 1.000 | 20.04 | 25.00 |
| 4 | 1.000 | 20.00 | 25.00 |
根据以上数据,待测烧碱溶液物质的量浓度是
(5)上述实验中,下列操作可能会造成结果偏高的是
A.f操作中,定容时俯视
B.滴定终点读数时仰视
C.使用前,碱式滴定管未用待装液润洗
D.锥形瓶水洗后未干燥就直接盛待测溶液
更新时间:2020-01-05 18:18:08
|
【知识点】 酸碱中和滴定的综合考查解读
相似题推荐
解答题-实验探究题
|
适中
(0.65)
解题方法
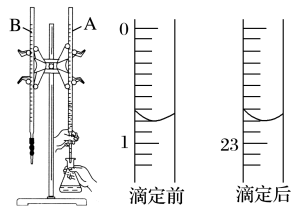
【推荐1】如图是用 的盐酸滴定某未知浓度的NaOH溶液的示意图和某次滴定前、后盛放盐酸的滴定管中液面的位置。
的盐酸滴定某未知浓度的NaOH溶液的示意图和某次滴定前、后盛放盐酸的滴定管中液面的位置。
请回答下列问题:
(1)仪器A的名称是_____ 。
(2)盐酸的体积读数:滴定前读数为_____ mL,滴定后读数为_____ mL。
(3)用酚酞做指示剂,达到滴定终点时的现象_____ 。
(4)某实验小组同学的三次实验的实验数据如下表所示。根据表中数据计算出的待测NaOH溶液的平均浓度是_____  (保留四位有效数字)。
(保留四位有效数字)。
(5)对下列几种假定情况进行讨论:
①取待测液的滴定管,滴定前滴定管尖嘴处有气泡,滴定后气泡消失,对测定结果的影响是_____ (填“偏高”“偏低”或“无影响”,下同);
②若滴定前锥形瓶未用待测液润洗,对测定结果的影响是_____ ;
③标准液读数时,若滴定前俯视,滴定后仰视,对测定结果的影响是_____ 。
 的盐酸滴定某未知浓度的NaOH溶液的示意图和某次滴定前、后盛放盐酸的滴定管中液面的位置。
的盐酸滴定某未知浓度的NaOH溶液的示意图和某次滴定前、后盛放盐酸的滴定管中液面的位置。
请回答下列问题:
(1)仪器A的名称是
(2)盐酸的体积读数:滴定前读数为
(3)用酚酞做指示剂,达到滴定终点时的现象
(4)某实验小组同学的三次实验的实验数据如下表所示。根据表中数据计算出的待测NaOH溶液的平均浓度是
 (保留四位有效数字)。
(保留四位有效数字)。| 实验编号 | 待测NaOH溶液的体积/mL | 滴定前盐酸的体积读数/mL | 滴定后盐酸的体积读数/mL |
| 1 | 20.00 | 1.20 | 23.22 |
| 2 | 20.00 | 1.21 | 29.21 |
| 3 | 20.00 | 1.50 | 23.48 |
(5)对下列几种假定情况进行讨论:
①取待测液的滴定管,滴定前滴定管尖嘴处有气泡,滴定后气泡消失,对测定结果的影响是
②若滴定前锥形瓶未用待测液润洗,对测定结果的影响是
③标准液读数时,若滴定前俯视,滴定后仰视,对测定结果的影响是
您最近一年使用:0次
解答题-实验探究题
|
适中
(0.65)
名校
【推荐2】用酸式滴定管准确移取25.00mL某未知浓度的盐酸溶液于一洁净的锥形瓶中,然后用0.20mol·L -1的氢氧化钠溶液(指示剂为酚酞).滴定结果如下:
(1)准确配制0.20mol·L-1的氢氧化钠溶液250mL,需要的主要仪器除量筒、烧杯、玻璃棒外,还必须用到的仪器有____________________
(2)根据以上数据可以计算出盐酸的物质的量浓度为_____________ mol·L-1.
(3)用0.20mol·L-1标准氢氧化钠溶液滴定待测盐酸溶液,滴定时左手控制碱式滴定管的玻璃球,右手不停摇动锥形瓶,眼睛注视_______________ ,直到滴定终点。
(4)达到滴定终点的标志是_______________________________________________________
(5)以下操作造成测定结果偏高的原因可能是__________________ 。
A. 未用标准液润洗碱式滴定管
B. 滴定终点读数时,俯视滴定管的刻度,其它操作均正确
C. 盛装未知液的锥形瓶用蒸馏水洗过,未用待测液润洗
D. 滴定到终点读数时发现滴定管尖嘴处悬挂一滴溶液
| NaOH起始读数 | NaOH终点读数 | |
| 第一次 | 0.10mL | 18.60mL |
| 第二次 | 0.30mL | 18.00mL |
(2)根据以上数据可以计算出盐酸的物质的量浓度为
(3)用0.20mol·L-1标准氢氧化钠溶液滴定待测盐酸溶液,滴定时左手控制碱式滴定管的玻璃球,右手不停摇动锥形瓶,眼睛注视
(4)达到滴定终点的标志是
(5)以下操作造成测定结果偏高的原因可能是
A. 未用标准液润洗碱式滴定管
B. 滴定终点读数时,俯视滴定管的刻度,其它操作均正确
C. 盛装未知液的锥形瓶用蒸馏水洗过,未用待测液润洗
D. 滴定到终点读数时发现滴定管尖嘴处悬挂一滴溶液
您最近一年使用:0次
解答题-原理综合题
|
适中
(0.65)
解题方法
【推荐3】Ⅰ.在0.1 mol·L-1的重铬酸钾(K2Cr2O7)溶液中存在如下平衡:Cr2O +H2O
+H2O 2HCrO
2HCrO
 2CrO
2CrO +2H+
+2H+
(1)在强碱溶液中,铬元素的主要存在形式为___________ (填离子符号),向重铬酸钾溶液中加入适量稀硫酸,溶液中c(Cr2O )/c(CrO
)/c(CrO )将
)将___________ (填“增大”、“减小”或“不变”)。
Ⅱ.已知某溶液中只存在OH-、H+、 、Cl-四种离子,某同学推测该溶液中各离子浓度大小 顺序可能有如下四种关系:并按要求填写下列空白:
、Cl-四种离子,某同学推测该溶液中各离子浓度大小 顺序可能有如下四种关系:并按要求填写下列空白:
①c(Cl-)>c( )>c(H+)>c(OH-) ②c(Cl-)>c(
)>c(H+)>c(OH-) ②c(Cl-)>c( )>c(OH-)>c(H+)
)>c(OH-)>c(H+)
③c( )>c(Cl-)>c(OH-)>c(H+) ④c(Cl-)>c(H+)>c(
)>c(Cl-)>c(OH-)>c(H+) ④c(Cl-)>c(H+)>c( )>c(OH-)
)>c(OH-)
(2)若溶液中只溶解了一种溶质,则该溶质是___________ ,上述四种离子浓度的大小顺序为___________ (选填序号)。
(3)若上述关系中③是正确的,则溶液中的溶质为___________ ;
(4)若该溶液是由体积相等的稀盐酸和氨水混合而成,且恰好呈中性,则混合前c(HCl)___________ c(NH3·H2O) (填“大于”“小于”或“等于”)。
Ⅲ.用酸碱中和滴定法测定某市售白醋(含 ,是一元弱酸)的总酸量。实验步骤如下:
,是一元弱酸)的总酸量。实验步骤如下:
(5)①量取10.00mL市售白醋,在烧杯中用水稀释后转移到100mL容量瓶中定容,摇匀即得稀释白醋溶液。取该稀释白醋溶液20.00mL于锥形瓶中,向其中滴加几滴___________ 作指示剂。
②用0.1000mol/L NaOH溶液滴定,当___________ 时,停止滴定,并记录NaOH溶液的最终读数。重复滴定4次。
③实验记录如下:
按上述数处理,可得c(市售白醋)=___________ mol/L。
④在本实验的滴定过程中,下列操作会使实验结果偏高的是___________ (填字母)。
A.碱式滴定管在滴定时未用NaOH标准溶液润洗
B.锥形瓶在滴定时剧烈摇动,有少量液体测出
C.锥形瓶中加入待测稀释白醋溶液后,再加少量水
D.碱式滴定管的尖嘴在滴定前有气泡,滴定后气泡消失
E.滴定终点读数时俯视
 +H2O
+H2O 2HCrO
2HCrO
 2CrO
2CrO +2H+
+2H+(1)在强碱溶液中,铬元素的主要存在形式为
 )/c(CrO
)/c(CrO )将
)将Ⅱ.已知某溶液中只存在OH-、H+、
 、Cl-四种离子,某同学推测该溶液中各离子浓度大小 顺序可能有如下四种关系:并按要求填写下列空白:
、Cl-四种离子,某同学推测该溶液中各离子浓度大小 顺序可能有如下四种关系:并按要求填写下列空白:①c(Cl-)>c(
 )>c(H+)>c(OH-) ②c(Cl-)>c(
)>c(H+)>c(OH-) ②c(Cl-)>c( )>c(OH-)>c(H+)
)>c(OH-)>c(H+)③c(
 )>c(Cl-)>c(OH-)>c(H+) ④c(Cl-)>c(H+)>c(
)>c(Cl-)>c(OH-)>c(H+) ④c(Cl-)>c(H+)>c( )>c(OH-)
)>c(OH-)(2)若溶液中只溶解了一种溶质,则该溶质是
(3)若上述关系中③是正确的,则溶液中的溶质为
(4)若该溶液是由体积相等的稀盐酸和氨水混合而成,且恰好呈中性,则混合前c(HCl)
Ⅲ.用酸碱中和滴定法测定某市售白醋(含
 ,是一元弱酸)的总酸量。实验步骤如下:
,是一元弱酸)的总酸量。实验步骤如下:(5)①量取10.00mL市售白醋,在烧杯中用水稀释后转移到100mL容量瓶中定容,摇匀即得稀释白醋溶液。取该稀释白醋溶液20.00mL于锥形瓶中,向其中滴加几滴
②用0.1000mol/L NaOH溶液滴定,当
③实验记录如下:
| 滴定次数 | 1 | 2 | 3 | 4 |
| V(稀释白醋)/mL | 20.00 | 20.00 | 20.00 | 20.00 |
 (NaOH)/mL (NaOH)/mL | 15.00 | 15.04 | 14.96 | 16.52 |
④在本实验的滴定过程中,下列操作会使实验结果偏高的是
A.碱式滴定管在滴定时未用NaOH标准溶液润洗
B.锥形瓶在滴定时剧烈摇动,有少量液体测出
C.锥形瓶中加入待测稀释白醋溶液后,再加少量水
D.碱式滴定管的尖嘴在滴定前有气泡,滴定后气泡消失
E.滴定终点读数时俯视
您最近一年使用:0次



