某同学用NaOH溶液来滴定邻苯二甲酸氢钾溶液有下列操作:
①向溶液中加入1~2滴指示剂
②取20.00 mL标准溶液放入锥形瓶中
③用NaOH溶液滴定至终点(终点时溶液的pH约为9.1)
④重复以上操作
⑤用天平精确称取一定量的邻苯二甲酸氢钾固体配成250 mL标准溶液(测得pH约为4.2)
⑥根据实验数据计算NaOH的物质的量浓度
(1)以上各步中,正确的(填序号)操作顺序是_____________________________ ,上述②中使用的仪器除锥形瓶外,还需要使用的仪器是______________ 。
(2)选用指示剂是______________ ,滴定终点现象______________________________________ 。
(3)滴定,并记录NaOH的终读数.重复滴定几次,数据记录如下表:
某同学在处理数据过程中计算得到平均消耗NaOH溶液的体积为V(NaOH)=(19.98+20.00+20.80+20.02)/4mL=20.20mL,他的计算合理吗?理由是_______________ 。
(4)步骤②中在观察滴定管的起始读数时,要使滴定管的尖嘴部分充满溶液,滴定前用蒸馏水洗净碱式滴定管,然后加NaOH溶液进行滴定,此操作对实验结果________ (填“偏大”、“偏小”或“无影响”)。
①向溶液中加入1~2滴指示剂
②取20.00 mL标准溶液放入锥形瓶中
③用NaOH溶液滴定至终点(终点时溶液的pH约为9.1)
④重复以上操作
⑤用天平精确称取一定量的邻苯二甲酸氢钾固体配成250 mL标准溶液(测得pH约为4.2)
⑥根据实验数据计算NaOH的物质的量浓度
(1)以上各步中,正确的(填序号)操作顺序是
(2)选用指示剂是
(3)滴定,并记录NaOH的终读数.重复滴定几次,数据记录如下表:
| 滴定次数实验数据 | 1 | 2 | 3 | 4 |
| V(样品)/mL | 20.00 | 20.00 | 20.00 | 20.00 |
| V(NaOH)/mL(初读数) | 0.10 | 0.30 | 0.00 | 0.20 |
| V(NaOH)/mL(终读数) | 20.08 | 20.30 | 20.80 | 20.22 |
| V(NaOH)/mL(消耗) | 19.98 | 20.00 | 20.80 | 20.02 |
(4)步骤②中在观察滴定管的起始读数时,要使滴定管的尖嘴部分充满溶液,滴定前用蒸馏水洗净碱式滴定管,然后加NaOH溶液进行滴定,此操作对实验结果
更新时间:2020-01-07 12:47:06
|
相似题推荐
解答题-实验探究题
|
适中
(0.65)
名校
【推荐1】某学生用0.1mol/L KOH溶液滴定未知浓度的盐酸溶液,其操作可分解为如下几步:
(A)移取20.00mL待测的盐酸溶液注入洁净的锥形瓶,并加入2-3滴酚酞;
(B)用标准溶液润洗滴定管2-3次;
(C)把盛有标准溶液的碱式滴定管固定好,调节液面使滴定管尖嘴充满溶液;
(D)取标准KOH溶液注入碱式滴定管至0刻度以上2-3cm;
(E)调节液面至0或0刻度以下,记下读数;
(F)把锥形瓶放在滴定管的下面,用标准KOH溶液滴定至终点,记下滴定管液面的刻度。
完成以下填空:
(1)正确操作的顺序是(用序号字母填写)______________________ 。
(2)实验中用左手控制_________ (填仪器及部位),眼睛注视_______ ,直至滴定终点。判断到达终点的现象是___________ 。
(3)上述(A)操作之前,如先用待测液润洗锥形瓶,则对测定结果的影响是(填偏大、偏小、不变,下同)_________________________ 。
(4)若称取一定量的KOH固体(含少量NaOH)配制标准溶液并用来滴定上述盐酸,则对测定结果的影响是____________ 。
(5)滴定结束后如仰视观察滴定管中液面刻度,则对滴定结果的影响是______ 。
(A)移取20.00mL待测的盐酸溶液注入洁净的锥形瓶,并加入2-3滴酚酞;
(B)用标准溶液润洗滴定管2-3次;
(C)把盛有标准溶液的碱式滴定管固定好,调节液面使滴定管尖嘴充满溶液;
(D)取标准KOH溶液注入碱式滴定管至0刻度以上2-3cm;
(E)调节液面至0或0刻度以下,记下读数;
(F)把锥形瓶放在滴定管的下面,用标准KOH溶液滴定至终点,记下滴定管液面的刻度。
完成以下填空:
(1)正确操作的顺序是(用序号字母填写)
(2)实验中用左手控制
(3)上述(A)操作之前,如先用待测液润洗锥形瓶,则对测定结果的影响是(填偏大、偏小、不变,下同)
(4)若称取一定量的KOH固体(含少量NaOH)配制标准溶液并用来滴定上述盐酸,则对测定结果的影响是
(5)滴定结束后如仰视观察滴定管中液面刻度,则对滴定结果的影响是
您最近一年使用:0次
解答题-实验探究题
|
适中
(0.65)
解题方法
【推荐2】如图是用 的盐酸滴定某未知浓度的NaOH溶液的示意图和某次滴定前、后盛放盐酸的滴定管中液面的位置。
的盐酸滴定某未知浓度的NaOH溶液的示意图和某次滴定前、后盛放盐酸的滴定管中液面的位置。
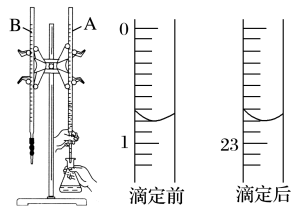
请回答下列问题:
(1)仪器A的名称是_____ 。
(2)盐酸的体积读数:滴定前读数为_____ mL,滴定后读数为_____ mL。
(3)用酚酞做指示剂,达到滴定终点时的现象_____ 。
(4)某实验小组同学的三次实验的实验数据如下表所示。根据表中数据计算出的待测NaOH溶液的平均浓度是_____  (保留四位有效数字)。
(保留四位有效数字)。
(5)对下列几种假定情况进行讨论:
①取待测液的滴定管,滴定前滴定管尖嘴处有气泡,滴定后气泡消失,对测定结果的影响是_____ (填“偏高”“偏低”或“无影响”,下同);
②若滴定前锥形瓶未用待测液润洗,对测定结果的影响是_____ ;
③标准液读数时,若滴定前俯视,滴定后仰视,对测定结果的影响是_____ 。
 的盐酸滴定某未知浓度的NaOH溶液的示意图和某次滴定前、后盛放盐酸的滴定管中液面的位置。
的盐酸滴定某未知浓度的NaOH溶液的示意图和某次滴定前、后盛放盐酸的滴定管中液面的位置。
请回答下列问题:
(1)仪器A的名称是
(2)盐酸的体积读数:滴定前读数为
(3)用酚酞做指示剂,达到滴定终点时的现象
(4)某实验小组同学的三次实验的实验数据如下表所示。根据表中数据计算出的待测NaOH溶液的平均浓度是
 (保留四位有效数字)。
(保留四位有效数字)。| 实验编号 | 待测NaOH溶液的体积/mL | 滴定前盐酸的体积读数/mL | 滴定后盐酸的体积读数/mL |
| 1 | 20.00 | 1.20 | 23.22 |
| 2 | 20.00 | 1.21 | 29.21 |
| 3 | 20.00 | 1.50 | 23.48 |
(5)对下列几种假定情况进行讨论:
①取待测液的滴定管,滴定前滴定管尖嘴处有气泡,滴定后气泡消失,对测定结果的影响是
②若滴定前锥形瓶未用待测液润洗,对测定结果的影响是
③标准液读数时,若滴定前俯视,滴定后仰视,对测定结果的影响是
您最近一年使用:0次
解答题-实验探究题
|
适中
(0.65)
名校
【推荐3】H2O2是医药、卫生行业上广泛使用的消毒剂。某课外小组采用滴定法测定某医用消毒剂中H2O2的浓度。实验步骤如下:
①标准液的配制和标定:称取一定量KMnO4固体溶于水,避光放置6~10天,过滤并取滤液于滴定管中待用,称取mgNa2C2O4固体于锥形瓶中,加水溶解,再加H2SO4酸化,滴定至终点,消耗KMnO4溶液的体积V1mL。滴定过程中发生的一个反应为:5H2C2O4+2MnO +6H+=2Mn2++10CO2↑+8H2O。
+6H+=2Mn2++10CO2↑+8H2O。
②H2O2浓度的测定:取待测样品25mL稀释至500mL,再移取10.00mL于锥形瓶中,加H2SO4酸化,用上述KMnO4标准液滴定至终点,消耗溶液的体积V2mL。
回答下列问题:
(1)②中移取10.00mL待测液所用主要仪器名称为___ 。
(2)配制KMnO4标准液时需要久置并过滤掉变质生成的MnO2,该过滤操作需用___ 。
a.普通漏斗和滤纸
b.布氏漏斗和滤纸
c.不需滤纸的微孔玻璃漏斗
(3)在恒定温度下进行滴定操作时,开始时反应速率较慢,随后加快,导致速率加快的原因是__ 。
(4)KMnO4标准液滴定H2O2的离子方程式为___ ;当滴定到____ 可以认为已达到滴定终点。
(5)该医生消毒剂中H2O2的物质的量浓度为___ mol·L-1。
(6)②中若用盐酸代替H2SO4测定结果将__ (填“偏高”“偏低”或“无影响”)。
①标准液的配制和标定:称取一定量KMnO4固体溶于水,避光放置6~10天,过滤并取滤液于滴定管中待用,称取mgNa2C2O4固体于锥形瓶中,加水溶解,再加H2SO4酸化,滴定至终点,消耗KMnO4溶液的体积V1mL。滴定过程中发生的一个反应为:5H2C2O4+2MnO
 +6H+=2Mn2++10CO2↑+8H2O。
+6H+=2Mn2++10CO2↑+8H2O。②H2O2浓度的测定:取待测样品25mL稀释至500mL,再移取10.00mL于锥形瓶中,加H2SO4酸化,用上述KMnO4标准液滴定至终点,消耗溶液的体积V2mL。
回答下列问题:
(1)②中移取10.00mL待测液所用主要仪器名称为
(2)配制KMnO4标准液时需要久置并过滤掉变质生成的MnO2,该过滤操作需用
a.普通漏斗和滤纸
b.布氏漏斗和滤纸
c.不需滤纸的微孔玻璃漏斗
(3)在恒定温度下进行滴定操作时,开始时反应速率较慢,随后加快,导致速率加快的原因是
(4)KMnO4标准液滴定H2O2的离子方程式为
(5)该医生消毒剂中H2O2的物质的量浓度为
(6)②中若用盐酸代替H2SO4测定结果将
您最近一年使用:0次
解答题-实验探究题
|
适中
(0.65)
【推荐1】实验室中有一未知浓度的稀盐酸,其某学生在实验室中进行测定盐酸浓度的实验。请完成下列填空:
(1)配制250mL0.1000mol•L-1标准溶液。配制所需的玻璃仪器有:烧杯、量筒、玻璃棒、__ 、__ 。
(2)取20.00mL待测稀盐酸放入锥形瓶中,并滴加2~3滴酚酞作指示剂,用__ (填仪器名称)盛装配制的标准NaOH溶液进行滴定。重复上述滴定操作3次,记录数据如下:
(3)滴定时,应该左手控制滴定管,右手控制锥形瓶,眼睛__ 。
(4)①判断达到滴定终点的方法是__ 。
②根据上述数据,可计算出该盐酸的浓度约为__ mol•L-1。
(5)在上述实验中,下列操作(其他操作正确)会造成测定结果偏低的有__ (填字母)。
(1)配制250mL0.1000mol•L-1标准溶液。配制所需的玻璃仪器有:烧杯、量筒、玻璃棒、
(2)取20.00mL待测稀盐酸放入锥形瓶中,并滴加2~3滴酚酞作指示剂,用
| 滴定次数 | 待测盐酸的体积/mL | 标准NaOH溶液体积 | |
| 滴定前的刻度/mL | 滴定后的刻度/mL | ||
| 第一次 | 20.00 | 0.39 | 20.39 |
| 第二次 | 20.00 | 4.90 | 24.90 |
| 第三次 | 20.00 | 1.00 | 24.00 |
(4)①判断达到滴定终点的方法是
②根据上述数据,可计算出该盐酸的浓度约为
(5)在上述实验中,下列操作(其他操作正确)会造成测定结果偏低的有
| A.酸式滴定管使用前,水洗后未用待测盐酸润洗 |
| B.锥形瓶水洗后未干燥 |
| C.滴定终点读数时俯视读数 |
| D.碱式滴定管尖嘴部分有气泡滴定后消失 |
您最近一年使用:0次
解答题-实验探究题
|
适中
(0.65)
【推荐2】已知 在家用清洁剂(45%溶液)、降低游泳池水的碱度等方面有重要应用。现有一批
在家用清洁剂(45%溶液)、降低游泳池水的碱度等方面有重要应用。现有一批 样品,欲测定其纯度,实验操作如下:
样品,欲测定其纯度,实验操作如下:
称取 样品,配成
样品,配成 溶液,每次取出
溶液,每次取出 配制的溶液,用
配制的溶液,用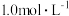 的
的 标准溶液滴定,测得的实验数据如下表:
标准溶液滴定,测得的实验数据如下表:
(1)配制 溶液所需的玻璃仪器主要有玻璃棒、烧杯、
溶液所需的玻璃仪器主要有玻璃棒、烧杯、_______ 、_______ 。
(2) 溶液显
溶液显_______ 性;可用_______ (填“a”或“b”)量取 溶液。
溶液。

(3)本实验可用_______ 作指示剂,达到滴定终点时的现象是_______ 。
(4) 样品的纯度为
样品的纯度为_______ 。
(5)下列操作会导致测定结果偏高的是_______(填标号)。
(6)若样品中只混有 ,欲用沉淀法测其纯度,则还需要知道哪些数据?
,欲用沉淀法测其纯度,则还需要知道哪些数据?_______ 。简述你的设计思路:_______ 。
 在家用清洁剂(45%溶液)、降低游泳池水的碱度等方面有重要应用。现有一批
在家用清洁剂(45%溶液)、降低游泳池水的碱度等方面有重要应用。现有一批 样品,欲测定其纯度,实验操作如下:
样品,欲测定其纯度,实验操作如下:称取
 样品,配成
样品,配成 溶液,每次取出
溶液,每次取出 配制的溶液,用
配制的溶液,用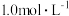 的
的 标准溶液滴定,测得的实验数据如下表:
标准溶液滴定,测得的实验数据如下表:| 序号 | 1 | 2 | 3 | 4 |
消耗标准溶液体积/ | 20.05 | 18.40 | 19.95 | 20.00 |
 溶液所需的玻璃仪器主要有玻璃棒、烧杯、
溶液所需的玻璃仪器主要有玻璃棒、烧杯、(2)
 溶液显
溶液显 溶液。
溶液。
(3)本实验可用
(4)
 样品的纯度为
样品的纯度为(5)下列操作会导致测定结果偏高的是_______(填标号)。
| A.滴定前滴定管中有气泡,滴定后气泡消失 |
B.用碱式滴定管量取 溶液时,未进行润洗操作 溶液时,未进行润洗操作 |
| C.滴定达到滴定终点时俯视读数 |
D.锥形瓶在取用 待测液前用少量水洗涤 待测液前用少量水洗涤 |
 ,欲用沉淀法测其纯度,则还需要知道哪些数据?
,欲用沉淀法测其纯度,则还需要知道哪些数据?
您最近一年使用:0次
解答题-实验探究题
|
适中
(0.65)
解题方法
【推荐3】邻苯二甲酸氢钾(化学式可表示为KHC8H4O4),可以用于标定NaOH溶液的的浓度。反应如下: KHC8H4O4+NaOH=KNaC8H4O4+ H2O。
已知:①常温下0.1 mol/L邻苯二甲酸溶液的Ka1=1.1×10-3,Ka2=3.9×10-6
②邻苯二甲酸氢钾溶液的pH<7。
请回答以下问题:
(1)写出邻苯二甲酸在水溶液中的电离方程式_______ 。
(2)邻苯二甲酸氢钾溶液pH<7的原因是_______ 。
(3)NaOH溶液滴定邻苯二甲酸氢钾溶液,混合溶液的相对导电能力变化曲线如图所示,其中b点为反应终点。

下列叙述错误的是_______ 。
A.混合溶液的导电能力与离子浓度和种类有关。
B. Na+与 的导电能力之和大于
的导电能力之和大于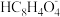 的导电能力
的导电能力
C.b点的混合溶液pH=7
D. c点的混合溶液中,c(Na+)>c(K+)>c(OH-)
(4)用已经标定浓度的NaOH溶液测定食醋的总酸含量。步骤如下:
用移液管移取市售食醋25.00 mL,置于250 mL容量瓶中,用水稀释至刻度,再从中移取25.00 mL,用经标定浓度的NaOH溶液进行滴定。
①“用移液管移取市售食醋25.00 mL,置于250 mL容量瓶中,用水稀释至刻度。再从中移取25.00 mL,这样操作的目的:一是稀释有助于减小食醋的颜色对滴定终点颜色的干扰;二是_______ 。
②滴定操作可以分解为如下几步,正确的操作步骤顺序是_______ 。
a.移取25.00 mL待测醋酸溶液注入洁净的锥形瓶中,并加入2~ 3滴酚酞溶液
b.用标准NaOH溶液润洗碱式滴定管2-3次
c.把盛有NaOH溶液的滴定管固定好,调节滴定管尖嘴使之充满溶液
d.取标准NaOH溶液注入碱式滴定管至“0”刻度以上2~3 mL
e.调节液面至“0”或“0”刻度以下,记下读数
f.把锥形瓶放在滴定管的下面,用标准溶液滴定至终点并记下读数
③下图中显示滴定终点时的度数是___ mL。

④滴定前滴定管尖嘴内无气泡,滴定后尖嘴内有气泡,则测得食醋的总酸含量_ (填 “偏高”、 “偏低”、“无影响”或“难以确定" )。
已知:①常温下0.1 mol/L邻苯二甲酸溶液的Ka1=1.1×10-3,Ka2=3.9×10-6
②邻苯二甲酸氢钾溶液的pH<7。
请回答以下问题:
(1)写出邻苯二甲酸在水溶液中的电离方程式
(2)邻苯二甲酸氢钾溶液pH<7的原因是
(3)NaOH溶液滴定邻苯二甲酸氢钾溶液,混合溶液的相对导电能力变化曲线如图所示,其中b点为反应终点。

下列叙述错误的是
A.混合溶液的导电能力与离子浓度和种类有关。
B. Na+与
 的导电能力之和大于
的导电能力之和大于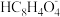 的导电能力
的导电能力C.b点的混合溶液pH=7
D. c点的混合溶液中,c(Na+)>c(K+)>c(OH-)
(4)用已经标定浓度的NaOH溶液测定食醋的总酸含量。步骤如下:
用移液管移取市售食醋25.00 mL,置于250 mL容量瓶中,用水稀释至刻度,再从中移取25.00 mL,用经标定浓度的NaOH溶液进行滴定。
①“用移液管移取市售食醋25.00 mL,置于250 mL容量瓶中,用水稀释至刻度。再从中移取25.00 mL,这样操作的目的:一是稀释有助于减小食醋的颜色对滴定终点颜色的干扰;二是
②滴定操作可以分解为如下几步,正确的操作步骤顺序是
a.移取25.00 mL待测醋酸溶液注入洁净的锥形瓶中,并加入2~ 3滴酚酞溶液
b.用标准NaOH溶液润洗碱式滴定管2-3次
c.把盛有NaOH溶液的滴定管固定好,调节滴定管尖嘴使之充满溶液
d.取标准NaOH溶液注入碱式滴定管至“0”刻度以上2~3 mL
e.调节液面至“0”或“0”刻度以下,记下读数
f.把锥形瓶放在滴定管的下面,用标准溶液滴定至终点并记下读数
③下图中显示滴定终点时的度数是

④滴定前滴定管尖嘴内无气泡,滴定后尖嘴内有气泡,则测得食醋的总酸含量
您最近一年使用:0次



