某学习小组用碳素钢进行了以下探究活动:
[探究一](1)将已去除表面氧化膜的碳素钢钉放入冷浓硫酸中,10min后将钢钉浸入CuSO4溶液中,钢钉表面无明显变化,其原因是______ .
(2)称取6.0g碳素钢放入15.0ml浓硫酸中,加热,充分反应后得到溶液X并收集到混合气体Y.
①甲同学认为X中除Fe3+之外还可能含有Fe2+,若要确认是否含有Fe2+,可选用______  选填序号
选填序号 .
.
A.KSCN溶液 B.浓氨水 C.酸性KMnO4溶液 D.K3[Fe(CN)6]溶液
②乙同学取560ml(标准状况)干燥气体Y通入足量溴水中,然后加入足量BaCl2溶液,经适当操作后得到干燥固体4.66g,由此可知Y中含硫化合物Q1的体积分数为______ .
[探究二]丙同学认为气体Y中还可能含有Q2、Q3两种气体(相同条件下Q1、Q2、Q3气体的密度依次减小).为此,设计了下列装置进行实验探究(假设有关气体完全反应).
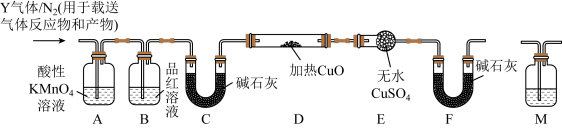
(3)装置B中试剂的作用是______ .
(4)已知洗气瓶M中盛装的是澄清石灰水,为确认Q2的存在,洗气瓶M的位置应在______ ,产生Q2的反应的化学方程式为 ______ .
(5)确认含有气体Q3的实验现象是______ ,产生Q3的反应的离子方程式为 ______ .
[探究一](1)将已去除表面氧化膜的碳素钢钉放入冷浓硫酸中,10min后将钢钉浸入CuSO4溶液中,钢钉表面无明显变化,其原因是
(2)称取6.0g碳素钢放入15.0ml浓硫酸中,加热,充分反应后得到溶液X并收集到混合气体Y.
①甲同学认为X中除Fe3+之外还可能含有Fe2+,若要确认是否含有Fe2+,可选用
 选填序号
选填序号 .
.A.KSCN溶液 B.浓氨水 C.酸性KMnO4溶液 D.K3[Fe(CN)6]溶液
②乙同学取560ml(标准状况)干燥气体Y通入足量溴水中,然后加入足量BaCl2溶液,经适当操作后得到干燥固体4.66g,由此可知Y中含硫化合物Q1的体积分数为
[探究二]丙同学认为气体Y中还可能含有Q2、Q3两种气体(相同条件下Q1、Q2、Q3气体的密度依次减小).为此,设计了下列装置进行实验探究(假设有关气体完全反应).
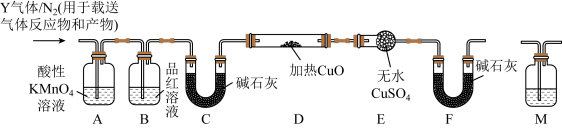
(3)装置B中试剂的作用是
(4)已知洗气瓶M中盛装的是澄清石灰水,为确认Q2的存在,洗气瓶M的位置应在
(5)确认含有气体Q3的实验现象是
更新时间:2020-01-07 10:24:39
|
相似题推荐
解答题-实验探究题
|
较难
(0.4)
【推荐1】以废铁屑(含少量 、
、 等杂质)为原料,制备硫酸亚铁晶体
等杂质)为原料,制备硫酸亚铁晶体 ,流程示意图如下。
,流程示意图如下。

已知: 晶体受热易失水。
晶体受热易失水。
(1) 的电离方程式是
的电离方程式是___________ 。
(2)酸浸过程中, 的作用是
的作用是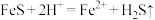 、
、___________ (用离子方程式表示)。
(3)酸浸时间对所得溶液的成分影响如下表所示。
① 时检验,溶液变红,说明所得溶液中含有
时检验,溶液变红,说明所得溶液中含有___________ 。
② 时检验,用离子方程式表示溶液未变红的原因
时检验,用离子方程式表示溶液未变红的原因___________ 。
③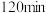 时检验,溶液复又变红,用离子方程式说明原因
时检验,溶液复又变红,用离子方程式说明原因___________ 。
④操作X是___________ 。
(4)测定所得硫酸亚铁晶体中 的含量,步骤如下:
的含量,步骤如下:
Ⅰ:称取 硫酸亚铁晶体样品,配制成
硫酸亚铁晶体样品,配制成 溶液。
溶液。
Ⅱ:取出 溶液,加入适量稀硫酸,滴入
溶液,加入适量稀硫酸,滴入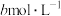 的
的 溶液,至反应完全共消耗
溶液,至反应完全共消耗 溶液
溶液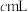 。
。
①Ⅰ中配制溶液用到的玻璃仪器有烧杯、玻璃棒、胶头滴管和___________ 。
②Ⅱ中 氧化
氧化 的离子方程式是
的离子方程式是___________ 。
③计算硫酸亚铁晶体样品中 的质量分数
的质量分数___________ 。
 、
、 等杂质)为原料,制备硫酸亚铁晶体
等杂质)为原料,制备硫酸亚铁晶体 ,流程示意图如下。
,流程示意图如下。
已知:
 晶体受热易失水。
晶体受热易失水。(1)
 的电离方程式是
的电离方程式是(2)酸浸过程中,
 的作用是
的作用是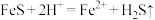 、
、(3)酸浸时间对所得溶液的成分影响如下表所示。
酸浸时间 |
|
|
|
用KSCN溶液检验 | 变红 | 未变红 | 变红 |
 时检验,溶液变红,说明所得溶液中含有
时检验,溶液变红,说明所得溶液中含有②
 时检验,用离子方程式表示溶液未变红的原因
时检验,用离子方程式表示溶液未变红的原因③
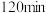 时检验,溶液复又变红,用离子方程式说明原因
时检验,溶液复又变红,用离子方程式说明原因④操作X是
(4)测定所得硫酸亚铁晶体中
 的含量,步骤如下:
的含量,步骤如下:Ⅰ:称取
 硫酸亚铁晶体样品,配制成
硫酸亚铁晶体样品,配制成 溶液。
溶液。Ⅱ:取出
 溶液,加入适量稀硫酸,滴入
溶液,加入适量稀硫酸,滴入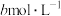 的
的 溶液,至反应完全共消耗
溶液,至反应完全共消耗 溶液
溶液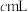 。
。①Ⅰ中配制溶液用到的玻璃仪器有烧杯、玻璃棒、胶头滴管和
②Ⅱ中
 氧化
氧化 的离子方程式是
的离子方程式是③计算硫酸亚铁晶体样品中
 的质量分数
的质量分数
您最近一年使用:0次
解答题-实验探究题
|
较难
(0.4)
解题方法
【推荐2】I.NH3在工业生产上有重要的应用
(1)写出用浓氨水检验氯气管道泄漏的化学反应方程式____________
(2)若将少量氨气与过量氯气混合,则生成一种酸和另一种化合物A,A中所有原子均满足8电子稳定结构,试写出A的电子式______________ ;A在一定条件下能与水反应,可用于饮用水的消毒,试写出此反应的化学反应方程式____________
II.某白色固体甲常用于织物的漂白,也能将污水中的某些重金属离子还原为单质除去。为研究其组成,某小组同学进行了如下实验。
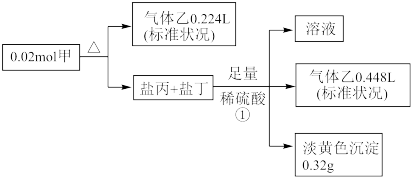
又知,甲的焰色为黄色,盐丙和丁的组成元素和甲相同,乙能使品红溶液褪色,①处气体体积在充分加热挥发后经干燥测定
(1)甲中所含阳离子的结构示意图_____________ ,甲的化学式____________
(2)写出①中产生黄色沉淀的反应的离子反应方程式____________
(3)乙能使品红溶液褪色的原因是____________
(4)甲的溶液还可用作分析化学中的吸氧剂,假设其溶液与少量氧气反应产生等物质的量的两种酸式盐,试写出该反应的化学反应方程式____________
(5)下列物质中可能在溶液中与甲反应的是____________
(1)写出用浓氨水检验氯气管道泄漏的化学反应方程式
(2)若将少量氨气与过量氯气混合,则生成一种酸和另一种化合物A,A中所有原子均满足8电子稳定结构,试写出A的电子式
II.某白色固体甲常用于织物的漂白,也能将污水中的某些重金属离子还原为单质除去。为研究其组成,某小组同学进行了如下实验。

又知,甲的焰色为黄色,盐丙和丁的组成元素和甲相同,乙能使品红溶液褪色,①处气体体积在充分加热挥发后经干燥测定
(1)甲中所含阳离子的结构示意图
(2)写出①中产生黄色沉淀的反应的离子反应方程式
(3)乙能使品红溶液褪色的原因是
(4)甲的溶液还可用作分析化学中的吸氧剂,假设其溶液与少量氧气反应产生等物质的量的两种酸式盐,试写出该反应的化学反应方程式
(5)下列物质中可能在溶液中与甲反应的是
| A.NaI | B.Cl2 | C.AgNO3 | D.NaOH |
您最近一年使用:0次
解答题-实验探究题
|
较难
(0.4)
【推荐3】氮化硼(BN)是一种新型无机非金属材料,不溶于冷水。常用硼砂-氯化铵法制备氮化硼,实验步骤如下:
步骤1:原料预处理。硼砂(Na2B4O7·10H2O)在真空中200~400°C脱水;提纯氯化铵。
步骤2:将粉碎和干燥的硼砂与氯化铵以7:3的质量比混合,压成坯块。
步骤3:在900~1000°C下通入氨气充分反应。
步骤4:分离、提纯产品。
回答下列问题:
(1)步骤1中硼砂脱水的目的是_______ 。
(2)某小组设计图1装置完成步骤3。
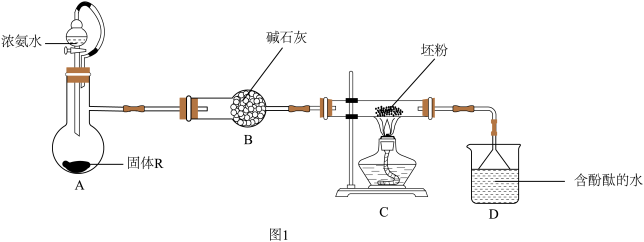
①固体R是_______ (填化学式)。
②有人认为应选择图2仪器替代酒精灯,他的理由是_______ 。改进后完成实验。
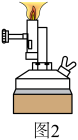
③实验时,先启动装置A中反应,当_______ (填实验现象)时点燃装置C中加热仪器。
④写出装置C中发生反应的化学方程式:_______ 。
(3)步骤4中分离、提纯产品的方法是_______ 。
(4)测定产品纯度(只含NaCl杂质)。称取wg产品溶于水,过滤。将滤液配制成250mL溶液,准确量取25.00mL配制的溶液于锥形瓶,加入V1mLc1mol·L-1AgNO3溶液,充分反应后,加入适量硝基苯(包裹AgC1),再滴加几滴指示剂X,用c2mol·L-1NH4SCN溶液滴定至终点,消耗滴定液V2mL。已知:室温下,Ksp(AgC1)=1.8×10-10,Ksp(AgSCN)=1.2×10-12。
①指示剂X是_______ (填化学式)。
②该产品纯度为_______ (用代数式表示)。
③若不加硝基苯,测得产品纯度_______ (填“偏高”“偏低”或“无影响”)。
步骤1:原料预处理。硼砂(Na2B4O7·10H2O)在真空中200~400°C脱水;提纯氯化铵。
步骤2:将粉碎和干燥的硼砂与氯化铵以7:3的质量比混合,压成坯块。
步骤3:在900~1000°C下通入氨气充分反应。
步骤4:分离、提纯产品。
回答下列问题:
(1)步骤1中硼砂脱水的目的是
(2)某小组设计图1装置完成步骤3。

①固体R是
②有人认为应选择图2仪器替代酒精灯,他的理由是

③实验时,先启动装置A中反应,当
④写出装置C中发生反应的化学方程式:
(3)步骤4中分离、提纯产品的方法是
(4)测定产品纯度(只含NaCl杂质)。称取wg产品溶于水,过滤。将滤液配制成250mL溶液,准确量取25.00mL配制的溶液于锥形瓶,加入V1mLc1mol·L-1AgNO3溶液,充分反应后,加入适量硝基苯(包裹AgC1),再滴加几滴指示剂X,用c2mol·L-1NH4SCN溶液滴定至终点,消耗滴定液V2mL。已知:室温下,Ksp(AgC1)=1.8×10-10,Ksp(AgSCN)=1.2×10-12。
①指示剂X是
②该产品纯度为
③若不加硝基苯,测得产品纯度
您最近一年使用:0次
解答题-实验探究题
|
较难
(0.4)
名校
【推荐1】POCl3常用作半导体掺杂剂及光导纤维原料,实验室制备POCl3并测定产品含量的实验过程如下:
I.实验室制备POCl3。采用氧气氧化液态PCl3法制取POCl3,实验装置(加热及夹持仪器略)如图:
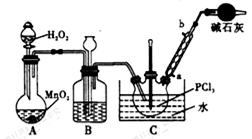
资料:①Ag++SCN-=AgSCN↓:Ksp(AgCl)>Ksp(Ag SCN);
②PCl3和POCl3的相关信息如下表:
(1) 装置B中的作用是观察氧气的流速和______________ 、_______________ ,干燥管的作用是_____________
(2)反应温度要控制在60~65℃,原因是:________________________________________________
II.测定POCl3产品的含量。
实验步骤:
①制备POCl3实验结束后,待三颈瓶中的液体冷却至室温,准确称取30.7 g产品(杂质不含氯元素),置于盛有60.00 mL蒸馏水的水解瓶中摇动至完全水解,将水解液配成100.00 mL 溶液。
②取10.00 mL溶液于锥形瓶中,加入10.00 mL 3.2 mol/L AgNO3标准溶液。
③加入少许硝基苯用力摇动,使沉淀表面被有机物覆盖。
④以X为指示剂,用0.2 mol/L KSCN 溶液滴定过量的AgNO3溶液,达到滴定终点时共用去10.00 mL KSCN 溶液。
(3)实验室用5.0 mol/L AgNO3 配制100 mL 3.2 mol/L AgNO3标准溶液,所使用的仪器除烧杯和玻璃棒外还有_____________________
(4)步骤③若不加入硝基苯的将导致测量结果_____ (填偏高、偏低或无影响)
(5)步骤④中X可以选择_____ 。
(6)反应中POCl3的质量百分含量为_____ ,通过_____ (填操作)可以提高产品的纯度。
I.实验室制备POCl3。采用氧气氧化液态PCl3法制取POCl3,实验装置(加热及夹持仪器略)如图:

资料:①Ag++SCN-=AgSCN↓:Ksp(AgCl)>Ksp(Ag SCN);
②PCl3和POCl3的相关信息如下表:
| 物质 | 熔点/℃ | 沸点/℃ | 相对分子质量 | 其他 |
| PCl3 | -112.0 | 76.0 | 137.5 | 两者互溶,均为无色液体,遇水均剧烈反应生成含氧酸和氯化氢 |
| POCl3 | 2.0 | 106.0 | 153.5 |
(2)反应温度要控制在60~65℃,原因是:
II.测定POCl3产品的含量。
实验步骤:
①制备POCl3实验结束后,待三颈瓶中的液体冷却至室温,准确称取30.7 g产品(杂质不含氯元素),置于盛有60.00 mL蒸馏水的水解瓶中摇动至完全水解,将水解液配成100.00 mL 溶液。
②取10.00 mL溶液于锥形瓶中,加入10.00 mL 3.2 mol/L AgNO3标准溶液。
③加入少许硝基苯用力摇动,使沉淀表面被有机物覆盖。
④以X为指示剂,用0.2 mol/L KSCN 溶液滴定过量的AgNO3溶液,达到滴定终点时共用去10.00 mL KSCN 溶液。
(3)实验室用5.0 mol/L AgNO3 配制100 mL 3.2 mol/L AgNO3标准溶液,所使用的仪器除烧杯和玻璃棒外还有
(4)步骤③若不加入硝基苯的将导致测量结果
(5)步骤④中X可以选择
(6)反应中POCl3的质量百分含量为
您最近一年使用:0次
解答题-工业流程题
|
较难
(0.4)
名校
解题方法
【推荐2】I.一氯甲烷(CH3C1)是一种重要的化工原料,常温下它是无色有毒气体,微溶于水,易溶于乙醇、CCl4等.某同学在实验室用下图所示装置模拟催化法制备和收集一氯甲烷.

(1)无水ZnCl2为催化剂,a瓶中发生反应的化学方程式为__________________________
(2)装置B的主要作用是____________________
(3)收集到的CH3Cl气体在氧气中充分燃烧,产物用过量的V1mL、c1mol•L﹣1NaOH溶液充分吸收,以甲基橙作指示剂,用c2 mol•L﹣1盐酸标准液对吸收液进行返滴定(发生的反应为:NaOH+HCl=NaCl+H2O,Na2CO3+2HCl=2NaCl+2CO2↑+2H2O),最终消耗V2mL盐酸.则所收集CH3Cl的物质的量为_______ mol.
(已知:2CH3Cl+3O2 2CO2+2H2O+2HCl)
2CO2+2H2O+2HCl)
II. 锂/磷酸氧铜电池是一种以磷酸氧铜作为正极材料的锂离子电池,其正极的活性物质是Cu4O(PO4)2,制备流程如下:

主要反应原理:2Na3PO4+4CuSO4+2NH3·H2O==Cu4O(PO4)2↓+3Na2SO4+(NH4)2SO4+H2O
(1)实验室进行“过滤”操作使用的玻璃仪器除烧杯外主要有____________________________________ 。
(2)流程中“洗涤Ⅰ”后,检验沉淀已洗涤干净的方法是________________________________________ 。

(1)无水ZnCl2为催化剂,a瓶中发生反应的化学方程式为
(2)装置B的主要作用是
(3)收集到的CH3Cl气体在氧气中充分燃烧,产物用过量的V1mL、c1mol•L﹣1NaOH溶液充分吸收,以甲基橙作指示剂,用c2 mol•L﹣1盐酸标准液对吸收液进行返滴定(发生的反应为:NaOH+HCl=NaCl+H2O,Na2CO3+2HCl=2NaCl+2CO2↑+2H2O),最终消耗V2mL盐酸.则所收集CH3Cl的物质的量为
(已知:2CH3Cl+3O2
 2CO2+2H2O+2HCl)
2CO2+2H2O+2HCl)II. 锂/磷酸氧铜电池是一种以磷酸氧铜作为正极材料的锂离子电池,其正极的活性物质是Cu4O(PO4)2,制备流程如下:

主要反应原理:2Na3PO4+4CuSO4+2NH3·H2O==Cu4O(PO4)2↓+3Na2SO4+(NH4)2SO4+H2O
(1)实验室进行“过滤”操作使用的玻璃仪器除烧杯外主要有
(2)流程中“洗涤Ⅰ”后,检验沉淀已洗涤干净的方法是
您最近一年使用:0次
解答题-实验探究题
|
较难
(0.4)
【推荐3】二氯化二硫(S2Cl2)在工业上用于橡胶的硫化,还可以作为贵金属的萃取剂,可由硫和氯气在100-110℃直接化合而成。实验室用以下装置制备S2Cl2并对尾气进行回收利用。已知S2Cl2的熔点:-77℃,沸点:137℃。S2Cl2遇水剧烈反应。
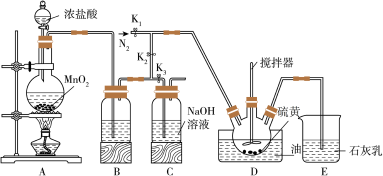
(1)S2Cl2遇水会生成黄色单质、一种能使品红褪色的气体化合物及酸雾,写出该反应的化学方程式_______________________________________________ 。
(2)B中所装试剂名称为___________________________________________________ 。
(3)通入N2的目的是________________________________________ 。A、B装置中的空气可以通过控制K2、K3来去除,具体方法为____________________________ 。
(4)装置E的作用是________________________________________ 。
(5)实验时,D装置开始需要油浴加热一段时间,之后停止加热,仅需通入氯气即可。则生成二氯化二硫的反应为_________________________ (填“放热”或“吸热” )反应。
(6)该装置由于存在系统缺陷,使制得的二氯化二硫可能不纯,还需增加一个装置,则该装置所在位置为_______________ ,所装固体试剂的名称为_______________ 。

(1)S2Cl2遇水会生成黄色单质、一种能使品红褪色的气体化合物及酸雾,写出该反应的化学方程式
(2)B中所装试剂名称为
(3)通入N2的目的是
(4)装置E的作用是
(5)实验时,D装置开始需要油浴加热一段时间,之后停止加热,仅需通入氯气即可。则生成二氯化二硫的反应为
(6)该装置由于存在系统缺陷,使制得的二氯化二硫可能不纯,还需增加一个装置,则该装置所在位置为
您最近一年使用:0次



