有一固体混合物,可能由Na2CO3、Na2SO4、CuSO4、CaCl2、NaOH等混合而成,为检验它们,做了如下实验:
①取少量固体混合物溶于蒸馏水,搅拌后得无色透明溶液:
②取少量上述溶液中滴加Ba(NO3)2溶液至过量,有白色沉淀生成;
③过滤,将沉淀物置于足量稀硝酸中,发现沉淀部分溶解。
试判断:
(1)固体混合物中肯定有_______ ,肯定没有______ ,可能有______ 。
(2)写出实验③中的离子方程式:___________ 。
(3)现要对(1)中可能有的物质进行确认,写出你所设计的实验方案(包括具体操作步骤和实验现象)________ 。
①取少量固体混合物溶于蒸馏水,搅拌后得无色透明溶液:
②取少量上述溶液中滴加Ba(NO3)2溶液至过量,有白色沉淀生成;
③过滤,将沉淀物置于足量稀硝酸中,发现沉淀部分溶解。
试判断:
(1)固体混合物中肯定有
(2)写出实验③中的离子方程式:
(3)现要对(1)中可能有的物质进行确认,写出你所设计的实验方案(包括具体操作步骤和实验现象)
更新时间:2020-02-01 21:16:43
|
相似题推荐
【推荐1】二氧化锗是工业制高纯度半导体锗的中间体。工业上用精硫锗矿[主要成分为GeS2(Ge为+4价),还含有少量CuS、Bi2O3和SiO2]制备二氧化锗的一种工艺如图所示:

已知:①GeO2不溶于水和常见稀酸,但能与NaOH反应生成锗酸盐(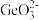 )。
)。
②GeCl4的沸点为84℃,在水中或酸的稀溶液中易水解。
回答下列问题:
(1)“预处理”时进行的操作可能是___________ 。
(2)“煅烧”时生成“气体X”的化学式为___________ 。
(3)“酸浸”时“浸出液A”中含可溶盐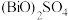 、
、___________ 和少量 ,写出生成
,写出生成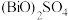 的离子方程式
的离子方程式___________ ,“酸浸”后所得固体的成分为___________ 。
(4)“浸出液B”与浓盐酸反应生成 的化学方程式为
的化学方程式为___________ ,浓盐酸的作用除作为反应物外,还有___________ (任写一条)。
(5)“操作a”的名称为___________ 。

已知:①GeO2不溶于水和常见稀酸,但能与NaOH反应生成锗酸盐(
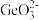 )。
)。②GeCl4的沸点为84℃,在水中或酸的稀溶液中易水解。
回答下列问题:
(1)“预处理”时进行的操作可能是
(2)“煅烧”时生成“气体X”的化学式为
(3)“酸浸”时“浸出液A”中含可溶盐
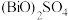 、
、 ,写出生成
,写出生成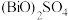 的离子方程式
的离子方程式(4)“浸出液B”与浓盐酸反应生成
 的化学方程式为
的化学方程式为(5)“操作a”的名称为
您最近一年使用:0次
解答题-工业流程题
|
适中
(0.65)
名校
解题方法
【推荐2】海水资源的利用具有非常广阔的前景。下面是海水综合利用联合工业体系的简图:

回答下列问题:
I.海水淡化
(1)人类可以从海水中获得淡水,以解决水资源危机。海水淡化的方法主要有_______ 、_______ 等。
Ⅱ.海水制盐
(2)过程Ⅰ采用的操作是_______ ;
(3)粗盐中可溶性的杂质离子主要有SO 、Mg2+、Ca2+。要除去这些杂质离子得到精盐水,过程Ⅱ依次加入了试剂NaOH溶液、BaCl2溶液、Na2CO3溶液、盐酸,其中Na2CO3溶液的作用是
、Mg2+、Ca2+。要除去这些杂质离子得到精盐水,过程Ⅱ依次加入了试剂NaOH溶液、BaCl2溶液、Na2CO3溶液、盐酸,其中Na2CO3溶液的作用是_______ 。
Ⅲ.海水提溴
(4)工业上从海水中提取溴单质的流程图中,步骤④的离子方程式为_______ ;从理论上考虑下列也能吸收Br2的是_______ 。
A.NaCl B.FeCl2 C. Na2SO3 D. H2O
(5)经过步骤①②已获得Br2,不直接用含Br2的海水进行蒸馏得到液溴,而要经过“空气吹出、SO2吸收、通入氯气”后再蒸馏,其目的是_______ ;
(6)溴在元素周期表中的位置是_______ 。
Ⅳ.海水提镁
(7)该工业生产过程中,为了使MgCl2转化为Mg(OH)2,应加入的试剂为_______ ;
(8)写出电解MgCl2冶炼金属Mg的化学方程式_______ 。

回答下列问题:
I.海水淡化
(1)人类可以从海水中获得淡水,以解决水资源危机。海水淡化的方法主要有
Ⅱ.海水制盐
(2)过程Ⅰ采用的操作是
(3)粗盐中可溶性的杂质离子主要有SO
 、Mg2+、Ca2+。要除去这些杂质离子得到精盐水,过程Ⅱ依次加入了试剂NaOH溶液、BaCl2溶液、Na2CO3溶液、盐酸,其中Na2CO3溶液的作用是
、Mg2+、Ca2+。要除去这些杂质离子得到精盐水,过程Ⅱ依次加入了试剂NaOH溶液、BaCl2溶液、Na2CO3溶液、盐酸,其中Na2CO3溶液的作用是Ⅲ.海水提溴
(4)工业上从海水中提取溴单质的流程图中,步骤④的离子方程式为
A.NaCl B.FeCl2 C. Na2SO3 D. H2O
(5)经过步骤①②已获得Br2,不直接用含Br2的海水进行蒸馏得到液溴,而要经过“空气吹出、SO2吸收、通入氯气”后再蒸馏,其目的是
(6)溴在元素周期表中的位置是
Ⅳ.海水提镁
(7)该工业生产过程中,为了使MgCl2转化为Mg(OH)2,应加入的试剂为
(8)写出电解MgCl2冶炼金属Mg的化学方程式
您最近一年使用:0次
解答题-工业流程题
|
适中
(0.65)
名校
解题方法
【推荐3】高纯硅是现代信息、半导体和光伏发电等产业都需要的基础材料。工业上提纯硅有多种路线,其中一种工艺流程示意图及主要反应如下:___________ 。当有Si+HCl=SiHCl3+H2参与反应时,每产生1 mol H2,该反应转移的电子数是___________ 。
(2)还原炉中发生的化学反应方程式为___________ 。
(3)上述工艺生产中循环使用的物质除Si、SiHCl3外,还有___________ 。
(4)工艺师常用氢氟酸来雕刻玻璃,该反应的化学方程式为___________ 。
(5)工业上可利用水玻璃和盐酸反应制备硅酸凝胶,进一步脱水处理可得到硅胶,写出水玻璃和盐酸反应的离子方程式:___________ 。
(6)关于硅及其相关化合物的叙述正确的是___________ (填字母)。
A.自然界中存在天然游离的硅单质
B.已知C与Si的最高正价都是+4,由于CO2+H2O=H2CO3,用类比法得知SiO2+H2O=H2SiO3
C.硅元素在金属与非金属的分界线处,因此具有弱导电性,一般可用于作为半导体材料
D.SiO2既能和NaOH溶液反应,又能和氢氟酸反应,所以是两性氧化物
E.玻璃、水泥、陶瓷都是传统的硅酸盐产品
(2)还原炉中发生的化学反应方程式为
(3)上述工艺生产中循环使用的物质除Si、SiHCl3外,还有
(4)工艺师常用氢氟酸来雕刻玻璃,该反应的化学方程式为
(5)工业上可利用水玻璃和盐酸反应制备硅酸凝胶,进一步脱水处理可得到硅胶,写出水玻璃和盐酸反应的离子方程式:
(6)关于硅及其相关化合物的叙述正确的是
A.自然界中存在天然游离的硅单质
B.已知C与Si的最高正价都是+4,由于CO2+H2O=H2CO3,用类比法得知SiO2+H2O=H2SiO3
C.硅元素在金属与非金属的分界线处,因此具有弱导电性,一般可用于作为半导体材料
D.SiO2既能和NaOH溶液反应,又能和氢氟酸反应,所以是两性氧化物
E.玻璃、水泥、陶瓷都是传统的硅酸盐产品
您最近一年使用:0次
解答题-无机推断题
|
适中
(0.65)
解题方法
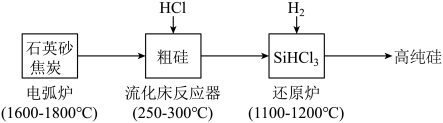
【推荐1】某溶液X中可能含有下列离子中的若干种:Cl-、SO 、CO
、CO 、Na+、Mg2+,为了确定溶液的组成,取100mL该溶液进行如下实验:
、Na+、Mg2+,为了确定溶液的组成,取100mL该溶液进行如下实验:
(1)溶液X中一定存在的离子有__________ ;一定不存在的离子有________ 。
(2)写出白色沉淀①与足量盐酸反应的离子方程式_____________ 。
 、CO
、CO 、Na+、Mg2+,为了确定溶液的组成,取100mL该溶液进行如下实验:
、Na+、Mg2+,为了确定溶液的组成,取100mL该溶液进行如下实验:
(1)溶液X中一定存在的离子有
(2)写出白色沉淀①与足量盐酸反应的离子方程式
您最近一年使用:0次
解答题-无机推断题
|
适中
(0.65)
解题方法
【推荐2】某无色透明溶液X含有以下离子中的若干种: 、
、 、
、 、
、 、
、 、
、 、
、 、
、 。为确定其成分,进行如下实验(假设气体均全部逸出,且体积折合为标准状况):
。为确定其成分,进行如下实验(假设气体均全部逸出,且体积折合为标准状况):
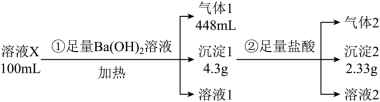
回答下列问题:
(1)溶液X中一定不含的阳离子是___________ 。
(2)“沉淀1”的成分是___________ (填化学式),②中产生气体2反应的化学方程式为___________ 。
(3)溶液X中___________ (填“存在”或“不存在”) 。若存在
。若存在 ,则
,则 的物质的量浓度至少为
的物质的量浓度至少为___________  (若不存在
(若不存在 ,则该空不填)。
,则该空不填)。
 、
、 、
、 、
、 、
、 、
、 、
、 、
、 。为确定其成分,进行如下实验(假设气体均全部逸出,且体积折合为标准状况):
。为确定其成分,进行如下实验(假设气体均全部逸出,且体积折合为标准状况):
回答下列问题:
(1)溶液X中一定不含的阳离子是
(2)“沉淀1”的成分是
(3)溶液X中
 。若存在
。若存在 ,则
,则 的物质的量浓度至少为
的物质的量浓度至少为 (若不存在
(若不存在 ,则该空不填)。
,则该空不填)。
您最近一年使用:0次
解答题-实验探究题
|
适中
(0.65)
解题方法
【推荐3】有一包白色固体,可能含有CaCO3、Na2SO4、KNO3、CuSO4、BaCl2五种物质中的一种或五种。先进行以下实验:
(1)取少量固体粉末加到足量水中,得到白色沉淀,上层清液为无色。
(2)向(1)的悬浊液中加入足量稀硝酸,白色沉淀消失,并有气泡产生。
(3)取少量(1)中的清液滴入Ba(NO3)2溶液,有白色沉淀生成,再加入稀硝酸,沉淀不溶解。
根据上述实验现象判断:该白色固体中一定含有Na2SO4、_______ ,一定不含有BaCl2、_______ ,可能含有KNO3。
(1)取少量固体粉末加到足量水中,得到白色沉淀,上层清液为无色。
(2)向(1)的悬浊液中加入足量稀硝酸,白色沉淀消失,并有气泡产生。
(3)取少量(1)中的清液滴入Ba(NO3)2溶液,有白色沉淀生成,再加入稀硝酸,沉淀不溶解。
根据上述实验现象判断:该白色固体中一定含有Na2SO4、
您最近一年使用:0次
解答题-无机推断题
|
适中
(0.65)
名校
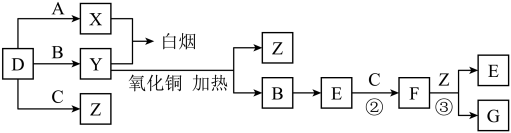
【推荐1】A、B、C、D是四种常见气体单质。E的相对分子质量比F小16,且F为红棕色,有关的转化关系如图所示(反应条件与部分反应的生成物略去)。
(1)D的化学式为___________ ,Y的化学式为___________ ,E的化学式为___________ 。
(2)Y与氧化铜反应,每生成 B消耗
B消耗 氧化铜,该反应的化学方程式为
氧化铜,该反应的化学方程式为___________ 。
(3)实验室中,检验白烟的水溶液中含有 的操作方法是
的操作方法是___________ 。
(4)气体F和气体 在通常条件下同时通入盛有
在通常条件下同时通入盛有 溶液的洗气瓶中(如图所示),洗气瓶中是否有沉淀生成,并说明理由
溶液的洗气瓶中(如图所示),洗气瓶中是否有沉淀生成,并说明理由___________ 。
(1)D的化学式为
(2)Y与氧化铜反应,每生成
 B消耗
B消耗 氧化铜,该反应的化学方程式为
氧化铜,该反应的化学方程式为(3)实验室中,检验白烟的水溶液中含有
 的操作方法是
的操作方法是(4)气体F和气体
 在通常条件下同时通入盛有
在通常条件下同时通入盛有 溶液的洗气瓶中(如图所示),洗气瓶中是否有沉淀生成,并说明理由
溶液的洗气瓶中(如图所示),洗气瓶中是否有沉淀生成,并说明理由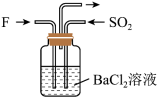
您最近一年使用:0次
解答题-有机推断题
|
适中
(0.65)
名校
解题方法
【推荐2】如图为某些中学常见物质的转化关系(部分反应条件或生成物略去)。其中A、B、C为常见单质,其余物质为化合物,C为黑色固体,气体D溶于水所得溶液显碱性,E为常用调味剂且焰色试验为黄色火焰,J为细小的白色晶体,常用作食物膨松剂,F常温下为无色无味液体。回答下列问题:
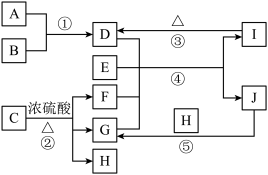
(1)H中含有的化学键为_______ (填“离子键”“共价键”或“离子键和共价键”)。
(2)实验室检验I中所含阳离子的方法为_________ 。
(3)反应①的化学方程式为________ ,以气体D与蒸馏水利用如图装置进行喷泉实验,引发喷泉的操作为________ 。
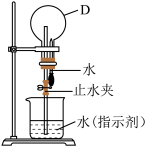
(4)反应②的化学方程式为________ ,其中氧化产物和还原产物的物质的量之比为________ 。
(5)反应④的化学方程式为_______ ,该反应可以发生的原因为________ 。
(6)向J的溶液中通入过量H时发生反应的离子方程式为________ 。

(1)H中含有的化学键为
(2)实验室检验I中所含阳离子的方法为
(3)反应①的化学方程式为

(4)反应②的化学方程式为
(5)反应④的化学方程式为
(6)向J的溶液中通入过量H时发生反应的离子方程式为
您最近一年使用:0次
解答题-无机推断题
|
适中
(0.65)
名校
解题方法
【推荐3】已知:在加热条件下,NH +OH-=NH3↑+H2O,某混合溶液中,可能大量含有的离子如下表:
+OH-=NH3↑+H2O,某混合溶液中,可能大量含有的离子如下表:
为探究其成分,某同学将Na2O2逐渐加入到上述混合溶液中并微热,产生沉淀和气体的物质的量与加入Na2O2的物质的量的关系分别如图所示:
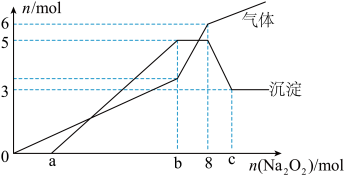
(1)该溶液中一定含有的阳离子是_______ ,其对应物质的量浓度之比为_______ ,溶液中一定不存在的阴离子是_______ ;
(2)请写出沉淀减少的离子方程式_______ 。
 +OH-=NH3↑+H2O,某混合溶液中,可能大量含有的离子如下表:
+OH-=NH3↑+H2O,某混合溶液中,可能大量含有的离子如下表:| 阳离子 | H+、K+、Al3+、NH 、Mg2+ 、Mg2+ |
| 阴离子 | Cl-、Br-、OH-、CO |

(1)该溶液中一定含有的阳离子是
(2)请写出沉淀减少的离子方程式
您最近一年使用:0次
【推荐1】某溶液X中只可能含有 、Fe2+、Al3+、
、Fe2+、Al3+、 、
、 、Cl-、
、Cl-、 中的若干种。某研究性小组为探究该溶液的组成,进行了如下实验:
中的若干种。某研究性小组为探究该溶液的组成,进行了如下实验:
实验Ⅰ.取2000mL溶液X,加入足量的浓NaOH溶液并加热,共收集到5.6L(已换算成标准状况)气体A,反应结束后无沉淀产生;往反应后的溶液中通入足量CO2,充分反应后生成19.5g沉淀B。
实验Ⅱ.另取200mL溶液X,加入足量2mol·L-1BaCl2溶液,充分反应后生成58.25g白色沉淀C;将沉淀C加入盐酸中,无明显现象。
实验Ⅲ.另取200mL溶液X,加入盐酸酸化的FeCl2溶液,无明显现象。
请回答下列问题:
(1)实验过程中需要用BaCl2固体配制250mL2mol·L-1BaCl2溶液,需要用到的玻璃仪器有烧杯、量筒、玻璃棒、胶头滴管、___________ ,玻璃棒的作用为___________ 。
(2)实验Ⅰ中生成气体A的离子方程式为___________ ;沉淀B为___________ (填化学式);19.5g沉淀B的物质的量为___________ mol。
(3)实验Ⅱ中生成白色沉淀C后进行的操作为___________ 、___________ 、干燥、称量;由实验Ⅱ可知溶液X中含有___________ (填离子符号),溶液X中该离子的物质的量浓度为___________ mol/L。
(4)通过实验Ⅲ可知溶液X中一定不含有 ,理由是
,理由是___________ 。
 、Fe2+、Al3+、
、Fe2+、Al3+、 、
、 、Cl-、
、Cl-、 中的若干种。某研究性小组为探究该溶液的组成,进行了如下实验:
中的若干种。某研究性小组为探究该溶液的组成,进行了如下实验:实验Ⅰ.取2000mL溶液X,加入足量的浓NaOH溶液并加热,共收集到5.6L(已换算成标准状况)气体A,反应结束后无沉淀产生;往反应后的溶液中通入足量CO2,充分反应后生成19.5g沉淀B。
实验Ⅱ.另取200mL溶液X,加入足量2mol·L-1BaCl2溶液,充分反应后生成58.25g白色沉淀C;将沉淀C加入盐酸中,无明显现象。
实验Ⅲ.另取200mL溶液X,加入盐酸酸化的FeCl2溶液,无明显现象。
请回答下列问题:
(1)实验过程中需要用BaCl2固体配制250mL2mol·L-1BaCl2溶液,需要用到的玻璃仪器有烧杯、量筒、玻璃棒、胶头滴管、
(2)实验Ⅰ中生成气体A的离子方程式为
(3)实验Ⅱ中生成白色沉淀C后进行的操作为
(4)通过实验Ⅲ可知溶液X中一定不含有
 ,理由是
,理由是
您最近一年使用:0次
解答题-实验探究题
|
适中
(0.65)
解题方法
【推荐2】实验室利用SO2制备少量Na2SO3并检验其性质。
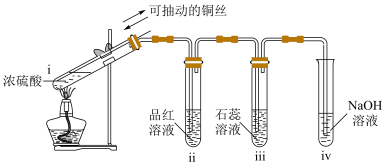
(1)i中发生反应的化学方程式为______ ,体现了浓硫酸的______ 性质。
(2)能够说明SO2具有漂白作用的实验现象为______ 。
(3)取iv中溶液分装在三支试管中,进行相关实验并记录现象如下:
①A中发生反应的离子方程式为______ ;B中反应所得氧化产物与还原产物的物质的量之比为______ 。
②甲同学为证明Na2SO3和H2O2能够反应,进行如下操作:取1mLC中溶液于试管中,先滴加足量______ (填化学式,下同)溶液,再滴加少量______ 溶液,产生白色沉淀,说明有 生成,故甲同学认为二者发生了反应:乙同学认为甲同学的实验方案有缺陷,你认为该缺陷可能为
生成,故甲同学认为二者发生了反应:乙同学认为甲同学的实验方案有缺陷,你认为该缺陷可能为______ 。
(4)小组同学设计实验测定某葡萄酒中的含硫量(以SO2计):将100mL葡萄酒和足量硫酸共热,使SO2全部逸出并与H2O2完全反应;除去过量的H2O2后,向混合溶液中滴加0.0030mol/LNaOH标准溶液,恰好完全反应时消耗NaOH标准溶液20.00mL。据此计算,该葡萄酒中SO2的含量为______ g/L。

(1)i中发生反应的化学方程式为
(2)能够说明SO2具有漂白作用的实验现象为
(3)取iv中溶液分装在三支试管中,进行相关实验并记录现象如下:
试管 | A | B | C |
| 所加试剂 | 酸性KMnO4溶液 | Na2S溶液 | 双氧水 |
| 现象 | 紫红色溶液褪色 | 产生淡黄色沉淀 | 无明显现象 |
②甲同学为证明Na2SO3和H2O2能够反应,进行如下操作:取1mLC中溶液于试管中,先滴加足量
 生成,故甲同学认为二者发生了反应:乙同学认为甲同学的实验方案有缺陷,你认为该缺陷可能为
生成,故甲同学认为二者发生了反应:乙同学认为甲同学的实验方案有缺陷,你认为该缺陷可能为(4)小组同学设计实验测定某葡萄酒中的含硫量(以SO2计):将100mL葡萄酒和足量硫酸共热,使SO2全部逸出并与H2O2完全反应;除去过量的H2O2后,向混合溶液中滴加0.0030mol/LNaOH标准溶液,恰好完全反应时消耗NaOH标准溶液20.00mL。据此计算,该葡萄酒中SO2的含量为
您最近一年使用:0次
【推荐3】某溶液中可能含有Na+、K+、Br—、SO42-、CO32-等离子中的全部或其中的几种,现分别取三份溶液,进行如下操作:
a.用洁净的铂丝蘸取溶液在无色火焰上灼烧,火焰呈黄色;
b.溶液中通入氯气,溶液由无色变为橙色;
c.溶液中加入过量的稀硫酸后,无气体放出,再加入Ba(NO3)2溶液后,产生白色沉淀.
(1)原混合液中一定存在的离子是__________ ,一定不存在的离子是___________ .
(2)为确定_______ 离子是否存在,只需将c操作中如何改进?______________
(3)为确定______ 离子是否存在,应补充的实验操作是_________________________ 。
a.用洁净的铂丝蘸取溶液在无色火焰上灼烧,火焰呈黄色;
b.溶液中通入氯气,溶液由无色变为橙色;
c.溶液中加入过量的稀硫酸后,无气体放出,再加入Ba(NO3)2溶液后,产生白色沉淀.
(1)原混合液中一定存在的离子是
(2)为确定
(3)为确定
您最近一年使用:0次



