有下列化学仪器:①托盘天平;②玻璃棒;③药匙;④烧杯;⑤量筒;⑥容量瓶;⑦胶头滴管。
(1)现需要配制500 mL 1 mol/L硫酸溶液,需用质量分数为98%、密度为1.84 g/cm3的浓硫酸________ mL。
(2)从上述仪器中,按实验使用的先后顺序,其编号排列是_______ 。
(3)容量瓶使用前检验漏水的方法是_______ 。
(4)若实验遇到下列情况,对硫酸溶液的物质的量浓度有何影响(填“偏高”、“偏低”或“不变”)
①未经冷却趁热将溶液注入容量瓶中,_______________ ;
②摇匀后发现液面低于刻度线再加水,_____________ ;
③容量瓶中原有少量蒸馏水,_______________ ;
④定容时观察液面俯视,_____________ ;
⑤未将洗涤液注入容量瓶中,_______________ 。
(1)现需要配制500 mL 1 mol/L硫酸溶液,需用质量分数为98%、密度为1.84 g/cm3的浓硫酸
(2)从上述仪器中,按实验使用的先后顺序,其编号排列是
(3)容量瓶使用前检验漏水的方法是
(4)若实验遇到下列情况,对硫酸溶液的物质的量浓度有何影响(填“偏高”、“偏低”或“不变”)
①未经冷却趁热将溶液注入容量瓶中,
②摇匀后发现液面低于刻度线再加水,
③容量瓶中原有少量蒸馏水,
④定容时观察液面俯视,
⑤未将洗涤液注入容量瓶中,
11-12高一上·陕西西安·期中 查看更多[4]
(已下线)2011-2012学年陕西省长安一中高一上学期期中考试化学试卷云南省楚雄市紫溪中学2018-2019学年高一上学期期中考试化学试题湖北省荆州市沙市区沙市中学2019-2020学年高一化学过关训练9《化学计量在实验中的应用》云南省昭通市昭阳区第一中学2020-2021学年高一上学期期中考试化学试题
更新时间:2020-02-01 20:42:37
|
相似题推荐
解答题-实验探究题
|
较难
(0.4)
名校
【推荐1】下面是用98%的浓H2SO4(ρ=1.84g/cm3)配制成0.5mol/L的稀H2SO4 500mL的操作,请按要求填空:
(1)所需浓H2SO4的体积为__________ (用下一小题的仪器量取)。
(2)如果实验室有15mL、20mL、50mL量筒,应选用_______ mL量筒最好。
(3)将量取的浓H2SO4沿烧杯内壁慢慢注入盛有约100mL水的烧杯里,并不断搅拌。
(4)将冷却至室温的上述溶液沿__________ 注入____________ 中,并用50mL蒸馏水洗涤烧杯2~3次,洗涤液要注入上述仪器中,并摇匀。
(5)加水至距刻度___________ 时,改用胶头滴管加水,使溶液的凹液面正好跟刻度相平。
(6)误差分析:请用“偏高 ”“偏低 ”或“无影响 ”进行填空
① 定容时,观察液面俯视:_____________ 。
② 摇匀后,液面低于刻度线,没有再加水:_____________ 。
③ 取浓H2SO4时,倒出浓H2SO4后的量筒中还残留少量液体未处理:_____________ 。
(1)所需浓H2SO4的体积为
(2)如果实验室有15mL、20mL、50mL量筒,应选用
(3)将量取的浓H2SO4沿烧杯内壁慢慢注入盛有约100mL水的烧杯里,并不断搅拌。
(4)将冷却至室温的上述溶液沿
(5)加水至距刻度
(6)误差分析:请用“
① 定容时,观察液面俯视:
② 摇匀后,液面低于刻度线,没有再加水:
③ 取浓H2SO4时,倒出浓H2SO4后的量筒中还残留少量液体未处理:
您最近一年使用:0次
解答题-工业流程题
|
较难
(0.4)
名校
【推荐2】利用化学原理可以对工厂排放的废水、废渣等进行有效检测与合理处理。某工厂对制革工业污泥中Cr(Ⅲ)的处理工艺流程如下。

其中硫酸浸取液中的金属离子主要是Cr3+,其次是Fe3+、Al3+、Ca2+和Mg2+。
(l)实验室用18.4mol/L的浓硫酸配制225mL4.8mol/L的H2SO4溶液,所用的玻璃仪器除烧杯、玻璃棒和量筒外,还需要__________________ 。
(2)酸浸时,为了提高浸取率除了增大酸的浓度外还可采取的措施有______ (答出一点即可)。
(3)H2O2的作用是将滤液I中的Cr3+转化为Cr2O72-,写出此反应的离子方程式______ 。
(4)常温下,部分阳离子以氮氧化物形式沉淀时,溶液的pH如下:
加入NaOH溶液使溶液呈碱性,Cr2O72-转化为CrO42-溶液的pH不能超过8,其理由_______ 。
(5)钠离子交换树脂的反应原理为Mn++nNaR→MRn+nNa+,利用钠离子交换树脂除去的滤液Ⅱ中的金属阳离子是____________ 。
(6)写出上述流程中用Na2SO3进行还原时发生反应的化学方程式_______ ,在实验室进行过滤操作时,为了加快过滤速率,可以采取的措施为_________ (写一种方法即可).

其中硫酸浸取液中的金属离子主要是Cr3+,其次是Fe3+、Al3+、Ca2+和Mg2+。
(l)实验室用18.4mol/L的浓硫酸配制225mL4.8mol/L的H2SO4溶液,所用的玻璃仪器除烧杯、玻璃棒和量筒外,还需要
(2)酸浸时,为了提高浸取率除了增大酸的浓度外还可采取的措施有
(3)H2O2的作用是将滤液I中的Cr3+转化为Cr2O72-,写出此反应的离子方程式
(4)常温下,部分阳离子以氮氧化物形式沉淀时,溶液的pH如下:
| 阳离子 | Fe3+ | Mg2+ | Al3+ |
| 开始沉淀时的pH | 2.7 | — | — |
| 沉淀完全时的pH | 3.7 | 11.1 | 8 |
加入NaOH溶液使溶液呈碱性,Cr2O72-转化为CrO42-溶液的pH不能超过8,其理由
(5)钠离子交换树脂的反应原理为Mn++nNaR→MRn+nNa+,利用钠离子交换树脂除去的滤液Ⅱ中的金属阳离子是
(6)写出上述流程中用Na2SO3进行还原时发生反应的化学方程式
您最近一年使用:0次
解答题-实验探究题
|
较难
(0.4)
【推荐3】二氧化氯(ClO2)是目前国际上公认的第四代高效、无毒的消毒剂,是一种黄绿色的气体,其熔点为-59 ℃,沸点为11.0 ℃,易溶于水。工业上用稍潮湿的KClO3和草酸(H2C2O4)在60 ℃时反应制得。某学生拟用下图所示装置模拟工业制取并收集ClO2。
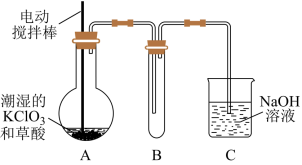
(1)A装置必须添加温度控制装置,除酒精灯外,还需要的玻璃仪器有烧杯、__________ 。
(2)B装置必须放在冰水浴中,其原因是______________________________ 。
(3)反应后在装置C中可得NaClO2溶液。已知:NaClO2饱和溶液在温度低于38℃时析出晶体是NaClO2•3H2O,高于38℃时析出晶体是NaClO2,高于60℃时NaClO2分解成NaClO3和NaCl。NaClO2的溶解度曲线如图
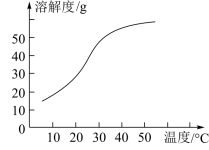
获得NaClO2晶体的操作步骤为:
①减压,55℃蒸发结晶;
②趁热过滤;
③______________________________________ ;
④在55℃干燥,得到成品。
(4)ClO2很不稳定,需随用随制,产物用水吸收得到ClO2溶液。为测定所得溶液中ClO2的浓度,进行了下列实验:
步骤1:准确量取ClO2溶液10.00 mL,稀释成100.00 mL试样,量取V1 mL试样加入到锥形瓶中;
步骤2:用稀硫酸调节试样的pH≤2.0,加入足量的KI晶体,静置片刻;
步骤3:加入指示剂,用c mol·L-1 Na2S2O3溶液滴定至终点。重复2次,测得消耗Na2S2O3溶液平均值为V2 mL(已知2Na2S2O3+I2===Na2S4O6+2NaI)。
①配制100 mL c mol·L-1 Na2S2O3标准溶液时,用到的玻璃仪器除烧杯、量筒、玻璃棒外还有:_______ 。
②若步骤2所得溶液放置时间太长,则测定结果____________ (填“偏高”、“偏低”或“不变”)
③ClO2溶液的浓度为________ g·L-1(用含字母的代数式表示)。

(1)A装置必须添加温度控制装置,除酒精灯外,还需要的玻璃仪器有烧杯、
(2)B装置必须放在冰水浴中,其原因是
(3)反应后在装置C中可得NaClO2溶液。已知:NaClO2饱和溶液在温度低于38℃时析出晶体是NaClO2•3H2O,高于38℃时析出晶体是NaClO2,高于60℃时NaClO2分解成NaClO3和NaCl。NaClO2的溶解度曲线如图

获得NaClO2晶体的操作步骤为:
①减压,55℃蒸发结晶;
②趁热过滤;
③
④在55℃干燥,得到成品。
(4)ClO2很不稳定,需随用随制,产物用水吸收得到ClO2溶液。为测定所得溶液中ClO2的浓度,进行了下列实验:
步骤1:准确量取ClO2溶液10.00 mL,稀释成100.00 mL试样,量取V1 mL试样加入到锥形瓶中;
步骤2:用稀硫酸调节试样的pH≤2.0,加入足量的KI晶体,静置片刻;
步骤3:加入指示剂,用c mol·L-1 Na2S2O3溶液滴定至终点。重复2次,测得消耗Na2S2O3溶液平均值为V2 mL(已知2Na2S2O3+I2===Na2S4O6+2NaI)。
①配制100 mL c mol·L-1 Na2S2O3标准溶液时,用到的玻璃仪器除烧杯、量筒、玻璃棒外还有:
②若步骤2所得溶液放置时间太长,则测定结果
③ClO2溶液的浓度为
您最近一年使用:0次
解答题-实验探究题
|
较难
(0.4)
名校
【推荐1】用18 mol/L浓硫酸配制100 mL 3.0 mol/L稀硫酸的实验步骤如下:
①计算所用浓硫酸的体积②量取一定体积的浓硫酸 ③稀释 ④转移、洗涤 ⑤定容、摇匀
完成下列问题:
(1)溶液配制中需要用到除了量筒、烧杯、玻璃棒,还需要的玻璃仪器有:_________
(2)所需浓硫酸的体积是_______ mL,量取浓硫酸所用的量筒的规格是_________
A. 10ml B. 20ml C. 50ml D. 100ml
(3)使用容量瓶前必须进行的一步操作是______________________
(4)下列关于容量瓶的使用方法中,正确的是________ (填下列选项的编号字母)。
a.使用前应检查是否漏液 b.使用前必须烘干
c.不能用作物质反应或溶解的容器 d.热溶液可直接转移到其中
(5)第③步实验的操作方法是_________________________________________________
(6)下列情况导致配制的稀硫酸浓度偏小的是__________
A.容量瓶用蒸馏水洗涤后残留有少量的水
B.所用过的烧杯、玻璃棒未洗涤
C.定容时俯视溶液的凹液面
①计算所用浓硫酸的体积②量取一定体积的浓硫酸 ③稀释 ④转移、洗涤 ⑤定容、摇匀
完成下列问题:
(1)溶液配制中需要用到除了量筒、烧杯、玻璃棒,还需要的玻璃仪器有:
(2)所需浓硫酸的体积是
A. 10ml B. 20ml C. 50ml D. 100ml
(3)使用容量瓶前必须进行的一步操作是
(4)下列关于容量瓶的使用方法中,正确的是
a.使用前应检查是否漏液 b.使用前必须烘干
c.不能用作物质反应或溶解的容器 d.热溶液可直接转移到其中
(5)第③步实验的操作方法是
(6)下列情况导致配制的稀硫酸浓度偏小的是
A.容量瓶用蒸馏水洗涤后残留有少量的水
B.所用过的烧杯、玻璃棒未洗涤
C.定容时俯视溶液的凹液面
您最近一年使用:0次
解答题-实验探究题
|
较难
(0.4)
名校
【推荐2】实验室需要0.1mol/L NaOH溶液450mL和0.5mol/L硫酸溶液500mL。根据这两种溶液的配制情况回答下列问题:
(1)如图所示的仪器中配制溶液肯定不需要的是________________ (填序号),配制上述溶液还需用到的玻璃仪器是_____________ (填仪器名称)。

(2)配制0.1mol/L NaOH 溶液操作步骤如下:正确顺序是___________________
①把称量好的NaOH固体放入小烧杯中,加适量的蒸馏水溶解;
②把①所得溶液冷却至室温,再小心转入一定容积的容量瓶中;
③继续向容量瓶中加蒸馏水至液面距刻度线1~2cm处,改用胶头滴管小心滴加蒸馏水至溶液凹液面与刻度线相切;
④用少量蒸馏水洗涤烧杯和玻璃棒2~3次,每次洗涤的液体都小心转入容量瓶,并轻轻摇匀;
⑤将容量瓶瓶塞塞紧,充分摇匀.
(3)根据计算用托盘天平称取NaOH的质量为______ g.在实验中其他操作均正确,若容量瓶用蒸馏水洗涤后未干燥,则所得溶液浓度_________ 0.10mol/L(填“大于”“小于”或“等于”,下同).若还未等溶液冷却就定容了,则所得溶液浓度___________ 0.10mol/L。
(1)如图所示的仪器中配制溶液肯定不需要的是

(2)配制0.1mol/L NaOH 溶液操作步骤如下:正确顺序是
①把称量好的NaOH固体放入小烧杯中,加适量的蒸馏水溶解;
②把①所得溶液冷却至室温,再小心转入一定容积的容量瓶中;
③继续向容量瓶中加蒸馏水至液面距刻度线1~2cm处,改用胶头滴管小心滴加蒸馏水至溶液凹液面与刻度线相切;
④用少量蒸馏水洗涤烧杯和玻璃棒2~3次,每次洗涤的液体都小心转入容量瓶,并轻轻摇匀;
⑤将容量瓶瓶塞塞紧,充分摇匀.
(3)根据计算用托盘天平称取NaOH的质量为
您最近一年使用:0次
解答题-实验探究题
|
较难
(0.4)
名校
解题方法
【推荐3】Ⅰ.有下列化学仪器:①托盘天平②玻璃棒③药匙④烧杯⑤量筒⑥容量瓶⑦胶头滴管⑧细口试剂瓶⑨标签纸
(1)现需要配制450mL1mol/L的硫酸溶液,选用容量瓶的规格是___________ 需要用量筒量取质量分数为98%、密度为1.84g/cm3的浓硫酸___________ mL。
(2)实验时不需要的仪器是___________ (填入编号)。
(3)下列对容量瓶及其使用方法的描述中正确的是___________
(4)在配制过程中,下列操作可引起所配溶液浓度偏低的有___________ (填序号)。
①未洗涤稀释浓硫酸时用过的烧杯和玻璃棒
②未等稀释后的硫酸溶液冷却至室温就转移到容量瓶中并定容
③转移前,容量瓶中含有少量蒸馏水
④定容时,仰视刻度线
⑤转移溶液时,不慎有少量溶液洒出
Ⅱ.回答下列问题
(5)标准状况下,3.4gNH3的物质的量是___________ ,体积是___________ ,它与标况下的___________ LH2S含有相同数目的氢原子。
(6)相同质量的两种气体O2、SO2,它们的物质的量之比是___________ ,在相同条件下它们的体积之比是___________ ,所含氧原子数之比是___________ 。
(7)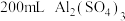 溶液中含
溶液中含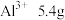 ,则溶液中c(SO
,则溶液中c(SO )=
)=___________ 。
(8)标准状况下,将VLHCl溶解在1L水中(水的密度近似为 ),所得溶液的密度为
),所得溶液的密度为 ,物质的量浓度为cmol/L,则c=
,物质的量浓度为cmol/L,则c=___________ (用含V、 的式子表示)
的式子表示)
(1)现需要配制450mL1mol/L的硫酸溶液,选用容量瓶的规格是
(2)实验时不需要的仪器是
(3)下列对容量瓶及其使用方法的描述中正确的是___________
| A.容量瓶上标有容积、温度和刻度线 |
| B.容量瓶用蒸馏水洗净后,必须烘干 |
| C.配制溶液时,把量好的浓硫酸小心倒入容量瓶中,加入蒸馏水到接近刻度线1-2cm处,改用胶头滴管滴加蒸馏水至刻度线 |
| D.使用前要检查容量瓶是否漏水 |
①未洗涤稀释浓硫酸时用过的烧杯和玻璃棒
②未等稀释后的硫酸溶液冷却至室温就转移到容量瓶中并定容
③转移前,容量瓶中含有少量蒸馏水
④定容时,仰视刻度线
⑤转移溶液时,不慎有少量溶液洒出
Ⅱ.回答下列问题
(5)标准状况下,3.4gNH3的物质的量是
(6)相同质量的两种气体O2、SO2,它们的物质的量之比是
(7)
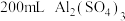 溶液中含
溶液中含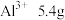 ,则溶液中c(SO
,则溶液中c(SO )=
)=(8)标准状况下,将VLHCl溶解在1L水中(水的密度近似为
 ),所得溶液的密度为
),所得溶液的密度为 ,物质的量浓度为cmol/L,则c=
,物质的量浓度为cmol/L,则c= 的式子表示)
的式子表示)
您最近一年使用:0次
解答题-实验探究题
|
较难
(0.4)
【推荐1】Ⅰ.下列实验操作或对实验事实的描述正确的是____________ (填序号)
①实验室配制氯化亚铁溶液时,将氯化亚铁先溶解在盐酸中,然后用蒸馏水稀释并加入少量铁粉;
②配制一定浓度的溶液时,俯视容量瓶的刻度线,会使配制的浓度偏高;实验室测定中和热时,过早读数会使测定结果偏低;
③试管中加入少量淀粉,再加入一定量稀硫酸,加热3-4分钟,然后加入银氨溶液,片刻后管壁上有“银镜”出现
④分别向体积和pH均相同的盐酸和醋酸中滴加等浓度的氢氧化钠溶液,完全中和时消耗的氢氧化钠溶液的体积一样多
⑤向NaOH溶液、KSCN溶液、沸腾的蒸馏水中分别滴加饱和的FeCl3溶液得到的分散系依次为:浊液、溶液、胶体
Ⅱ.某研究性学习小组利用下图所示装置研究乙醇与氧化铁的反应,请回答下列问题:

(1)装置中试管B的作用是____________________________ 。
(2)实验中可观察到石英管A中的现象为_______________________________ 。
(3)反应停止后,取出试管C在酒精灯上加热至沸腾,可观察到有红色沉淀产生。写出该反应的化学方程式________________________________ 。
(4)为了测定反应后石英管A左侧固体中铁元素的含量,进行如下实验:
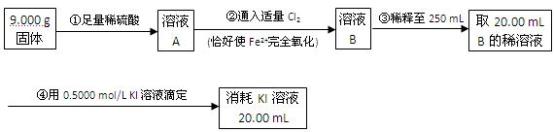
(i)步骤③中用到的玻璃仪器有烧杯、玻璃棒、胶头滴管、__________________ 。
(ii)下列有关步骤④的操作中说法正确的是__________________________ 。
a.滴定过程中可利用淀粉溶液作为指示剂
b.滴定管用蒸馏水洗涤后可以直接装液
c.锥形瓶不需要用待测夜润洗
d.滴定过程中,眼睛注视滴定管中液面变化
e.滴定结束后,30 s内溶液不恢复原来的颜色,再读数
(iii)由框图中数据计算,可得石英管A左侧固体中铁元素的百分含量为_______ 。
①实验室配制氯化亚铁溶液时,将氯化亚铁先溶解在盐酸中,然后用蒸馏水稀释并加入少量铁粉;
②配制一定浓度的溶液时,俯视容量瓶的刻度线,会使配制的浓度偏高;实验室测定中和热时,过早读数会使测定结果偏低;
③试管中加入少量淀粉,再加入一定量稀硫酸,加热3-4分钟,然后加入银氨溶液,片刻后管壁上有“银镜”出现
④分别向体积和pH均相同的盐酸和醋酸中滴加等浓度的氢氧化钠溶液,完全中和时消耗的氢氧化钠溶液的体积一样多
⑤向NaOH溶液、KSCN溶液、沸腾的蒸馏水中分别滴加饱和的FeCl3溶液得到的分散系依次为:浊液、溶液、胶体
Ⅱ.某研究性学习小组利用下图所示装置研究乙醇与氧化铁的反应,请回答下列问题:

(1)装置中试管B的作用是
(2)实验中可观察到石英管A中的现象为
(3)反应停止后,取出试管C在酒精灯上加热至沸腾,可观察到有红色沉淀产生。写出该反应的化学方程式
(4)为了测定反应后石英管A左侧固体中铁元素的含量,进行如下实验:

(i)步骤③中用到的玻璃仪器有烧杯、玻璃棒、胶头滴管、
(ii)下列有关步骤④的操作中说法正确的是
a.滴定过程中可利用淀粉溶液作为指示剂
b.滴定管用蒸馏水洗涤后可以直接装液
c.锥形瓶不需要用待测夜润洗
d.滴定过程中,眼睛注视滴定管中液面变化
e.滴定结束后,30 s内溶液不恢复原来的颜色,再读数
(iii)由框图中数据计算,可得石英管A左侧固体中铁元素的百分含量为
您最近一年使用:0次
解答题-实验探究题
|
较难
(0.4)
名校
【推荐2】(硫化碱法是工业上制备Na2S2O3的方法之一,反应原理为:2Na2S+Na2CO3+4SO2=3Na2S2O3+CO2(该反应△H>0)。某研究小组在实验室用硫化碱法制备Na2S2O3·5H2O流程如下。
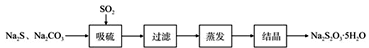
(1)吸硫装置如图所示

①装置B的作用是检验装置A中SO2的吸收效率,B中试剂是______ ,表明SO2吸收效率低的实验现象是B中溶液 _________ 。
②为了使SO2尽可能吸收完全,在不改变A中溶液浓度、体积的条件下,除了及时搅拌反应物外,还可采取的合理措施是___________________ 。(答一条)
(2)假设本实验所用的Na2CO3含少量NaCl、NaOH,设计实验方案进行检验。请完成该实验方案。(已知:室温时CaCO3饱和溶液的pH=10.2)
(3)Na2S2O3溶液是定量实验中的常用试剂,测定其浓度的过程如下:
第一步:准确称取a g KIO3(化学式量:214)固体配成溶液;
第二步:加入过量KI固体和H2SO4溶液,滴加指示剂;
第三步:用Na2S2O3溶液滴定至终点,消耗Na2S2O3溶液的体积为V mL。则c(Na2S2O3)=___ mol·L-1。
(4)在(3)的实验中,某同学第一步和第二步的操作都很规范,第三步滴速太慢,这样测得的Na2S2O3浓度可能___________ (填“不受影响”、“偏低”或“偏高”),原因是_____________ 。(用离子方程式表示)。(已知:IO3-+5I-+6H+= 3I2+3H2O, 4I-+O2+4H+=I2+2H2O ,2S2O32-+I2=S4O62-+2I-)

(1)吸硫装置如图所示

①装置B的作用是检验装置A中SO2的吸收效率,B中试剂是
②为了使SO2尽可能吸收完全,在不改变A中溶液浓度、体积的条件下,除了及时搅拌反应物外,还可采取的合理措施是
(2)假设本实验所用的Na2CO3含少量NaCl、NaOH,设计实验方案进行检验。请完成该实验方案。(已知:室温时CaCO3饱和溶液的pH=10.2)
序号 | 实验操作 | 预期现象 | 结论 |
① | 取少量样品于试管中,加入适量蒸馏水,充分振荡溶解, | 有白色沉淀生成 | 样品含NaCl |
② | 另取少量样品于烧杯中,加入适量蒸馏水,充分搅拌溶解, | 有白色沉淀生成,上层清液pH>10.2 | 样品含NaOH |
第一步:准确称取a g KIO3(化学式量:214)固体配成溶液;
第二步:加入过量KI固体和H2SO4溶液,滴加指示剂;
第三步:用Na2S2O3溶液滴定至终点,消耗Na2S2O3溶液的体积为V mL。则c(Na2S2O3)=
(4)在(3)的实验中,某同学第一步和第二步的操作都很规范,第三步滴速太慢,这样测得的Na2S2O3浓度可能
您最近一年使用:0次
解答题-实验探究题
|
较难
(0.4)
名校
解题方法
【推荐3】现有含有少量NaCl、 Na2SO4、Na2CO3等杂质的NaNO3溶液,选择适当的试剂除去杂质,得到纯净的NaNO3固体,实验流程如下图所示。
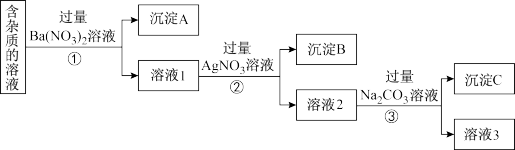
(1)沉淀A的主要成分是_____________ 、______________ (填化学式)。
(2)①②③中均进行的分离操作是_______________ 。
(3)溶液3经过处理可以得到NaNO3固体,溶液3中肯定含有的杂质是__________ ,为了除去杂质,可向溶液3中加入适量的______________ 。
(4)实验探究小组在实验中需要用到456 mL1 mol•L-1的HNO3溶液,但是在实验室中只发现一瓶8 mol•L-1的HNO3溶液,该小组用8mol•L-1的HNO3溶液配制所需溶液。
①实验中所需的玻璃仪器包括_________ 、________ mL量筒、烧杯、__________ 、胶头滴管等。
②该实验中需要量取8mol•L-1的HNO3溶液________ mL。
③下列实验操作中导致配制的溶液浓度偏高的是_____________ 。
A.取8mol•L-1的HNO3溶液溶液时仰视刻度线
B.量取用的量筒水洗后未进行任何操作
C. 8mol•L-1的HNO3溶液从量筒转移至烧杯后用水洗涤量筒并全部转移至烧杯
D.定容时仰视刻度线
E.定容后,将容量瓶振荡摇匀后,发现液面低于刻度线,未进行任何操作
(5)某同学转移溶液的操作如图所示,该同学操作中的错误是________________ 。容量瓶的刻度线标在比较细的瓶颈之上的原因是___________ 。
A.为了美观 B.为了统一标准 C.为了提高准确度 D.方便刻画

(1)沉淀A的主要成分是
(2)①②③中均进行的分离操作是
(3)溶液3经过处理可以得到NaNO3固体,溶液3中肯定含有的杂质是
(4)实验探究小组在实验中需要用到456 mL1 mol•L-1的HNO3溶液,但是在实验室中只发现一瓶8 mol•L-1的HNO3溶液,该小组用8mol•L-1的HNO3溶液配制所需溶液。
①实验中所需的玻璃仪器包括
②该实验中需要量取8mol•L-1的HNO3溶液
③下列实验操作中导致配制的溶液浓度偏高的是
A.取8mol•L-1的HNO3溶液溶液时仰视刻度线
B.量取用的量筒水洗后未进行任何操作
C. 8mol•L-1的HNO3溶液从量筒转移至烧杯后用水洗涤量筒并全部转移至烧杯
D.定容时仰视刻度线
E.定容后,将容量瓶振荡摇匀后,发现液面低于刻度线,未进行任何操作
(5)某同学转移溶液的操作如图所示,该同学操作中的错误是

A.为了美观 B.为了统一标准 C.为了提高准确度 D.方便刻画
您最近一年使用:0次
解答题-实验探究题
|
较难
(0.4)
名校
【推荐1】甲、乙两同学分别用不同的方法配制100mL 4.6mol/L的稀硫酸。
(1)配制溶液时,一般可以分为以下几个步骤:
①称量或量取 ②计算 ③溶解或稀释 ④摇匀 ⑤转移洗涤 ⑥定容 ⑦冷却
其正确的操作顺序为____________________________ 。
(2)甲同学:用量筒量取一定量的浓硫酸,小心地倒入盛有少量水的烧杯中,搅拌均匀,待冷却至室温后转移到100 mL容量瓶中,用少量的水将烧杯等仪器洗涤2~3次,每次洗涤液也转移到容量瓶中,然后小心地向容量瓶加入水至刻度线定容,塞好瓶塞,反复上下颠倒摇匀。
①实验所用的玻璃仪器除烧杯、量筒和容量瓶外还有_______ 、________ ;
②若用98%(密度为1.84g/cm3)的浓硫酸,应量取浓硫酸的体积为___ mL,
(3)乙同学:用100 mL量筒量取所需体积的浓硫酸,并向其中小心地加入少量水,搅拌均匀,待冷却至室温后,再向量筒中加水至100 mL刻度线,搅拌均匀。
指出其中错误之处____________________________ (任写一处)。
(1)配制溶液时,一般可以分为以下几个步骤:
①称量或量取 ②计算 ③溶解或稀释 ④摇匀 ⑤转移洗涤 ⑥定容 ⑦冷却
其正确的操作顺序为
(2)甲同学:用量筒量取一定量的浓硫酸,小心地倒入盛有少量水的烧杯中,搅拌均匀,待冷却至室温后转移到100 mL容量瓶中,用少量的水将烧杯等仪器洗涤2~3次,每次洗涤液也转移到容量瓶中,然后小心地向容量瓶加入水至刻度线定容,塞好瓶塞,反复上下颠倒摇匀。
①实验所用的玻璃仪器除烧杯、量筒和容量瓶外还有
②若用98%(密度为1.84g/cm3)的浓硫酸,应量取浓硫酸的体积为
(3)乙同学:用100 mL量筒量取所需体积的浓硫酸,并向其中小心地加入少量水,搅拌均匀,待冷却至室温后,再向量筒中加水至100 mL刻度线,搅拌均匀。
指出其中错误之处
您最近一年使用:0次
解答题-实验探究题
|
较难
(0.4)
解题方法
【推荐2】某化学兴趣小组以含铁的废铝为原料制备硫酸铝晶体,设计如下的实验方案:

请回答以下问题:
(1)上述实验中多次用到过滤操作,该操作中要用到的玻璃仪器有__________ ;
(2)步骤②中有洗涤沉淀的操作,如何判断沉淀已洗涤干净:__________________ ;
(3)写出步骤②所得沉淀受热分解的化学方程式__________ ,指出两种产物在物质分类上的类别_______________ 、____________ ;
(4)步骤①中使用的NaOH溶液以4mol/L为宜。某同学称量mgNaOH固体配制V mL 4mol/L的NaOH溶液,下面是该同学配制过程的示意图,其操作中有错误的是(填操作序号)____________ 。
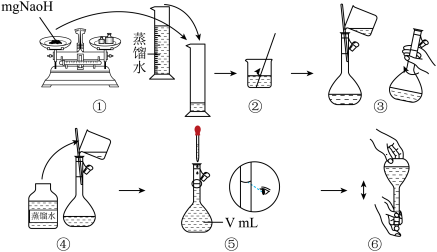
第⑤部操作可能会使所配溶液浓度偏_________ (填“大”或“小”或“无影响”)

请回答以下问题:
(1)上述实验中多次用到过滤操作,该操作中要用到的玻璃仪器有
(2)步骤②中有洗涤沉淀的操作,如何判断沉淀已洗涤干净:
(3)写出步骤②所得沉淀受热分解的化学方程式
(4)步骤①中使用的NaOH溶液以4mol/L为宜。某同学称量mgNaOH固体配制V mL 4mol/L的NaOH溶液,下面是该同学配制过程的示意图,其操作中有错误的是(填操作序号)

第⑤部操作可能会使所配溶液浓度偏
您最近一年使用:0次
解答题-实验探究题
|
较难
(0.4)
名校
【推荐3】某研究性学习小组为了探究醋酸的电离情况,进行了如下实验。
[实验一]配制并标定醋酸溶液的浓度
取冰醋酸配制250 mL 0.2 mol·L-1的醋酸溶液,用0.2 mol·L-1的醋酸溶液稀释成所需浓度的溶液,再用NaOH标准溶液对所配醋酸溶液的浓度进行标定。回答下列问题:
(1)配制250 mL 0.2 mol·L-1醋酸溶液时需要用到的玻璃仪器有量筒、烧杯、玻璃棒、________ 和________ 。
(2)为标定某醋酸溶液的准确浓度,用0.2000 mol·L-1的NaOH溶液对20.00 mL醋酸溶液进行滴定,几次滴定消耗NaOH溶液的体积如下:
则该醋酸溶液的准确浓度为________ (保留小数点后四位)。
[实验二]
探究浓度对醋酸电离程度的影响
用pH计测定25℃时不同浓度的醋酸的pH,结果如下,回答下列问题:
(3)从表中的数据,还可以得出另一结论:随着醋酸浓度的减小,醋酸的电离程度将________ (填“增大”“减小”或“不变”)。
(4)根据表中数据,可以得出醋酸是弱电解质的结论,你认为得出此结论的依据是:______ 。
[实验三]探究温度对醋酸电离程度的影响
(5)请你设计一个实验完成该探究,请简述你的实验方案:___________________________________ 。
[实验一]配制并标定醋酸溶液的浓度
取冰醋酸配制250 mL 0.2 mol·L-1的醋酸溶液,用0.2 mol·L-1的醋酸溶液稀释成所需浓度的溶液,再用NaOH标准溶液对所配醋酸溶液的浓度进行标定。回答下列问题:
(1)配制250 mL 0.2 mol·L-1醋酸溶液时需要用到的玻璃仪器有量筒、烧杯、玻璃棒、
(2)为标定某醋酸溶液的准确浓度,用0.2000 mol·L-1的NaOH溶液对20.00 mL醋酸溶液进行滴定,几次滴定消耗NaOH溶液的体积如下:
| 实验序号 | 1 | 2 | 3 | 4 |
| 消耗NaOH溶液的体积(mL) | 20.05 | 20.00 | 18.80 | 19.95 |
[实验二]
探究浓度对醋酸电离程度的影响
用pH计测定25℃时不同浓度的醋酸的pH,结果如下,回答下列问题:
| 醋酸浓度 (mol·L-1) | 0.0010 | 0.0100 | 0.0200 | 0.1000 | 0.2000 |
| pH | 3.88 | 3.38 | 3.23 | 2.88 | 2.73 |
(4)根据表中数据,可以得出醋酸是弱电解质的结论,你认为得出此结论的依据是:
[实验三]探究温度对醋酸电离程度的影响
(5)请你设计一个实验完成该探究,请简述你的实验方案:
您最近一年使用:0次



