某小组设计实验探究重铬酸铵[(NH4)2Cr2O7]的部分性质:资料显示:
①(NH4)2Cr2O7呈橙红色,Cr2O3呈绿色,Cr3+呈绿色。
②Mg3N2遇水蒸气剧烈反应生成NH3。
(1)探究重铬酸铵分解产物是否有NH3(装置如图1所示)。
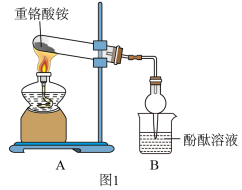
B中倒置的干燥管作用是_____________________ 。实验中,没有观察到B中颜色发生变化,实验结论是_________________________________ 。
(2)探究(NH4)2Cr2O7 N2↑+Cr2O3+4H2O的真实性(如下
N2↑+Cr2O3+4H2O的真实性(如下装置可以重复使用 ):
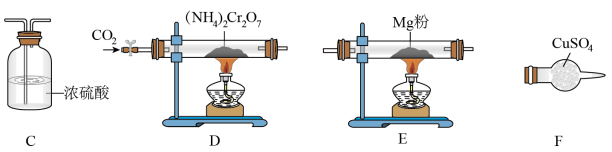
①气流从左至右,装置连接顺序D、________________________________ 。
②点燃E处酒精灯之前,先通入一段时间CO2,其目的是_______________ 能证明有水生成的实验现象是_________________ 。
③能说明D中分解反应已发生的实验依据是_______________ 。
④设计实验证明重铬酸铵分解生成了N2:取反应后E中残留固体于试管,滴加蒸馏水,____ 。
(3)探究(NH4)2Cr2O7的氧化性(按如图2装置进行实验)。为了探究(NH4)2Cr2O7与Na2S反应的氧化产物是否是SO42-,设计如下方案。连接K,观察到左烧杯中溶液由橙色逐渐变成绿色,电流计指针有明显偏转。实验完毕后,向右烧杯滴加BaCl2溶液,产生白色沉淀。
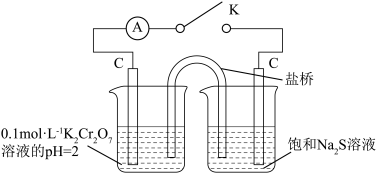
图2中负极的电极反应式为________________________ (不考虑后续反应)。
①(NH4)2Cr2O7呈橙红色,Cr2O3呈绿色,Cr3+呈绿色。
②Mg3N2遇水蒸气剧烈反应生成NH3。
(1)探究重铬酸铵分解产物是否有NH3(装置如图1所示)。

B中倒置的干燥管作用是
(2)探究(NH4)2Cr2O7
 N2↑+Cr2O3+4H2O的真实性(如下
N2↑+Cr2O3+4H2O的真实性(如下
①气流从左至右,装置连接顺序D、
②点燃E处酒精灯之前,先通入一段时间CO2,其目的是
③能说明D中分解反应已发生的实验依据是
④设计实验证明重铬酸铵分解生成了N2:取反应后E中残留固体于试管,滴加蒸馏水,
(3)探究(NH4)2Cr2O7的氧化性(按如图2装置进行实验)。为了探究(NH4)2Cr2O7与Na2S反应的氧化产物是否是SO42-,设计如下方案。连接K,观察到左烧杯中溶液由橙色逐渐变成绿色,电流计指针有明显偏转。实验完毕后,向右烧杯滴加BaCl2溶液,产生白色沉淀。

图2中负极的电极反应式为
更新时间:2020-02-21 14:57:30
|
相似题推荐
解答题-实验探究题
|
适中
(0.65)
解题方法
【推荐1】I.有甲、乙两位同学均想利用原电池反应检测金属的活动性顺序,两人均用镁片和铝片作电极,但甲同学将电极放入6 mol·L-1的H2SO4溶液中,乙同学将电极放入6 mol·L-1的NaOH溶液中,如图所示。
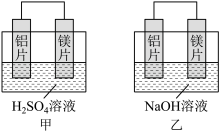
(1)写出甲中正极的电极反应式:_______
(2)乙中负极为_______ , 总反应的离子方程式:_______
(3)由此实验得出的下列结论中,正确的有_______
II.利用反应Cu+2FeCl3=CuCl2+2FeCl2设计成如图所示原电池,回答下列问题:
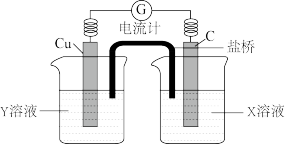
(4)写出电极反应式:正极_______ ;负极_______ 。
(5)图中X溶液是_______ ,Y溶液是_______ 。

(1)写出甲中正极的电极反应式:
(2)乙中负极为
(3)由此实验得出的下列结论中,正确的有_______
| A.利用原电池反应判断金属活动性顺序时应注意选择合适的介质 |
| B.镁的金属性不一定比铝的金属性强 |
| C.该实验说明金属活动性顺序表已过时,没有实用价值了 |
| D.该实验说明化学研究对象复杂、反应受条件影响较大,因此应具体问题具体分析 |
II.利用反应Cu+2FeCl3=CuCl2+2FeCl2设计成如图所示原电池,回答下列问题:

(4)写出电极反应式:正极
(5)图中X溶液是
您最近一年使用:0次
解答题-原理综合题
|
适中
(0.65)
解题方法
【推荐2】不同的金属在化学反应中表现出来的活泼程度不同,俄国化学家贝开托夫在大量实验和系统研究之后,于1865年发表了金属活动性顺序:K Ca Na Mg Al Zn Fe Sn Pb (H) Cu Hg Ag Pt Au 。
(1)金属活动性顺序是学习“金属及其化合物”的重要工具,许多“金属及其化合物”的知识规律可以通过金属活动性顺序来掌握。例如,工业上冶炼金属,根据金属活动性顺序可以采用不同的冶炼方法。其中可以用“热分解法”冶炼的金属是__________ 、________ 。
工业上又常用下列反应进行金属钾的冶炼: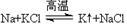 ,似乎“违背”了金属活动性顺序,试解释钠能将更活泼的钾置换出来的原因
,似乎“违背”了金属活动性顺序,试解释钠能将更活泼的钾置换出来的原因__________________________ 。
(2)在实践中发现还有许多化学事实 “违背”金属活动性顺序,但这些“反常”现象都可以通过化学原理得到合理解释。某学生在做探究实验时,把锌粒投入1mol·L-1氯化铁溶液中,观察到如下实验现象:锌粒表面有一定量气泡产生,溶液颜色逐渐变浅,一段时间后溶液逐渐浑浊,试用相关反应方程式进行解释___________________ 、________________ 。
(3)研究金属活动性顺序还可以指导对金属阳离子氧化性强弱的认识,工业上用氯化铁溶液腐蚀铜制电路板。
①请根据金属活动性顺序结合该反应原理,比较Cu2+、Fe3+、Fe2+的氧化性强弱_______ 。
②请运用原电池原理设计实验验证Cu2+、Fe3+氧化性强弱的结论。方案___________ 。
(1)金属活动性顺序是学习“金属及其化合物”的重要工具,许多“金属及其化合物”的知识规律可以通过金属活动性顺序来掌握。例如,工业上冶炼金属,根据金属活动性顺序可以采用不同的冶炼方法。其中可以用“热分解法”冶炼的金属是
工业上又常用下列反应进行金属钾的冶炼:
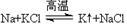 ,似乎“违背”了金属活动性顺序,试解释钠能将更活泼的钾置换出来的原因
,似乎“违背”了金属活动性顺序,试解释钠能将更活泼的钾置换出来的原因(2)在实践中发现还有许多化学事实 “违背”金属活动性顺序,但这些“反常”现象都可以通过化学原理得到合理解释。某学生在做探究实验时,把锌粒投入1mol·L-1氯化铁溶液中,观察到如下实验现象:锌粒表面有一定量气泡产生,溶液颜色逐渐变浅,一段时间后溶液逐渐浑浊,试用相关反应方程式进行解释
(3)研究金属活动性顺序还可以指导对金属阳离子氧化性强弱的认识,工业上用氯化铁溶液腐蚀铜制电路板。
①请根据金属活动性顺序结合该反应原理,比较Cu2+、Fe3+、Fe2+的氧化性强弱
②请运用原电池原理设计实验验证Cu2+、Fe3+氧化性强弱的结论。方案
您最近一年使用:0次
解答题-原理综合题
|
适中
(0.65)
解题方法
【推荐3】按要求回答问题:
(1)以Zn和Cu为电极,稀H2SO4为电解质溶液形成的原电池中:
①H+向___________ 极移动(填“正”或“负”)。
②若有1mole- 流过导线,则理论上负极质量减少____________ g。
③若将稀硫酸换成硫酸铜溶液,电极质量增加的是___________ (填“锌极”或“铜极”),原因是______________ (用电极方程式表示)。
(2)一定温度下,在容积为2 L的密闭容器中进行反应:aN(g) bM(g)+cP(g),M、N、P的物质的量随时间变化的曲线如图所示:
bM(g)+cP(g),M、N、P的物质的量随时间变化的曲线如图所示:
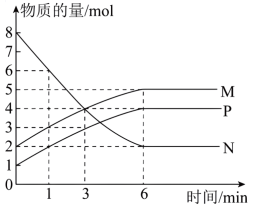
①反应化学方程式中各物质的系数比为a∶b∶c=_________ 。
②下列叙述中能说明上述反应达到平衡状态的是____________________________ 。
A.反应中当M与N的物质的量相等时
B.混合气体的总物质的量不随时间变化而变化
C.单位时间内每消耗amolN,同时消耗bmolM
D.混合气体的压强不随时间的变化而变化
E.M的物质的量浓度保持不变
(1)以Zn和Cu为电极,稀H2SO4为电解质溶液形成的原电池中:
①H+向
②若有1mole- 流过导线,则理论上负极质量减少
③若将稀硫酸换成硫酸铜溶液,电极质量增加的是
(2)一定温度下,在容积为2 L的密闭容器中进行反应:aN(g)
 bM(g)+cP(g),M、N、P的物质的量随时间变化的曲线如图所示:
bM(g)+cP(g),M、N、P的物质的量随时间变化的曲线如图所示:
①反应化学方程式中各物质的系数比为a∶b∶c=
②下列叙述中能说明上述反应达到平衡状态的是
A.反应中当M与N的物质的量相等时
B.混合气体的总物质的量不随时间变化而变化
C.单位时间内每消耗amolN,同时消耗bmolM
D.混合气体的压强不随时间的变化而变化
E.M的物质的量浓度保持不变
您最近一年使用:0次
解答题-实验探究题
|
适中
(0.65)
名校
【推荐1】(1)CCl4 和蒸馏水都是无色液体,请按下列要求用实验方法鉴别两者:
① 只允许用一种试剂:用两支试管分别取出少量的 CCl4和 蒸馏水 ,然后分别加入少量 的单质碘,振荡,呈紫红色的液体 是_____ ,呈棕黄色的液体是 _____ .
② 不用任何试剂:用试管取少量的其中一种液体,再加入另外一种液体,下层液体是______ ,上 层液体是_______ 。
(2)NaCl溶液中含有少量的CaCl2,某学生用过量的 Na2CO3使 Ca2+转化为沉淀而除 去,确认Na2CO3已 过量的实验 方法 是 :_____ .
(3) 氢氧化铁胶体的制备方法是_____ 。 发生反应的化学方程式为_______________________ 。
① 只允许用一种试剂:用两支试管分别取出少量的 CCl4和 蒸馏水 ,然后分别加入少量 的单质碘,振荡,呈紫红色的液体 是
② 不用任何试剂:用试管取少量的其中一种液体,再加入另外一种液体,下层液体是
(2)NaCl溶液中含有少量的CaCl2,某学生用过量的 Na2CO3使 Ca2+转化为沉淀而除 去,确认Na2CO3已 过量的实验 方法 是 :
(3) 氢氧化铁胶体的制备方法是
您最近一年使用:0次
解答题-实验探究题
|
适中
(0.65)
名校
【推荐2】硫脲[ ]是用来合成磺胺噻唑和蛋氨酸等药物的原料,白色或浅黄色晶体,有苦味。可由氰氨化钙(
]是用来合成磺胺噻唑和蛋氨酸等药物的原料,白色或浅黄色晶体,有苦味。可由氰氨化钙(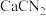 )与
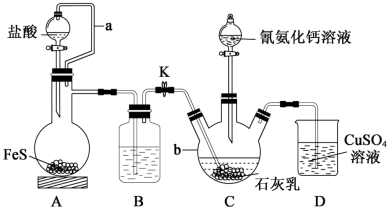
)与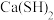 溶液等做原料,在约80℃时反应制取,实验装置(夹持及加热装置已省略)如图。
溶液等做原料,在约80℃时反应制取,实验装置(夹持及加热装置已省略)如图。
回答下列问题:
(1)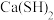 的电子式为
的电子式为_______ 。仪器b的名称是_______ 。
(2)装置A中a的作用是_______ ,A中发生反应的化学方程式为_______ 。
(3)装置B中盛放的试剂是_______ ,其作用是_______ 。
(4)装置C中生成硫脲的总反应为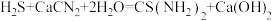 ,若反应分两步进行,写出第二步生成硫脲的化学方程式
,若反应分两步进行,写出第二步生成硫脲的化学方程式_______ 。
(5)装置D的作用为:_______ 。
(6)硫氰化铵(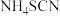 )熔融也可制取硫脲,检验硫氰化铵是否完全转化为硫脲的方法是
)熔融也可制取硫脲,检验硫氰化铵是否完全转化为硫脲的方法是_______ (写出操作步骤和实验现象)。
 ]是用来合成磺胺噻唑和蛋氨酸等药物的原料,白色或浅黄色晶体,有苦味。可由氰氨化钙(
]是用来合成磺胺噻唑和蛋氨酸等药物的原料,白色或浅黄色晶体,有苦味。可由氰氨化钙(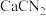 )与
)与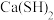 溶液等做原料,在约80℃时反应制取,实验装置(夹持及加热装置已省略)如图。
溶液等做原料,在约80℃时反应制取,实验装置(夹持及加热装置已省略)如图。
回答下列问题:
(1)
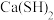 的电子式为
的电子式为(2)装置A中a的作用是
(3)装置B中盛放的试剂是
(4)装置C中生成硫脲的总反应为
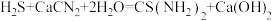 ,若反应分两步进行,写出第二步生成硫脲的化学方程式
,若反应分两步进行,写出第二步生成硫脲的化学方程式(5)装置D的作用为:
(6)硫氰化铵(
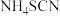 )熔融也可制取硫脲,检验硫氰化铵是否完全转化为硫脲的方法是
)熔融也可制取硫脲,检验硫氰化铵是否完全转化为硫脲的方法是
您最近一年使用:0次
【推荐3】已知难溶电解质在水溶液中存在溶解平衡:MmAn(s) mMn+(aq)+nAm-(aq),Ksp=[c(Mn+)]m·[c(Am-)]n,称为溶度积。某学习小组欲探究CaSO4沉淀转化为CaCO3沉淀的可能性,查得如下资料:(25℃)
mMn+(aq)+nAm-(aq),Ksp=[c(Mn+)]m·[c(Am-)]n,称为溶度积。某学习小组欲探究CaSO4沉淀转化为CaCO3沉淀的可能性,查得如下资料:(25℃)
实验步骤如下:
①往100mL0.1mol·L-1的CaCl2溶液中加入100mL0.1mol·L-1的Na2SO4溶液,立即有白色沉淀生成。
②向上述悬浊液中加入Na2CO3固体3g,搅拌,静置,沉淀后弃去上层清液。
③再加入蒸馏水搅拌,静置,沉淀后再弃去上层清液。
④_____________。
(1)由题中信息知Ksp越大,表示电解质的溶解度越______ (填“大”或“小”)。
(2)写出第②步发生反应的化学方程式:______________________________ 。
(3)设计第③步的目的是_______________________________ 。
(4)请补充第④步操作及发生的现象:__________________________ 。
 mMn+(aq)+nAm-(aq),Ksp=[c(Mn+)]m·[c(Am-)]n,称为溶度积。某学习小组欲探究CaSO4沉淀转化为CaCO3沉淀的可能性,查得如下资料:(25℃)
mMn+(aq)+nAm-(aq),Ksp=[c(Mn+)]m·[c(Am-)]n,称为溶度积。某学习小组欲探究CaSO4沉淀转化为CaCO3沉淀的可能性,查得如下资料:(25℃)| 难溶电解质 | CaCO3 | CaSO4 | MgCO3 | Mg(OH)2 |
Ksp | 2.8×10-9 | 9.1×10-6 | 6.8×10-6 | 1.8×10-11 |
①往100mL0.1mol·L-1的CaCl2溶液中加入100mL0.1mol·L-1的Na2SO4溶液,立即有白色沉淀生成。
②向上述悬浊液中加入Na2CO3固体3g,搅拌,静置,沉淀后弃去上层清液。
③再加入蒸馏水搅拌,静置,沉淀后再弃去上层清液。
④_____________。
(1)由题中信息知Ksp越大,表示电解质的溶解度越
(2)写出第②步发生反应的化学方程式:
(3)设计第③步的目的是
(4)请补充第④步操作及发生的现象:
您最近一年使用:0次
解答题-实验探究题
|
适中
(0.65)
解题方法
【推荐1】二水合草酸亚铁(FeC2O4·2H2O)可用作照相显影剂和制药工业。FeC2O4·2H2O受热分解时生成FeO、CO、CO2、H2O等物质,甲同学利用下图装置(夹持及加热仪器省略)在实验室中对其气体产物进行了探究。
已知常温下CO能与PdCl2溶液反应得到黑色的Pd。
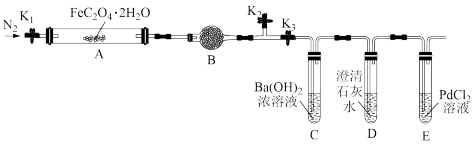
请回答下列问题:
(1)装置B中的试剂为____________ ;装置D的作用为__________________ 。
(2)实验开始前向装置内通入一段时间N2的目的是________________ 。
(3)实验过程中,装置E中除了生成黑色的Pd外还有CO2生成,对应的化学方程式为___________________ 。
(4)反应结束后,需向装置A中再次通入N2,目的是将生成的气体产物全部赶入右侧实验装置中,通入N2的具体实验操作为_________________________ 。
(5)若实验中所用草酸亚铁晶体的质量为36g,装置C中产生的白色沉淀的质量为41.37g,则装置A中发生反应的化学方程式为_______________________ 。
(6)乙同学认为FeC2O4·2H2O分解时得到的CO2的量应高于理论值,他的判断理由为____________ ;请设计实验证明乙同学的观点正确:____________ 。
已知常温下CO能与PdCl2溶液反应得到黑色的Pd。

请回答下列问题:
(1)装置B中的试剂为
(2)实验开始前向装置内通入一段时间N2的目的是
(3)实验过程中,装置E中除了生成黑色的Pd外还有CO2生成,对应的化学方程式为
(4)反应结束后,需向装置A中再次通入N2,目的是将生成的气体产物全部赶入右侧实验装置中,通入N2的具体实验操作为
(5)若实验中所用草酸亚铁晶体的质量为36g,装置C中产生的白色沉淀的质量为41.37g,则装置A中发生反应的化学方程式为
(6)乙同学认为FeC2O4·2H2O分解时得到的CO2的量应高于理论值,他的判断理由为
您最近一年使用:0次
解答题-实验探究题
|
适中
(0.65)
【推荐2】软锰矿的主要成分为MnO2,工业可用其按如下方法制备高锰酸钾:
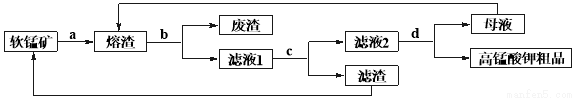
A.将软锰矿初选后粉碎,与固体苛性钾混合,加入反应釜中敞口加热至熔融,并保持熔融状态下搅拌25~30min,冷却得墨绿色熔渣(主要成分为K2MnO4);
B.将熔渣粉碎,加入去离子水溶解,充分搅拌后过滤得墨绿色滤液1;
C.取适量70%硫酸,加入滤液1中,边加边搅拌,直至不再产生棕褐色沉淀,过滤,得紫色滤液2;
d.提纯滤液2即可得高锰酸钾粗品。
根据上述内容回答下列问题:
(1)步骤a中,反应物熔融状态下搅拌的目的是: ,用化学方程式表示出MnO2转化为K2MnO4的反应原理: 。
(2)粉碎后的软锰矿与苛性钾置于 中进行加热。
A.陶瓷反应釜 B.石英反应釜 C.铁制反应釜
(3)写出步骤c中反应的离子方程式: 。
(4)步骤d中由滤液2得到高锰酸钾粗品的主要操作步骤是:加热浓缩、冷却结晶、过滤、____________、干燥。该操作为如何进行___________________。
(5)若将母液循环使用,可能造成的问题是: 。
(6)早先有文献报道:步骤a中加入KClO3固体会缩短流程时间以及提高高锰酸钾的产率,但从绿色化学角度考虑后,现在工厂中一般不采用此法,你认为这种方法不符合绿色化学的原因是: 。

A.将软锰矿初选后粉碎,与固体苛性钾混合,加入反应釜中敞口加热至熔融,并保持熔融状态下搅拌25~30min,冷却得墨绿色熔渣(主要成分为K2MnO4);
B.将熔渣粉碎,加入去离子水溶解,充分搅拌后过滤得墨绿色滤液1;
C.取适量70%硫酸,加入滤液1中,边加边搅拌,直至不再产生棕褐色沉淀,过滤,得紫色滤液2;
d.提纯滤液2即可得高锰酸钾粗品。
根据上述内容回答下列问题:
(1)步骤a中,反应物熔融状态下搅拌的目的是: ,用化学方程式表示出MnO2转化为K2MnO4的反应原理: 。
(2)粉碎后的软锰矿与苛性钾置于 中进行加热。
A.陶瓷反应釜 B.石英反应釜 C.铁制反应釜
(3)写出步骤c中反应的离子方程式: 。
(4)步骤d中由滤液2得到高锰酸钾粗品的主要操作步骤是:加热浓缩、冷却结晶、过滤、____________、干燥。该操作为如何进行___________________。
(5)若将母液循环使用,可能造成的问题是: 。
(6)早先有文献报道:步骤a中加入KClO3固体会缩短流程时间以及提高高锰酸钾的产率,但从绿色化学角度考虑后,现在工厂中一般不采用此法,你认为这种方法不符合绿色化学的原因是: 。
您最近一年使用:0次
解答题-实验探究题
|
适中
(0.65)
名校
【推荐3】CuCl在染色和催化领域应用广泛。实验室利用下图装置(加热和夹持装置略去)将二氧化硫通入新制氢氧化铜悬浊液中制备CuCl。
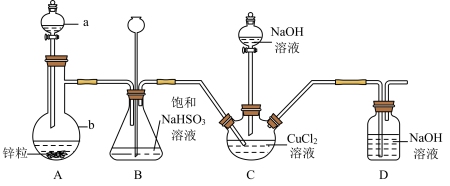
已知:I.CuCl(M=99.0g/mol)为白色固体,难溶于水和乙醇,能溶于浓盐酸;
II.Cu2O+2H+=Cu+Cu2++H2O,CuCl+HCl=HCuCl2,HCuCl2 CuCl↓+HCl。
CuCl↓+HCl。
实验步骤如下:向C中先加入15mL0.5mol·L-1的CuCl2溶液,再加入0.6mol·L-1的NaOH溶液30mL;打开A中分液漏斗的活塞产生SO2气体,一段时间后C中产生白色固体,然后将C中混合物过滤、依次用水和乙醇洗涤、烘干,所得固体质量为0.594g。
(1)试剂a为_______ ,b仪器的名称为_______ 。
(2)B装置的主要作用有三个:
①_______ ;
②平衡装置A到C中气体压强,防止气压过大,气流速度过快;
③指示B、C间导管是否堵塞。
(3)将二氧化硫通入C中新制氢氧化铜悬浊液,产生白色固体的离子方程式为_______ 。
(4)用乙醇洗涤CuCl的优点为_______ 。
(5)计算该实验中CuCl的产率为_______ %。
(6)若所得CuCl固体中混有少量Cu2O,请补充完除去Cu2O的实验方案:
①向产物中滴加试剂_______ ,使固体充分溶解,再过滤出杂质;
②向滤液中加水稀释至不再产生沉淀为止:
③_______ 可得到除去Cu2O后的CuCl固体。

已知:I.CuCl(M=99.0g/mol)为白色固体,难溶于水和乙醇,能溶于浓盐酸;
II.Cu2O+2H+=Cu+Cu2++H2O,CuCl+HCl=HCuCl2,HCuCl2
 CuCl↓+HCl。
CuCl↓+HCl。实验步骤如下:向C中先加入15mL0.5mol·L-1的CuCl2溶液,再加入0.6mol·L-1的NaOH溶液30mL;打开A中分液漏斗的活塞产生SO2气体,一段时间后C中产生白色固体,然后将C中混合物过滤、依次用水和乙醇洗涤、烘干,所得固体质量为0.594g。
(1)试剂a为
(2)B装置的主要作用有三个:
①
②平衡装置A到C中气体压强,防止气压过大,气流速度过快;
③指示B、C间导管是否堵塞。
(3)将二氧化硫通入C中新制氢氧化铜悬浊液,产生白色固体的离子方程式为
(4)用乙醇洗涤CuCl的优点为
(5)计算该实验中CuCl的产率为
(6)若所得CuCl固体中混有少量Cu2O,请补充完除去Cu2O的实验方案:
①向产物中滴加试剂
②向滤液中加水稀释至不再产生沉淀为止:
③
您最近一年使用:0次



