已知难溶电解质在水溶液中存在溶解平衡:MmAn(s) mMn+(aq)+nAm-(aq),Ksp=[c(Mn+)]m·[c(Am-)]n,称为溶度积。某学习小组欲探究CaSO4沉淀转化为CaCO3沉淀的可能性,查得如下资料:(25℃)
mMn+(aq)+nAm-(aq),Ksp=[c(Mn+)]m·[c(Am-)]n,称为溶度积。某学习小组欲探究CaSO4沉淀转化为CaCO3沉淀的可能性,查得如下资料:(25℃)
实验步骤如下:
①往100mL0.1mol·L-1的CaCl2溶液中加入100mL0.1mol·L-1的Na2SO4溶液,立即有白色沉淀生成。
②向上述悬浊液中加入Na2CO3固体3g,搅拌,静置,沉淀后弃去上层清液。
③再加入蒸馏水搅拌,静置,沉淀后再弃去上层清液。
④_____________。
(1)由题中信息知Ksp越大,表示电解质的溶解度越______ (填“大”或“小”)。
(2)写出第②步发生反应的化学方程式:______________________________ 。
(3)设计第③步的目的是_______________________________ 。
(4)请补充第④步操作及发生的现象:__________________________ 。
 mMn+(aq)+nAm-(aq),Ksp=[c(Mn+)]m·[c(Am-)]n,称为溶度积。某学习小组欲探究CaSO4沉淀转化为CaCO3沉淀的可能性,查得如下资料:(25℃)
mMn+(aq)+nAm-(aq),Ksp=[c(Mn+)]m·[c(Am-)]n,称为溶度积。某学习小组欲探究CaSO4沉淀转化为CaCO3沉淀的可能性,查得如下资料:(25℃)| 难溶电解质 | CaCO3 | CaSO4 | MgCO3 | Mg(OH)2 |
Ksp | 2.8×10-9 | 9.1×10-6 | 6.8×10-6 | 1.8×10-11 |
①往100mL0.1mol·L-1的CaCl2溶液中加入100mL0.1mol·L-1的Na2SO4溶液,立即有白色沉淀生成。
②向上述悬浊液中加入Na2CO3固体3g,搅拌,静置,沉淀后弃去上层清液。
③再加入蒸馏水搅拌,静置,沉淀后再弃去上层清液。
④_____________。
(1)由题中信息知Ksp越大,表示电解质的溶解度越
(2)写出第②步发生反应的化学方程式:
(3)设计第③步的目的是
(4)请补充第④步操作及发生的现象:
11-12高二·全国·课时练习 查看更多[4]
(已下线)2012年人教版高中化学选修4 3.4难溶电解质的溶解平衡练习卷(已下线)2012-2013学年河南省安阳一中高二上学期期末考试化学试卷(已下线)易错17 难溶电解质的溶解平衡及应用-备战2021年高考化学一轮复习易错题福建省仙游第一中学2022-2023学年高二下学期第一次月考化学试题
更新时间:2020-11-02 20:19:19
|
相似题推荐
解答题-工业流程题
|
适中
(0.65)
解题方法
【推荐1】二氧化锰不仅是活性好的催化剂,也被广泛用作干电池的正极材料。某化学小组设计用高硫锰矿(主要成分为锰的化合物和硫化亚铁)为原料制取二氧化锰的工艺流程如图:
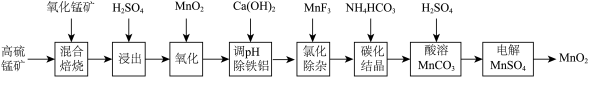
已知:①“混合焙烧”后的烧渣含MnSO4、Fe2O3及少量FeO、MgO、Al2O3
②在该条件下,金属离子开始沉淀和完全沉淀的pH如下表。
(1)写出浸出时与铝元素有关的离子反应方程式__ 。
(2)上述“氧化”步骤是否可省略__ (填“是”或“否”),你的依据是__ 。
(3)“调pH除铁铝’’时,生成沉淀的pH范围为__ ;“氟化除杂”中除去的离子为__ 。
(4)请用平衡移动原理解释除杂处理后的Mn2+用NH4HCO3转化成MnCO3沉淀的过程__ (用文字和离子方程式表达)。
(5)用惰性电极电解MnSO4制备MnO2时,其阳极反应式为__ ;整个流程中能够循环利用的物质除MnO2外还有__ (写名称)。

已知:①“混合焙烧”后的烧渣含MnSO4、Fe2O3及少量FeO、MgO、Al2O3
②在该条件下,金属离子开始沉淀和完全沉淀的pH如下表。
| 金属离子 | Fe3+ | Fe2+ | Al3+ | Mn2+ |
| 开始沉淀 | 1.8 | 6.8 | 4.0 | 7.5 |
| 完全沉淀 | 3.2 | 8.0 | 5.0 | 8.4 |
(2)上述“氧化”步骤是否可省略
(3)“调pH除铁铝’’时,生成沉淀的pH范围为
(4)请用平衡移动原理解释除杂处理后的Mn2+用NH4HCO3转化成MnCO3沉淀的过程
(5)用惰性电极电解MnSO4制备MnO2时,其阳极反应式为
您最近一年使用:0次
解答题-工业流程题
|
适中
(0.65)
解题方法
【推荐2】新一代脱硝催化剂(SCR)(主要含TiO2、V2O5,及SiO2、Al2O3等)。该SCR的使用寿命为3年左右,废弃SCR回收再利用至关重要。湿法回收SCR的工艺流程如下:
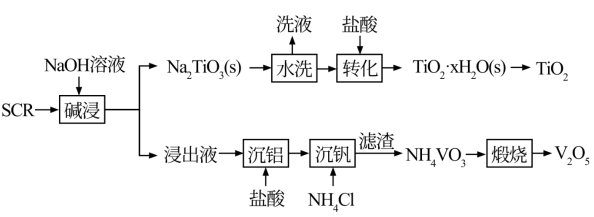
已知:V2O5是两性氧化物,在弱碱性条件下即可生成VO3,VO3易水解。Na₂TiO3难溶于水。回答下列问题:
(1)“碱浸”时,提高浸出率的措施有___________ (写出一种措施即可)。
(2)“沉铝”过程中得到的沉淀主要成分是___________ (填化学式)
(3)“转化”时的离子方程式为___________ 。
(4)“沉钒”中析出NH4VO3晶体时,需要加入过量的NH4C1,其原因是___________ 。
(5)已知NH4VO3难溶于水,Ksp=3.0×10-8,向10mL0.1mol·L-1NaVO3的滤液中加入等体积的NH4Cl溶液(忽略混合过程中的体积变化),欲使VO 沉淀完全,则NH4Cl溶液的最小浓度为
沉淀完全,则NH4Cl溶液的最小浓度为___________ (溶液中某离子浓度≤1×10-5mol·L-1时,认为该离子沉淀完全)。
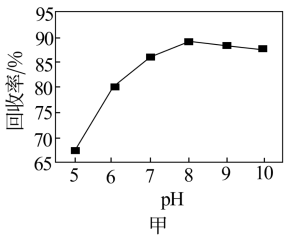
(6)钒回收率随溶液pH的变化如图甲所示,试分析pH在8左右时钒回收率最高的原因:___________ 。
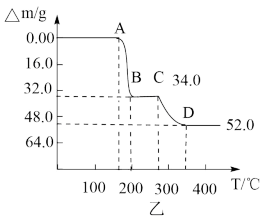
(7)为研究“煅烧”过程中发生的化学变化,某研究小组取234gNH4VO3进行探究,煅烧过程中减少的质量(Δm)随温度变化的曲线如图乙所示,则D点所得物质的化学式为___________

已知:V2O5是两性氧化物,在弱碱性条件下即可生成VO3,VO3易水解。Na₂TiO3难溶于水。回答下列问题:
(1)“碱浸”时,提高浸出率的措施有
(2)“沉铝”过程中得到的沉淀主要成分是
(3)“转化”时的离子方程式为
(4)“沉钒”中析出NH4VO3晶体时,需要加入过量的NH4C1,其原因是
(5)已知NH4VO3难溶于水,Ksp=3.0×10-8,向10mL0.1mol·L-1NaVO3的滤液中加入等体积的NH4Cl溶液(忽略混合过程中的体积变化),欲使VO
 沉淀完全,则NH4Cl溶液的最小浓度为
沉淀完全,则NH4Cl溶液的最小浓度为(6)钒回收率随溶液pH的变化如图甲所示,试分析pH在8左右时钒回收率最高的原因:

(7)为研究“煅烧”过程中发生的化学变化,某研究小组取234gNH4VO3进行探究,煅烧过程中减少的质量(Δm)随温度变化的曲线如图乙所示,则D点所得物质的化学式为

您最近一年使用:0次
解答题-原理综合题
|
适中
(0.65)
名校
【推荐3】近期发现, 是继NO、CO之后的第三个生命体系气体信号分子,它具有参与调节神经信号传递、舒张血管减轻高血压的功能。回答下列问题:
是继NO、CO之后的第三个生命体系气体信号分子,它具有参与调节神经信号传递、舒张血管减轻高血压的功能。回答下列问题:
(1)下列事实中,不能比较氢硫酸与亚硫酸的酸性强弱的是___________ (填标号)
a.氢硫酸不能与碳酸氢钠溶液反应,而亚硫酸可以
b.常温下,氢硫酸的导电能力低于相同浓度的亚硫酸
c.常温下, 的氢硫酸和亚硫酸的
的氢硫酸和亚硫酸的 分别为4.5和2.1
分别为4.5和2.1
d.氢硫酸的还原性强于亚硫酸
(2)向 的水溶液中缓慢通入
的水溶液中缓慢通入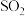 至饱和,再继续通一段时间,整个过程中
至饱和,再继续通一段时间,整个过程中 的变化情况为
的变化情况为___________
(3)常温下,向 溶液中通入
溶液中通入 气体或加入
气体或加入 固体,测得
固体,测得 与溶液
与溶液 的关系如图(忽略溶液体积的变化及
的关系如图(忽略溶液体积的变化及 的挥发)。请计算:
的挥发)。请计算:
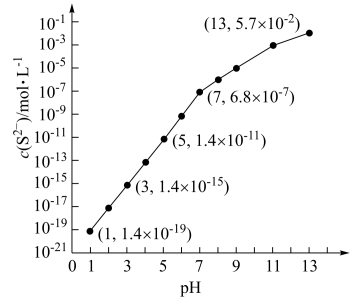
①当溶液中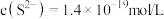 ,溶液中,水电离产生的
,溶液中,水电离产生的
___________ 
②当 时,溶液中
时,溶液中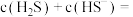
___________ 
(4)向 溶液中滴加饱和
溶液中滴加饱和 溶液,没有沉淀生成,继续滴加一定量的氨水后,生成
溶液,没有沉淀生成,继续滴加一定量的氨水后,生成 沉淀。用电离平衡原理解释上述现象
沉淀。用电离平衡原理解释上述现象___________
 是继NO、CO之后的第三个生命体系气体信号分子,它具有参与调节神经信号传递、舒张血管减轻高血压的功能。回答下列问题:
是继NO、CO之后的第三个生命体系气体信号分子,它具有参与调节神经信号传递、舒张血管减轻高血压的功能。回答下列问题:(1)下列事实中,不能比较氢硫酸与亚硫酸的酸性强弱的是
a.氢硫酸不能与碳酸氢钠溶液反应,而亚硫酸可以
b.常温下,氢硫酸的导电能力低于相同浓度的亚硫酸
c.常温下,
 的氢硫酸和亚硫酸的
的氢硫酸和亚硫酸的 分别为4.5和2.1
分别为4.5和2.1d.氢硫酸的还原性强于亚硫酸
(2)向
 的水溶液中缓慢通入
的水溶液中缓慢通入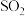 至饱和,再继续通一段时间,整个过程中
至饱和,再继续通一段时间,整个过程中 的变化情况为
的变化情况为(3)常温下,向
 溶液中通入
溶液中通入 气体或加入
气体或加入 固体,测得
固体,测得 与溶液
与溶液 的关系如图(忽略溶液体积的变化及
的关系如图(忽略溶液体积的变化及 的挥发)。请计算:
的挥发)。请计算:
①当溶液中
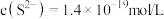 ,溶液中,水电离产生的
,溶液中,水电离产生的

②当
 时,溶液中
时,溶液中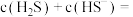

(4)向
 溶液中滴加饱和
溶液中滴加饱和 溶液,没有沉淀生成,继续滴加一定量的氨水后,生成
溶液,没有沉淀生成,继续滴加一定量的氨水后,生成 沉淀。用电离平衡原理解释上述现象
沉淀。用电离平衡原理解释上述现象
您最近一年使用:0次
解答题-原理综合题
|
适中
(0.65)
【推荐1】平衡,可逆反应的宿命,可逆反应永恒的话题。
(1)在一体积为10L的容器中,通入一定量的CO和H2O,在一定温度时发生反应,4s后达到平衡状态。CO+H2O(g)⇌CO2+H2;△H<0
①CO和H2O的浓度变化如下图所示,则在0~4s时正反应的平均反应速率为v(CO2)=_______ mol·L-1·min-1
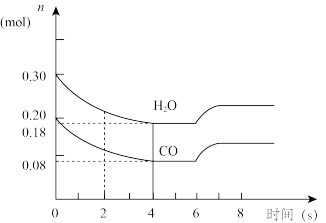
②图中6~7s之间反应向_______ (填左、右或不)移动,原因可能是_______ (填字母代号)
A.只充入水蒸气 B.只降低温度 C.只使用催化剂
D.只充入惰性气体 E.增大压强 F.只充入CO2
(2)在25℃下,将amol·L-1的醋酸与0.01mol·L-1的NaOH等体积混合,反应平衡时溶液中c(Na+)=c(CH3COO-),则溶液显_______ 性(填“酸”“碱”或“中”);用含a的代数式表示CH3COOH的电离常数Ka=_______ 。
(3)氨气的水溶液称为氨水,它的主要存在微粒是NH3·H2O。
已知:a.常温下,醋酸和NH3·H2O的电离平衡常数均为1.74×10-5mol/L
b.CH3COOH+NaHCO3=CH3COONa+CO2↑+H2O
则CH3COONH4溶液呈_______ 性(填“酸”、“碱”或“中”),NH4HCO3溶液呈_______ 性(填“酸”、“碱”或“中”),NH4HCO3溶液中浓度最大的离子是_______ (填离子的名称)
(4)已知常温下Ksp[Cu(OH)2]=2.2×10-20,Ksp[Fe(OH)3]=1.0×10-38。现有0.1mol·L-1的CuCl2溶液中含有Fe3+,调节pH=3.0使Fe3+沉淀完全[即当c(Fe3+)<10-5mol·L-1时认为沉淀完全]此时Cu2+是否开始沉淀_______ (填“是”或“否”)。
(1)在一体积为10L的容器中,通入一定量的CO和H2O,在一定温度时发生反应,4s后达到平衡状态。CO+H2O(g)⇌CO2+H2;△H<0
①CO和H2O的浓度变化如下图所示,则在0~4s时正反应的平均反应速率为v(CO2)=

②图中6~7s之间反应向
A.只充入水蒸气 B.只降低温度 C.只使用催化剂
D.只充入惰性气体 E.增大压强 F.只充入CO2
(2)在25℃下,将amol·L-1的醋酸与0.01mol·L-1的NaOH等体积混合,反应平衡时溶液中c(Na+)=c(CH3COO-),则溶液显
(3)氨气的水溶液称为氨水,它的主要存在微粒是NH3·H2O。
已知:a.常温下,醋酸和NH3·H2O的电离平衡常数均为1.74×10-5mol/L
b.CH3COOH+NaHCO3=CH3COONa+CO2↑+H2O
则CH3COONH4溶液呈
(4)已知常温下Ksp[Cu(OH)2]=2.2×10-20,Ksp[Fe(OH)3]=1.0×10-38。现有0.1mol·L-1的CuCl2溶液中含有Fe3+,调节pH=3.0使Fe3+沉淀完全[即当c(Fe3+)<10-5mol·L-1时认为沉淀完全]此时Cu2+是否开始沉淀
您最近一年使用:0次
解答题-原理综合题
|
适中
(0.65)
名校
【推荐2】物质在水中可能存在电离平衡、水解平衡和沉淀溶解平衡。请回答下列问题:
(1)①碳酸钠俗称_______ ,(填选项)
A.烧碱 B.苏打 C.小苏打 D.火碱
②可作为碱使用的原因是_______ (填选项)。
A.碳酸钠是碱
B.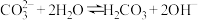
C.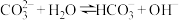
(2)为抑制水解,实验室中配制 溶液时将
溶液时将 固体溶解在浓
固体溶解在浓_______ 里面(填名称);将 溶液和
溶液和 溶液混合,产生红褐色沉淀和无色气体,红褐色沉淀是
溶液混合,产生红褐色沉淀和无色气体,红褐色沉淀是_______ (填名称,下同),无色气体是_______ 。
(3)25℃时,pH均为5的醋酸和硫酸铝两种溶液中,由水电离出的 之比为
之比为_______ 。(填选项)
A.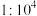 B.
B.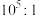 C.
C.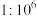
(4)25℃时, ,现将足量氯化银固体放入100mL0.2mol/L
,现将足量氯化银固体放入100mL0.2mol/L 溶液中,则溶液中氯离子的浓度为
溶液中,则溶液中氯离子的浓度为_______  (忽略溶液体积的变化)(填选项)
(忽略溶液体积的变化)(填选项)
A. B.
B. C.
C.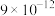
(5)某温度时, ,
,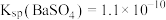 。在该温度下,向含有
。在该温度下,向含有 固体的溶液中滴加
固体的溶液中滴加 溶液,当有
溶液,当有 沉淀生成时溶液中
沉淀生成时溶液中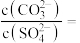
_______ (保留三位有效数字)。
(1)①碳酸钠俗称
A.烧碱 B.苏打 C.小苏打 D.火碱
②可作为碱使用的原因是
A.碳酸钠是碱
B.
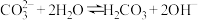
C.
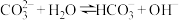
(2)为抑制水解,实验室中配制
 溶液时将
溶液时将 固体溶解在浓
固体溶解在浓 溶液和
溶液和 溶液混合,产生红褐色沉淀和无色气体,红褐色沉淀是
溶液混合,产生红褐色沉淀和无色气体,红褐色沉淀是(3)25℃时,pH均为5的醋酸和硫酸铝两种溶液中,由水电离出的
 之比为
之比为A.
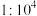 B.
B.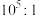 C.
C.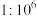
(4)25℃时,
 ,现将足量氯化银固体放入100mL0.2mol/L
,现将足量氯化银固体放入100mL0.2mol/L 溶液中,则溶液中氯离子的浓度为
溶液中,则溶液中氯离子的浓度为 (忽略溶液体积的变化)(填选项)
(忽略溶液体积的变化)(填选项)A.
 B.
B. C.
C.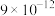
(5)某温度时,
 ,
,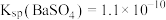 。在该温度下,向含有
。在该温度下,向含有 固体的溶液中滴加
固体的溶液中滴加 溶液,当有
溶液,当有 沉淀生成时溶液中
沉淀生成时溶液中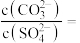
您最近一年使用:0次
解答题-实验探究题
|
适中
(0.65)
名校
【推荐3】化学小组实验探究SO2与AgNO3溶液的反应。
(1)实验一:用如下装置(夹持、加热仪器略)制备SO2,将足量SO2通入AgNO3溶液中,迅速反应,得到无色溶液A和白色沉淀B。
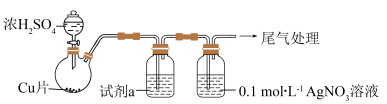
尾气吸收所用试剂是_______ 。
(2)对体系中有关物质性质分析得出:沉淀B可能为Ag2SO3、Ag2SO4或二者混合物。(资料:Ag2SO4微溶于水;Ag2SO3难溶于水)
实验二:验证B的成分

①写出Ag2SO3溶于氨水的离子方程式:_______ 。
②加入盐酸后沉淀D大部分溶解,剩余少量沉淀F。推断D中主要是BaSO3,进而推断B中含有Ag2SO3。向滤液E中加入一种试剂,可进一步证实B中含有Ag2SO3。所用试剂及现象是_______ 。
(3)根据沉淀F的存在,推测 的产生有两个途径:
的产生有两个途径:
途径1:实验一中,SO2在AgNO3溶液中被氧化生成Ag2SO4,随沉淀B进入D。
途径2:实验二中, 被氧化为
被氧化为 进入D。
进入D。
实验三:探究 的产生途径
的产生途径
①向溶液A中滴入过量盐酸,产生白色沉淀,取上层清液继续滴加BaCl2溶液,未出现白色沉淀,可判断B中不含Ag2SO4.做出判断的理由:_______ 。
②实验三的结论:_______ 。
(4)实验一中,SO2与AgNO3溶液反应的离子方程式是_______ 。
(1)实验一:用如下装置(夹持、加热仪器略)制备SO2,将足量SO2通入AgNO3溶液中,迅速反应,得到无色溶液A和白色沉淀B。

尾气吸收所用试剂是
(2)对体系中有关物质性质分析得出:沉淀B可能为Ag2SO3、Ag2SO4或二者混合物。(资料:Ag2SO4微溶于水;Ag2SO3难溶于水)
实验二:验证B的成分

①写出Ag2SO3溶于氨水的离子方程式:
②加入盐酸后沉淀D大部分溶解,剩余少量沉淀F。推断D中主要是BaSO3,进而推断B中含有Ag2SO3。向滤液E中加入一种试剂,可进一步证实B中含有Ag2SO3。所用试剂及现象是
(3)根据沉淀F的存在,推测
 的产生有两个途径:
的产生有两个途径:途径1:实验一中,SO2在AgNO3溶液中被氧化生成Ag2SO4,随沉淀B进入D。
途径2:实验二中,
 被氧化为
被氧化为 进入D。
进入D。实验三:探究
 的产生途径
的产生途径①向溶液A中滴入过量盐酸,产生白色沉淀,取上层清液继续滴加BaCl2溶液,未出现白色沉淀,可判断B中不含Ag2SO4.做出判断的理由:
②实验三的结论:
(4)实验一中,SO2与AgNO3溶液反应的离子方程式是
您最近一年使用:0次
解答题-实验探究题
|
适中
(0.65)
解题方法
【推荐1】现有5瓶失去标签的液体,已知它们分别是苯、乙醇、乙酸、葡萄糖溶液、乙酸乙酯中的一种,现通过如下实验来确定各试剂瓶中所装液体的成分。
(1)A为_______ ,E中溶质的分子式为_______ 。
(2)B中所含官能团的名称为_______ 。
(3)C的二氯代物有_______ 种。
(4)写出C在Ni做催化剂的条件下与H2反应的化学方程式_______ 。
(5)乙醇可通过乙烯与水在一定条件下反应得到,其对应的化学方程式为_______ ,反应类型为_______ 。
| 实验步骤与方法 | 实验现象 |
| ①将5瓶液体分别依次标号为A、B、C、D、E,然后闻气味 | 只有E没有明显气味 |
| ②各取少量5种液体于试管中,加水稀释 | 只有C、D不溶解并浮在水面上 |
| ③各取少量5种液体于试管中,滴加新制Cu( OH)2悬浊液并加热 | 只有 B使悬浊液中的固体溶解,E中产生砖红色沉淀 |
| ④各取少量C、D于试管中,加NaOH稀溶液并加热 | 只有C仍有分层现象,在D的试管口闻到特殊香味 |
(2)B中所含官能团的名称为
(3)C的二氯代物有
(4)写出C在Ni做催化剂的条件下与H2反应的化学方程式
(5)乙醇可通过乙烯与水在一定条件下反应得到,其对应的化学方程式为
您最近一年使用:0次
解答题-工业流程题
|
适中
(0.65)
解题方法
【推荐2】以黄铁矿(主要成分 )为原料生产硫酸,应将产出的炉渣和尾气进行资源化综合利用,减轻对环境的污染。其中一种流程如下图所示。
)为原料生产硫酸,应将产出的炉渣和尾气进行资源化综合利用,减轻对环境的污染。其中一种流程如下图所示。
(1)黄铁矿中硫元素的化合价为___________ 。
(2)“氧化”时,反应的化学方程式为___________ 。
(3)工业上,吸收 时宜选用的试剂X为
时宜选用的试剂X为___________ (填“水”或“浓硫酸”)。
(4) 高温灼烧时,火焰呈
高温灼烧时,火焰呈___________ 色。
(5) 在保存过程中发生
在保存过程中发生___________ (填“氧化”或“还原”)反应,导致商品 中不可避免地存在
中不可避免地存在 ,欲检验其中的
,欲检验其中的 ,可取少量样品溶于水中,
,可取少量样品溶于水中,___________ ,说明含有 。
。
(6)一般用K2Cr2O7滴定分析法测定还原铁粉纯度。实验步骤:称取一定量样品,用过量稀硫酸溶解,用已知浓度的K2Cr2O7溶液测定其中的Fe2+。反应原理为___________Cr2O +___________Fe2++___________H+=___________Cr3++___________Fe3++___________H2O。
+___________Fe2++___________H+=___________Cr3++___________Fe3++___________H2O。
①配平上述离子反应方程式___________ 。
②某次实验称取0.2800g样品,测定时消耗浓度为0.03000mol·L-1的K2Cr2O7溶液25.10mL,则样品中铁含量为___________ %(保留至小数点后第一位)。
 )为原料生产硫酸,应将产出的炉渣和尾气进行资源化综合利用,减轻对环境的污染。其中一种流程如下图所示。
)为原料生产硫酸,应将产出的炉渣和尾气进行资源化综合利用,减轻对环境的污染。其中一种流程如下图所示。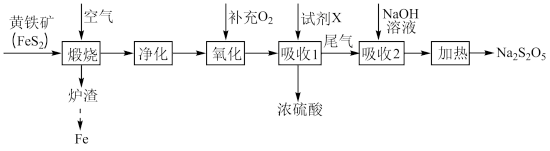
(1)黄铁矿中硫元素的化合价为
(2)“氧化”时,反应的化学方程式为
(3)工业上,吸收
 时宜选用的试剂X为
时宜选用的试剂X为(4)
 高温灼烧时,火焰呈
高温灼烧时,火焰呈(5)
 在保存过程中发生
在保存过程中发生 中不可避免地存在
中不可避免地存在 ,欲检验其中的
,欲检验其中的 ,可取少量样品溶于水中,
,可取少量样品溶于水中, 。
。(6)一般用K2Cr2O7滴定分析法测定还原铁粉纯度。实验步骤:称取一定量样品,用过量稀硫酸溶解,用已知浓度的K2Cr2O7溶液测定其中的Fe2+。反应原理为___________Cr2O
 +___________Fe2++___________H+=___________Cr3++___________Fe3++___________H2O。
+___________Fe2++___________H+=___________Cr3++___________Fe3++___________H2O。①配平上述离子反应方程式
②某次实验称取0.2800g样品,测定时消耗浓度为0.03000mol·L-1的K2Cr2O7溶液25.10mL,则样品中铁含量为
您最近一年使用:0次
解答题-实验探究题
|
适中
(0.65)
【推荐3】二氧化氯(C1O2)是黄绿色气体,易溶于水但不与水反应,沸点为11℃,工业上可利用ClO2处理含硫废水。学习小组在实验室中探究C1O2与Na2S的反应。回答下列问题:
(1)ClO2的制备和收集

①装置B的作用是_________ 。
②C中有NaHSO4生成,反应的化学方程式为________ 。
③欲收集干燥的ClO2,选择上图中的装置,按气流方向连接顺序为a→______ (用小写字母表示)。
(2)C1O2与Na2S的反应
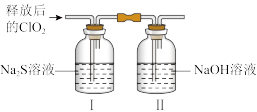
用N2稀释C1O2以增强其稳定性,将适量稀释后的C1O2通入下图所示装置中,充分反应,I中得到无色澄清溶液。
①小组同学根据实验现象,对S2-氧化产物做如下假设:
假设1:S2-被氧化为SO2。
假设2:S2-被氧化为________ 。
②继续实验,探究上述假设是否正确。
a.取上述装置I中溶液于试管中,加入氢氧化钡溶液,生成白色沉淀,过滤。
b.取a中所得白色沉淀于试管中,加入盐酸,滴入2滴品红溶液,无明显现象。则上述假设正确的是________ 。
③C1O2与Na2S反应的离子方程式为__________ 。
(1)ClO2的制备和收集

①装置B的作用是
②C中有NaHSO4生成,反应的化学方程式为
③欲收集干燥的ClO2,选择上图中的装置,按气流方向连接顺序为a→
(2)C1O2与Na2S的反应
用N2稀释C1O2以增强其稳定性,将适量稀释后的C1O2通入下图所示装置中,充分反应,I中得到无色澄清溶液。

①小组同学根据实验现象,对S2-氧化产物做如下假设:
假设1:S2-被氧化为SO2。
假设2:S2-被氧化为
②继续实验,探究上述假设是否正确。
a.取上述装置I中溶液于试管中,加入氢氧化钡溶液,生成白色沉淀,过滤。
b.取a中所得白色沉淀于试管中,加入盐酸,滴入2滴品红溶液,无明显现象。则上述假设正确的是
③C1O2与Na2S反应的离子方程式为
您最近一年使用:0次



