Li3Fe2(PO4)3作为锂离子电池的负极材料时有良好的放电平台,通过提高材料的电导率可以有效的改善材料的性能。配平下列反应的化学方程式。___ Li3Fe2(PO4)3+1Fe2O3+CO→CO2+LiFePO4
更新时间:2020-02-26 21:08:21
|
【知识点】 氧化还原反应方程式的配平解读
相似题推荐
填空题
|
适中
(0.65)
名校
【推荐1】要准确掌握化学基本概念和研究方法。按要求回答下列问题:
(1)下列是某同学对有关物质进行分类的列表
每组分类均有错误,其错误的物质分别是第一组__ 、第二组__ (填化学式)。
(2)一个密闭容器中放入M、N、Q、P四种物质,在一定条件下发生化学反应,一段时间后,测得有关数据如下表,按要求回答下列问题:
①该变化的基本反应类型是___ 反应;
②物质Q在反应中可能起的作用是___ 。
(3)向NaHSO4溶液中逐滴加入Ba(OH)2溶液至中性,请写出发生反应的离子方程式:__ 。
(4)已知反应:2KMnO4+16HCl(浓)=2KCl+2MnCl2+5Cl2↑+8H2O
①用双线桥 表示上述反应中电子转移的方向和数目__ 。
②浓盐酸在该反应中表现的性质是__ (填序号)。
A.只有还原性 B.还原性和酸性
C.只有氧化性 D.氧化性和酸性
(1)下列是某同学对有关物质进行分类的列表
| 碱 | 酸 | 盐 | 碱性氧化物 | 酸性氧化物 | |
| 第一组 | Na2CO3 | H2SO4 | NaHCO3 | CaO | CO2 |
| 第二组 | NaOH | HCl | NaCl | Na2O | CO |
每组分类均有错误,其错误的物质分别是第一组
(2)一个密闭容器中放入M、N、Q、P四种物质,在一定条件下发生化学反应,一段时间后,测得有关数据如下表,按要求回答下列问题:
| 物质 | M | N | Q | P |
| 反应前质量/g | 50 | 1 | 3 | 12 |
| 反应后质量/g | x | 26 | 3 | 30 |
①该变化的基本反应类型是
②物质Q在反应中可能起的作用是
(3)向NaHSO4溶液中逐滴加入Ba(OH)2溶液至中性,请写出发生反应的离子方程式:
(4)已知反应:2KMnO4+16HCl(浓)=2KCl+2MnCl2+5Cl2↑+8H2O
①用
②浓盐酸在该反应中表现的性质是
A.只有还原性 B.还原性和酸性
C.只有氧化性 D.氧化性和酸性
您最近半年使用:0次
填空题
|
适中
(0.65)
解题方法
【推荐2】高铁酸钾(K2FeO4)是一种新型、高效、多功能绿色水处理剂,无二次污染。工业上是先制得高铁酸钠,然后在低温下,向高铁酸钠溶液中加入KOH至饱和,使高铁酸钾析出。
回答下列问题:
(1)干法制备高铁酸钠的主要反应为2FeSO4+6Na2O2=2Na2FeO4+2Na2O+2Na2SO4+O2↑。
①该反应中还原剂是___ 。每生成1molO2,该反应转移___ mol电子。
②K2FeO4在水处理过程中所起的作用是___ 。
(2)湿法制备高铁酸钾(K2FeO4)的反应体系中有六种微粒:Fe(OH)3、ClO-、OH-、FeO42-、Cl-、H2O。
①写出并配平湿法制高铁酸钾的离子反应方程式:___ 。
②低温下,在高铁酸钠溶液中加入KOH至饱和可析出高铁酸钾(K2FeO4),其原因是___ 。
回答下列问题:
(1)干法制备高铁酸钠的主要反应为2FeSO4+6Na2O2=2Na2FeO4+2Na2O+2Na2SO4+O2↑。
①该反应中还原剂是
②K2FeO4在水处理过程中所起的作用是
(2)湿法制备高铁酸钾(K2FeO4)的反应体系中有六种微粒:Fe(OH)3、ClO-、OH-、FeO42-、Cl-、H2O。
①写出并配平湿法制高铁酸钾的离子反应方程式:
②低温下,在高铁酸钠溶液中加入KOH至饱和可析出高铁酸钾(K2FeO4),其原因是
您最近半年使用:0次
填空题
|
适中
(0.65)
解题方法
【推荐3】硅是构成矿物和岩石的主要成分,单质硅及其化合物具有广泛的用途。完成下列填空:
(1)某些硅酸盐具有筛选分子的功能。一种硅酸盐的组成为:M2O·R2O3·2SiO2·nH2O,已知元素M、R均位于元素周期表的第3周期,两元素原子的质子数之和为24。
①写出M原子核外能量最高的电子的电子排布式:___________ 。
②常温下,不能与R单质发生反应的是_______ (选填序号)。
a.CuCl2溶液 b.Fe2O3 c.浓硫酸 d.NaOH溶液 e.Na2CO3固体
(2)氮化硅(Si3N4)陶瓷材料硬度大、熔点高。可由下列反应制得:SiO2+C+N2 Si3N4+CO
Si3N4+CO
①Si3N4中氮元素的化合价为-3,请解释Si3N4中氮元素化合价为负价的原因__________________ 。
②C3N4的结构与Si3N4相似,请比较二者熔点高低,并说明理由:______________________ 。
③配平上述反应的化学方程式,并标出电子转移的数目和方向。_______________ 。
(3)一种用工业硅(含少量铁、铜等金属的氧化物)制备Si3N4的主要流程如下:
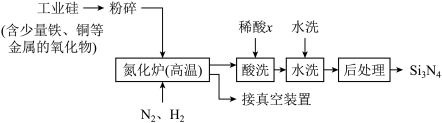
①将工业硅粉碎的目的是______________________________ 。
②适量的H2是为了排尽设备中的空气,但H2在高温下也能还原工业硅中的某些金属化物。 可能是
可能是______ (选填:“盐酸”“硝酸”或“硫酸”),理由是_____________________ 。
(1)某些硅酸盐具有筛选分子的功能。一种硅酸盐的组成为:M2O·R2O3·2SiO2·nH2O,已知元素M、R均位于元素周期表的第3周期,两元素原子的质子数之和为24。
①写出M原子核外能量最高的电子的电子排布式:
②常温下,不能与R单质发生反应的是
a.CuCl2溶液 b.Fe2O3 c.浓硫酸 d.NaOH溶液 e.Na2CO3固体
(2)氮化硅(Si3N4)陶瓷材料硬度大、熔点高。可由下列反应制得:SiO2+C+N2
 Si3N4+CO
Si3N4+CO①Si3N4中氮元素的化合价为-3,请解释Si3N4中氮元素化合价为负价的原因
②C3N4的结构与Si3N4相似,请比较二者熔点高低,并说明理由:
③配平上述反应的化学方程式,并标出电子转移的数目和方向。
(3)一种用工业硅(含少量铁、铜等金属的氧化物)制备Si3N4的主要流程如下:

①将工业硅粉碎的目的是
②适量的H2是为了排尽设备中的空气,但H2在高温下也能还原工业硅中的某些金属化物。
 可能是
可能是
您最近半年使用:0次



