实验室以海绵铜(主要成分为Cu和CuO)为原料制取CuCl的主要流程如图:
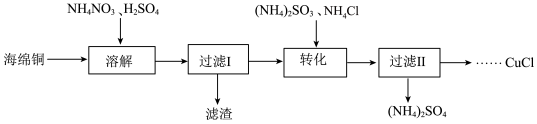
已知:①CuCl为白色固体,难溶于水和乙醇,可溶于氯离子浓度较大的溶液中。
②CuCl有水存在时在空气中易被氧化,在酸性条件下较稳定。
(1)“溶解”时选用约为0.5mol•L-1的硫酸,过程中无气体产生。若硫酸浓度过大,反应会产生NO、NO2等有害气体,NH4NO3的用量会___ (填“增大”或“减小”或“不变”)。
(2)“转化”步骤中发生反应的离子方程式为___ 。加入的(NH4)2SO3需要适当过量的原因是__ 。
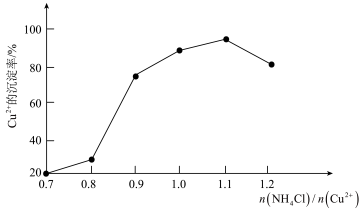
(3)氯化铵用量[ ]与Cu2+沉淀率的关系如图所示。随着氯化铵用量的增多Cu2+沉淀率增加,但当氯化铵用量增加到一定程度后Cu2+的沉淀率减少,其原因是
]与Cu2+沉淀率的关系如图所示。随着氯化铵用量的增多Cu2+沉淀率增加,但当氯化铵用量增加到一定程度后Cu2+的沉淀率减少,其原因是___ 。
(4)检验CuCl沉淀是否洗涤完全的方法是___ 。
(5)若CuCl产品中混有少量CaSO4,设计提纯CuCl的实验方案:__ 。(实验中可选试剂:0.1mol•L-1盐酸、10mol•L-1盐酸、蒸馏水、无水乙醇)

已知:①CuCl为白色固体,难溶于水和乙醇,可溶于氯离子浓度较大的溶液中。
②CuCl有水存在时在空气中易被氧化,在酸性条件下较稳定。
(1)“溶解”时选用约为0.5mol•L-1的硫酸,过程中无气体产生。若硫酸浓度过大,反应会产生NO、NO2等有害气体,NH4NO3的用量会
(2)“转化”步骤中发生反应的离子方程式为
(3)氯化铵用量[
 ]与Cu2+沉淀率的关系如图所示。随着氯化铵用量的增多Cu2+沉淀率增加,但当氯化铵用量增加到一定程度后Cu2+的沉淀率减少,其原因是
]与Cu2+沉淀率的关系如图所示。随着氯化铵用量的增多Cu2+沉淀率增加,但当氯化铵用量增加到一定程度后Cu2+的沉淀率减少,其原因是
(4)检验CuCl沉淀是否洗涤完全的方法是
(5)若CuCl产品中混有少量CaSO4,设计提纯CuCl的实验方案:
更新时间:2020-02-27 12:53:44
|
相似题推荐
解答题-实验探究题
|
适中
(0.65)
【推荐1】硫酸铜是一种用途广泛的化工原料。将适量稀硝酸分多次加入到铜粉与稀硫酸的混合物中,加热使之反应完全,通过蒸发、结晶,得到硫酸铜晶体(装置如图所示)。
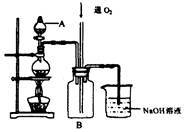
(1)图中烧瓶内发生的离子反应方程式为:________________
(2)反应时B瓶内的现象是___________________________
(3)为符合绿色化学的要求,某研究性学习小组进行如下设计:
第一组:以空气为氧化剂法
把Fe2(SO4)3作催化剂加入到铜粉与稀硫酸的混合物中,并通入空气或氧气,即发生反应。反应完全后向其中加入物质甲调节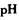 ,产生Fe(OH)3,过滤、蒸发、结晶,得到硫酸铜晶体,滤渣作催化剂循环使用。
,产生Fe(OH)3,过滤、蒸发、结晶,得到硫酸铜晶体,滤渣作催化剂循环使用。
经查阅资料得知,在溶液中通过调节溶液的酸碱性而使Cu2+,Fe2+ Fe3+分别生成沉淀的pH如下:
请回答下列问题:
①物质甲是_____ (填字母序号)。
a.NH3•H2O b.CuCO3 c.NaOH d.CuO
②该方案中调节PH的范围是______ 。

(1)图中烧瓶内发生的离子反应方程式为:
(2)反应时B瓶内的现象是
(3)为符合绿色化学的要求,某研究性学习小组进行如下设计:
第一组:以空气为氧化剂法
把Fe2(SO4)3作催化剂加入到铜粉与稀硫酸的混合物中,并通入空气或氧气,即发生反应。反应完全后向其中加入物质甲调节
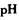 ,产生Fe(OH)3,过滤、蒸发、结晶,得到硫酸铜晶体,滤渣作催化剂循环使用。
,产生Fe(OH)3,过滤、蒸发、结晶,得到硫酸铜晶体,滤渣作催化剂循环使用。经查阅资料得知,在溶液中通过调节溶液的酸碱性而使Cu2+,Fe2+ Fe3+分别生成沉淀的pH如下:
物质 | 开始沉淀时的PH | 完全沉淀时的PH |
Fe(OH)3 | 1.9 | 3.2 |
Cu(OH)2 | 4.7 | 6.7 |
Fe(OH)2 | 6.3 | 9.7 |
①物质甲是
a.NH3•H2O b.CuCO3 c.NaOH d.CuO
②该方案中调节PH的范围是
您最近一年使用:0次
解答题-工业流程题
|
适中
(0.65)
名校
解题方法
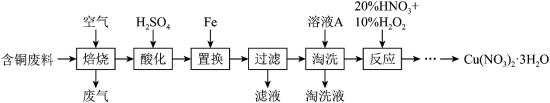
【推荐2】硝酸铜是一种重要的化工原料,可由工业含铜废料制备,含铜废料的主要成分为Cu、CuS、CuSO4等,制备流程如图所示:
(1)“焙烧”时,CuS与空气中的O2反应生成CuO和SO2,该反应的化学方程式为_______ ,提高“焙烧”效率的方法为_______ 。(任写一种)
(2)“过滤”所得滤液中溶质的主要成分为_______ 。
(3)①“淘洗”所用时溶液A可以是_______ 。(填标号)。
a.稀硝酸 b.浓硝酸 c.稀硫酸 d.㳖硫酸
②如何证明“淘洗”已完全_______ 。
(4)“反应”阶段所用的试剂是20%的HNO3溶液和10%的H2O2溶液,反应过程中无红棕色气体生成。
①理论上反应所消耗的H2O2和HNO3的物质的量之比为_______ 。
②若不加10%的H2O2溶液,只用20%的HNO3溶液,随着反应的进行,温度上升并出现大量红棕色气体,反应的离子方程式为_______ 。
(5)某工厂用m1kg上述工业含铜废料(含铜元素80%)制备Cu(NO3)2•3H2O,最终得到产品m2kg,产率为_______ 。(分数化为最简)
(1)“焙烧”时,CuS与空气中的O2反应生成CuO和SO2,该反应的化学方程式为
(2)“过滤”所得滤液中溶质的主要成分为
(3)①“淘洗”所用时溶液A可以是
a.稀硝酸 b.浓硝酸 c.稀硫酸 d.㳖硫酸
②如何证明“淘洗”已完全
(4)“反应”阶段所用的试剂是20%的HNO3溶液和10%的H2O2溶液,反应过程中无红棕色气体生成。
①理论上反应所消耗的H2O2和HNO3的物质的量之比为
②若不加10%的H2O2溶液,只用20%的HNO3溶液,随着反应的进行,温度上升并出现大量红棕色气体,反应的离子方程式为
(5)某工厂用m1kg上述工业含铜废料(含铜元素80%)制备Cu(NO3)2•3H2O,最终得到产品m2kg,产率为
您最近一年使用:0次
【推荐3】Ⅰ.绿色粉末状固体化合物X由三种元素组成,取50.4gX,用蒸馏水完全溶解得绿色溶液A,将溶液A分成A1和A2两等份,完成如下实验:
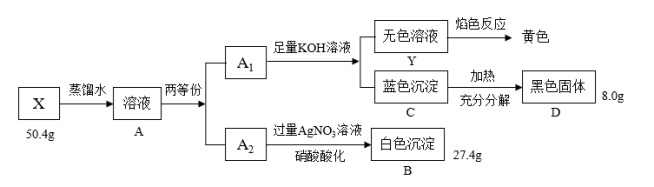
请回答
(1)X的化学式是____ 。
(2)沉淀C分解生成固体D的过程若温度过高可能得到砖红色固体,请写出由D固体生成砖红色固体的化学方程式:____ 。
(3)蓝色沉淀中加入足量浓NaOH会生成一种绛蓝色溶液,原因是生成了一种和X类似的物质,请写出该反应的离子方程式____ 。
Ⅱ.为检验三草酸合铁酸钾K3[Fe(C2O4)3]·3H2O的热分解产物,按如图所示装置进行实验:

请回答
(1)该套实验装置的明显缺陷是____ 。
(2)实验过程中观察到B中白色无水硫酸铜变成蓝色,C、F中澄清石灰水变浑浊,E中____ (填实验现象),则可证明三草酸合铁酸钾热分解的气体产物是H2O、CO、CO2。
(3)样品完全分解后,装置A中的残留物含有FeO和Fe2O3,检验FeO存在的方法是:____ 。

请回答
(1)X的化学式是
(2)沉淀C分解生成固体D的过程若温度过高可能得到砖红色固体,请写出由D固体生成砖红色固体的化学方程式:
(3)蓝色沉淀中加入足量浓NaOH会生成一种绛蓝色溶液,原因是生成了一种和X类似的物质,请写出该反应的离子方程式
Ⅱ.为检验三草酸合铁酸钾K3[Fe(C2O4)3]·3H2O的热分解产物,按如图所示装置进行实验:

请回答
(1)该套实验装置的明显缺陷是
(2)实验过程中观察到B中白色无水硫酸铜变成蓝色,C、F中澄清石灰水变浑浊,E中
(3)样品完全分解后,装置A中的残留物含有FeO和Fe2O3,检验FeO存在的方法是:
您最近一年使用:0次
解答题-实验探究题
|
适中
(0.65)
【推荐1】实验室由安息香制备二苯乙二酮的反应如下:
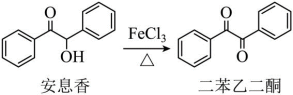
相关信息列表如下:
装置示意图如下图所示,实验步骤为:
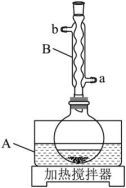
①在圆底烧瓶中加入10mL冰乙酸、5mL水及 ,边搅拌边加热,至固体全部溶解。
,边搅拌边加热,至固体全部溶解。
②停止加热,待沸腾平息后加入2.0g安息香,加热回流45~60min。
③加入50mL水,煮沸后冷却,有黄色固体析出。
④过滤,并用冷水洗涤固体3次,得到粗品。
⑤粗品用75%的乙醇重结晶,干燥后得淡黄色结晶1.6g。
回答下列问题:
(1)仪器A中应加入_______ (填“水”或“油”)作为热传导介质。
(2)仪器B的名称是_______ ;冷却水应从_______ (填“a”或“b”)口通入。
(3)实验步骤②中,安息香必须待沸腾平息后方可加入,其主要目的是_______ 。
(4)在本实验中, 为氧化剂且过量,写出安息香制备二苯乙二酮的化学方程式
为氧化剂且过量,写出安息香制备二苯乙二酮的化学方程式_______ ;某同学改进本实验:用少量 并通入空气制备二苯乙二酮。简述该方案中氯化铁为何只需少量的
并通入空气制备二苯乙二酮。简述该方案中氯化铁为何只需少量的 参与反应。
参与反应。_______ 。
(5)本实验步骤①~③在乙酸体系中进行,乙酸除作溶剂外,另一主要作用是_______ 。
(6)若粗品中混有少量未氧化的安息香,可用少量_______ 洗涤的方法除去(填标号)。若要得到更高纯度的产品,可用重结晶的方法进一步提纯。
a.热水 b.乙酸 c.冷水 d.乙醇
(7)本实验的产率最接近于_______ (填标号)。
a.85% b.80% c.75% d.70%

相关信息列表如下:
| 物质 | 性状 | 熔点/℃ | 沸点/℃ | 溶解性 |
| 安息香 | 白色固体 | 133 | 344 | 难溶于冷水 溶于热水、乙醇、乙酸 |
| 二苯乙二酮 | 淡黄色固体 | 95 | 347 | 不溶于水 溶于乙醇、苯、乙酸 |
| 冰乙酸 | 无色液体 | 17 | 118 | 与水、乙醇互溶 |

①在圆底烧瓶中加入10mL冰乙酸、5mL水及
 ,边搅拌边加热,至固体全部溶解。
,边搅拌边加热,至固体全部溶解。②停止加热,待沸腾平息后加入2.0g安息香,加热回流45~60min。
③加入50mL水,煮沸后冷却,有黄色固体析出。
④过滤,并用冷水洗涤固体3次,得到粗品。
⑤粗品用75%的乙醇重结晶,干燥后得淡黄色结晶1.6g。
回答下列问题:
(1)仪器A中应加入
(2)仪器B的名称是
(3)实验步骤②中,安息香必须待沸腾平息后方可加入,其主要目的是
(4)在本实验中,
 为氧化剂且过量,写出安息香制备二苯乙二酮的化学方程式
为氧化剂且过量,写出安息香制备二苯乙二酮的化学方程式 并通入空气制备二苯乙二酮。简述该方案中氯化铁为何只需少量的
并通入空气制备二苯乙二酮。简述该方案中氯化铁为何只需少量的 参与反应。
参与反应。(5)本实验步骤①~③在乙酸体系中进行,乙酸除作溶剂外,另一主要作用是
(6)若粗品中混有少量未氧化的安息香,可用少量
a.热水 b.乙酸 c.冷水 d.乙醇
(7)本实验的产率最接近于
a.85% b.80% c.75% d.70%
您最近一年使用:0次
解答题-工业流程题
|
适中
(0.65)
解题方法
【推荐2】K2SO4是无氯优质钾肥,MnSO4·H2O在工业、农业等方面有广泛的应用。以硫酸工业的尾气联合制备K2SO4和MnSO4·H2O的工艺流程如下:

(1)检验K2SO4样品是否含有氯化物杂质的实验操作是_______ 。
(2)已知软锰矿浆主要成分是MnO2,反应IV的化学方程式为_______ 。
(3)已知室温下Mn(OH)2的Ksp=4.5×10-13,向MnSO4溶液中滴加氨水使溶液的pH=10,此时溶液中残留的Mn2+的浓度为_______ mol·L-1。
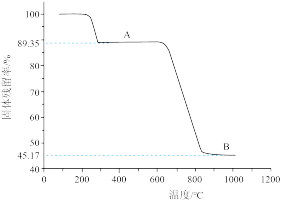
(4)取一定量MnSO4·H2O样品在空气中加热,样品的固体残留率(固体样品的剩余质量/固体样品的起始质量×100%)随温度的变化如下图所示(样品在300℃时已完全失去结晶水,900℃以上残留固体为金属氧化物)。试通过计算确定曲线中B段所表示物质的化学式(写出计算过程)。_____

(1)检验K2SO4样品是否含有氯化物杂质的实验操作是
(2)已知软锰矿浆主要成分是MnO2,反应IV的化学方程式为
(3)已知室温下Mn(OH)2的Ksp=4.5×10-13,向MnSO4溶液中滴加氨水使溶液的pH=10,此时溶液中残留的Mn2+的浓度为
(4)取一定量MnSO4·H2O样品在空气中加热,样品的固体残留率(固体样品的剩余质量/固体样品的起始质量×100%)随温度的变化如下图所示(样品在300℃时已完全失去结晶水,900℃以上残留固体为金属氧化物)。试通过计算确定曲线中B段所表示物质的化学式(写出计算过程)。

您最近一年使用:0次
解答题-实验探究题
|
适中
(0.65)
解题方法
【推荐3】回答下列问题:
(1)海水制得的粗盐中常常含有泥沙、Ca2+ 、Mg2+ 、SO 等杂质,粗盐提纯的步骤有:①加入过量的 Na2CO3溶液;②加入过量的 NaOH 溶液;③加入过量的 BaCl2溶液;④用适量盐酸调节溶液至中性;⑤溶解;⑥过滤;⑦蒸发。正确的操作顺序是
等杂质,粗盐提纯的步骤有:①加入过量的 Na2CO3溶液;②加入过量的 NaOH 溶液;③加入过量的 BaCl2溶液;④用适量盐酸调节溶液至中性;⑤溶解;⑥过滤;⑦蒸发。正确的操作顺序是___________ 。(填选项字母)。
a.⑤⑥③②①⑥④⑦ b.⑤⑥①③②⑥④⑦ c.⑤⑥③①②④⑥⑦ d.⑤⑥②③①⑥④⑦
(2)粗盐提纯实验中用到的盐酸的物质的量浓度为 0.500mol L-1,现实验室某浓盐酸试剂瓶上的有关数据如下:欲用上述浓盐酸配制实验所需浓度的稀盐酸 480mL。
L-1,现实验室某浓盐酸试剂瓶上的有关数据如下:欲用上述浓盐酸配制实验所需浓度的稀盐酸 480mL。
①需量取的浓盐酸的体积为:___________ mL。
②下列操作的正确顺序是___________ (用字母表示)。
B→___________ → ___________→ ___________→ ___________→G
A.上下颠倒摇匀;B.量取;C.洗涤;D.定容;E.稀释;F.移液;G.装瓶
③下列操作会使所配溶液浓度偏低的是___________ 。(填标号)
a.配制前,容量瓶中有少量蒸馏水
b.量取盐酸读数时,仰视刻度线
c.量取盐酸后,洗涤量筒倒入烧杯中
d.定容时水不慎超过了刻度线,用滴管吸出
e.向容量瓶中转移溶液时,不慎有液滴洒在容量瓶外面
(3)配制 500g 0.9%的生理盐水,下列仪器不需要用到的有___________ 。(填仪器名称)
(1)海水制得的粗盐中常常含有泥沙、Ca2+ 、Mg2+ 、SO
 等杂质,粗盐提纯的步骤有:①加入过量的 Na2CO3溶液;②加入过量的 NaOH 溶液;③加入过量的 BaCl2溶液;④用适量盐酸调节溶液至中性;⑤溶解;⑥过滤;⑦蒸发。正确的操作顺序是
等杂质,粗盐提纯的步骤有:①加入过量的 Na2CO3溶液;②加入过量的 NaOH 溶液;③加入过量的 BaCl2溶液;④用适量盐酸调节溶液至中性;⑤溶解;⑥过滤;⑦蒸发。正确的操作顺序是a.⑤⑥③②①⑥④⑦ b.⑤⑥①③②⑥④⑦ c.⑤⑥③①②④⑥⑦ d.⑤⑥②③①⑥④⑦
(2)粗盐提纯实验中用到的盐酸的物质的量浓度为 0.500mol
 L-1,现实验室某浓盐酸试剂瓶上的有关数据如下:欲用上述浓盐酸配制实验所需浓度的稀盐酸 480mL。
L-1,现实验室某浓盐酸试剂瓶上的有关数据如下:欲用上述浓盐酸配制实验所需浓度的稀盐酸 480mL。| 盐酸 分子式:HCl 相对分子质量:36.5 密度:1.19 g/cm3 HCl质量分数/:36.5% |
②下列操作的正确顺序是
B→___________ → ___________→ ___________→ ___________→G
A.上下颠倒摇匀;B.量取;C.洗涤;D.定容;E.稀释;F.移液;G.装瓶
③下列操作会使所配溶液浓度偏低的是
a.配制前,容量瓶中有少量蒸馏水
b.量取盐酸读数时,仰视刻度线
c.量取盐酸后,洗涤量筒倒入烧杯中
d.定容时水不慎超过了刻度线,用滴管吸出
e.向容量瓶中转移溶液时,不慎有液滴洒在容量瓶外面
(3)配制 500g 0.9%的生理盐水,下列仪器不需要用到的有
a.  b.
b.  c.
c.  d.
d. 
您最近一年使用:0次



