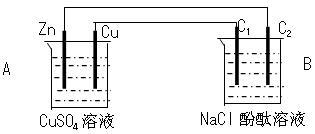
在我们的日常生活中,电化学技术与我们密切相关。根据所学电化学知识,回答下列问题:
(1)事实证明,能设计成原电池的反应通常是放热反应,下列化学反应在理论上可以设计成原电池的是_____________ 。
A.CH4(g)+O2(g)=CO2(g)+H2O(g) △H<0
B.NaOH(aq)+HCl(aq)=NaCl(aq)+H2O(l) △H<0
C.2H2O(l)=2H2(g)+O2(g) △H>0
(2)以熔融KCO3为电解质溶液,依据所选反应设计一个原电池,其负极反应式为______________________________ 。
(3)电解原理在化学工业中有着广泛的应用。现将你设计的原电池通过导线与下图中电解池相连,其中,a为电解液,X和Y是两块电极板,则:
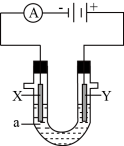
①若X和Y均为惰性电极,a为MgCl2溶液,则电解时的化学反应方程式为______________________________ 。
②若X和Y为惰性电极,a为CuSO4溶液,通电一段时间后,向所得溶液中加入0.2mol Cu(OH)2粉末,恰好恢复电解前的浓度和pH,则电解过程中转移的电子的物质的量为_________________ 。
③若X、Y分别为铁和铜,a为H2SO4溶液,则电解池的总反应式为___________________________ 。
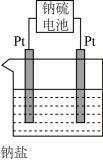
(4)现有有一种新型的高能电池——钠硫电池(熔融的钠、硫为两极,以Na+导电的β-Al2O3陶瓷作固体电解质),反应式为:2Na+xS Na2Sx,上述电解都是用该电池作电源(如图)该电池的正极反应为
Na2Sx,上述电解都是用该电池作电源(如图)该电池的正极反应为______________________ 。
(1)事实证明,能设计成原电池的反应通常是放热反应,下列化学反应在理论上可以设计成原电池的是
A.CH4(g)+O2(g)=CO2(g)+H2O(g) △H<0
B.NaOH(aq)+HCl(aq)=NaCl(aq)+H2O(l) △H<0
C.2H2O(l)=2H2(g)+O2(g) △H>0
(2)以熔融KCO3为电解质溶液,依据所选反应设计一个原电池,其负极反应式为
(3)电解原理在化学工业中有着广泛的应用。现将你设计的原电池通过导线与下图中电解池相连,其中,a为电解液,X和Y是两块电极板,则:

①若X和Y均为惰性电极,a为MgCl2溶液,则电解时的化学反应方程式为
②若X和Y为惰性电极,a为CuSO4溶液,通电一段时间后,向所得溶液中加入0.2mol Cu(OH)2粉末,恰好恢复电解前的浓度和pH,则电解过程中转移的电子的物质的量为
③若X、Y分别为铁和铜,a为H2SO4溶液,则电解池的总反应式为

(4)现有有一种新型的高能电池——钠硫电池(熔融的钠、硫为两极,以Na+导电的β-Al2O3陶瓷作固体电解质),反应式为:2Na+xS
 Na2Sx,上述电解都是用该电池作电源(如图)该电池的正极反应为
Na2Sx,上述电解都是用该电池作电源(如图)该电池的正极反应为
更新时间:2020-03-04 17:05:36
|
相似题推荐
填空题
|
适中
(0.65)
解题方法
【推荐1】如图为原电池装置示意图:
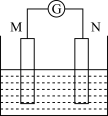
(1)若M为铜片,N为碳棒,电解质溶液为FeCl3溶液,则铜片为_______ 极(填“正”或“负”),写出正极反应式________ 。
(2)若M为Pb,N为PbO2,电解质为H2SO4溶液,工作时的总反应式为Pb+PbO2+2H2SO4=2PbSO4+2H2O。写出M电极反应式:_______ ;该电池工作时,M电极的质量将_____ (填“增加”、“减小”或“不变”)。若该电池反应消耗了0.2 mol H2SO4,则转移电子的数目为________ 。
(3)若M、N均为铂片,电解质为KOH溶液,分别从M.、N两极通入CH4和O2,该电池为甲烷燃料电池,写出M电极反应式:_________ 。该电池工作一段时间后,溶液的碱性将______ (填“增强”、“减弱”或“不变”)。

(1)若M为铜片,N为碳棒,电解质溶液为FeCl3溶液,则铜片为
(2)若M为Pb,N为PbO2,电解质为H2SO4溶液,工作时的总反应式为Pb+PbO2+2H2SO4=2PbSO4+2H2O。写出M电极反应式:
(3)若M、N均为铂片,电解质为KOH溶液,分别从M.、N两极通入CH4和O2,该电池为甲烷燃料电池,写出M电极反应式:
您最近一年使用:0次
填空题
|
适中
(0.65)
名校
解题方法
【推荐2】按要求回答下列问题
(1)如图所示原电池正极的反应式为_______ 。
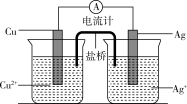
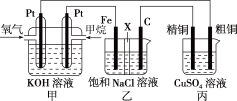
(2)某同学设计一个燃料电池(如图所示),目的是探究氯碱工业原理和粗铜的精炼原理,其中乙装置中 为阳离子交换膜。
为阳离子交换膜。
根据要求回答相关问题:
①甲池中,通入甲烷的电极为_______ (填“正极”或负极),负极的电极反应式为_______ 。
②乙池中,石墨电极为_______ (填“阳极”或“阴极”),反应一段时间后,在乙装置中滴入酚酞溶液,_______ (填“铁极”或“石墨极”)区的溶液先变红。
③如果粗铜中含有锌、银等杂质,丙池中反应一段时间,硫酸铜溶液浓度将_______ (填“增大”“减小”或“不变”)。乙池的总反应方程式为_______ 。
(3)氨可用作碱性燃料电池的燃料,电池反应为 ,则氨燃料电池的负极电极反应为
,则氨燃料电池的负极电极反应为 _______ 。
(1)如图所示原电池正极的反应式为

(2)某同学设计一个燃料电池(如图所示),目的是探究氯碱工业原理和粗铜的精炼原理,其中乙装置中
 为阳离子交换膜。
为阳离子交换膜。
根据要求回答相关问题:
①甲池中,通入甲烷的电极为
②乙池中,石墨电极为
③如果粗铜中含有锌、银等杂质,丙池中反应一段时间,硫酸铜溶液浓度将
(3)氨可用作碱性燃料电池的燃料,电池反应为
 ,则氨燃料电池的负极电极反应为
,则氨燃料电池的负极电极反应为
您最近一年使用:0次
填空题
|
适中
(0.65)
解题方法
【推荐3】人们应用原电池原理制作了多种电池以满足不同的需要。在现代生活、生产和科学技术发展中,电池发挥着越来越重要的作用,如在宇宙飞船、人造卫星、空间电视转播站、飞机、轮船、电脑、收音机、照相机、电子手表、心脏起搏器等,都离不开各式各样的电池,同时废弃的电池随便丢弃也会对环境造成污染。请根据题中提供的信息,回答下列问题:
(1)FeCl3溶液常用于腐蚀印刷电路铜板,发生2FeCl3+Cu=2FeCl2+CuCl2,若将此反应设计成原电池,则负极所用电极材料为____ ,当线路中转移0.1mol电子时,则被腐蚀铜的质量为____ g。
(2)蓄电池在放电时起原电池作用,在充电时起电解池的作用。铅蓄电池在放电时发生的电池反应式为:Pb+PbO2+2H2SO4=2PbSO4+2H2O。则正极电极反应式为____ 。
(3)如图为甲烷氧气燃料电池的构造示意图,电解质溶液的溶质是KOH。则X极为电池的____ (填“正”或“负”)极,X极的电极反应方程式为 ____ 。
(1)FeCl3溶液常用于腐蚀印刷电路铜板,发生2FeCl3+Cu=2FeCl2+CuCl2,若将此反应设计成原电池,则负极所用电极材料为
(2)蓄电池在放电时起原电池作用,在充电时起电解池的作用。铅蓄电池在放电时发生的电池反应式为:Pb+PbO2+2H2SO4=2PbSO4+2H2O。则正极电极反应式为
(3)如图为甲烷氧气燃料电池的构造示意图,电解质溶液的溶质是KOH。则X极为电池的

您最近一年使用:0次
填空题
|
适中
(0.65)
名校
解题方法
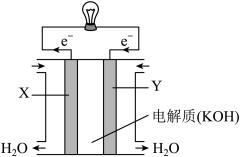
【推荐1】铁和铁的化合物在生活、生产、国防建设中有广泛的应用。请回答下列有关问题:
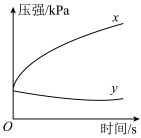
(1)在不同酸性介质中,金属铁的腐蚀原理并不相同,如图是在密闭容器中,生铁在 和
和 的盐酸中容器内压强随时间的变化过程。其负极反应式为
的盐酸中容器内压强随时间的变化过程。其负极反应式为_______ ;代表 的曲线是
的曲线是_______ (填“x”或“y”)。
(2)高铁酸钾( )是一种新型非氯高效消毒剂。用下图所示的装置可以制取
)是一种新型非氯高效消毒剂。用下图所示的装置可以制取 。
。
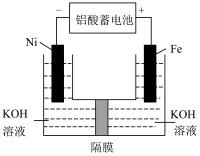
①该化合物中铁元素的化合价为_______ ; 净水时,起絮凝作用的原理是
净水时,起絮凝作用的原理是_______ (结合化学用语和文字说明)。
②铅酸蓄电池的正极反应式为_______ ;该装置中,若外电路转移了 ,理论上消耗
,理论上消耗 物质的量为
物质的量为_______ 。
③隔膜最好是交换膜_______ (填“阳离子”或“阴离子”):电解时阳极附近的
_______ (填“增大”“减小”或“不变”),阳极的电极反应式为_______ 。

(1)在不同酸性介质中,金属铁的腐蚀原理并不相同,如图是在密闭容器中,生铁在
 和
和 的盐酸中容器内压强随时间的变化过程。其负极反应式为
的盐酸中容器内压强随时间的变化过程。其负极反应式为 的曲线是
的曲线是(2)高铁酸钾(
 )是一种新型非氯高效消毒剂。用下图所示的装置可以制取
)是一种新型非氯高效消毒剂。用下图所示的装置可以制取 。
。
①该化合物中铁元素的化合价为
 净水时,起絮凝作用的原理是
净水时,起絮凝作用的原理是②铅酸蓄电池的正极反应式为
 ,理论上消耗
,理论上消耗 物质的量为
物质的量为③隔膜最好是交换膜

您最近一年使用:0次
填空题
|
适中
(0.65)
解题方法
【推荐2】某课外活动小组准备用如图所示的装置进行实验。现有甲、乙、丙三位同学分别选择了如下电极材料和电解质溶液:

(1)甲同学在实验中将电键K5闭合,Zn电极上的电极反应式为________________ ;
(2)乙同学准备进行电解CuCl2溶液的实验,则电解时的总反应方程式为____________________ ;
实验时应闭合的电键组合是________ 。(从下列五项中选择所有可能组合,第三小题也在这五项中选择)
A.K1和K2
B.K1和K3
C.K1和K4
D.K2和K3
E.K2和K4
(3)丙同学准备在Fe上镀Cu,选择了某种盐来配制电镀液,则该盐的化学式为______________ ,实验时,应闭合的电键组合是___________ (选项如上)。

| A电极 | B电极 | X溶液 | |
| 甲 | Cu | Zn | H2SO4 |
| 乙 | Pt | Pt | CuCl2 |
| 丙 | Fe | Cu | ? |
(1)甲同学在实验中将电键K5闭合,Zn电极上的电极反应式为
(2)乙同学准备进行电解CuCl2溶液的实验,则电解时的总反应方程式为
实验时应闭合的电键组合是
A.K1和K2
B.K1和K3
C.K1和K4
D.K2和K3
E.K2和K4
(3)丙同学准备在Fe上镀Cu,选择了某种盐来配制电镀液,则该盐的化学式为
您最近一年使用:0次
填空题
|
适中
(0.65)
名校
解题方法
【推荐1】如图是乙醇燃料电池工作时的示意图,乙池中M、N两个电极的材料是石墨和铁中的一种,工作时M、N两个电极的质量都不减少,请回答:

(1)甲池中通入乙醇的铂电极名称是______ ,通入 的铂电极反应式为
的铂电极反应式为__________________ ;
(2)乙池属于______ (填“原电池”或“电解池”),工作时,乙池中电子流出的电极是______ (填“M”或“N”):
(3)若乙池中某电极析出金属银4.32g时,甲池中理论上消耗氧气为______ L(标准状况下);
(4)如要用电解方法精炼粗铜,乙池电解液选用 溶液,则N电极的材料是
溶液,则N电极的材料是______ ,反应一段时间以后, 溶液的浓度
溶液的浓度______ 。(填“增大”“减小”“不变”)

(1)甲池中通入乙醇的铂电极名称是
 的铂电极反应式为
的铂电极反应式为(2)乙池属于
(3)若乙池中某电极析出金属银4.32g时,甲池中理论上消耗氧气为
(4)如要用电解方法精炼粗铜,乙池电解液选用
 溶液,则N电极的材料是
溶液,则N电极的材料是 溶液的浓度
溶液的浓度
您最近一年使用:0次
填空题
|
适中
(0.65)
解题方法
【推荐2】如图所示,C、D、E、F都是惰性电极,A、B为电源。将电源接通后,向乙中滴入酚酞溶液,在F极附近显红色,D质量增加。
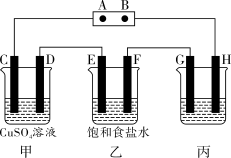
(1)AB作为电源,可以利用多种原电池来提供电能,兴趣小组同学设计如下电源:
①小红同学设计利用反应“Cu+2Fe3+=Cu2++2Fe2+”制成化学电池来提供电能,该电池的负极材料是____ ,电解质溶液是____ 。
②小秦同学设计将铝片和铜片用导线相连,一组插入浓硝酸中,一组插入烧碱溶液中,分别形成了原电池,在这两个原电池中,负极分别为___ (填字母)。
A.铝片、铜片 B.铜片、铝片 C.铝片、铝片 D.铜片、铜片
③小明同学利用CO、氧气燃料电池作电源,电解质为KOH溶液,A电极上的反应式为___ ,工作一段时间后溶液的pH___ (填“增大”“减小”或“不变”)。
(2)若甲中装有足量的硫酸铜溶液,工作一段时间后,停止通电,欲使溶液恢复到起始状态,可向溶液中加入____ (填字母)。
A.Cu B.Cu2(OH)2CO3 C.Cu(OH)2 D.CuCO3
(3)通电后乙中发生的总反应方程式为____ 。
(4)欲用丙装置给铜镀银,则金属银应为___ (填“G”或“H”)极,反应一段时间后(用CO、氧气燃料电池作电源)铜制品质量增加43.2g,理论上消耗氧气的质量为____ g。

(1)AB作为电源,可以利用多种原电池来提供电能,兴趣小组同学设计如下电源:
①小红同学设计利用反应“Cu+2Fe3+=Cu2++2Fe2+”制成化学电池来提供电能,该电池的负极材料是
②小秦同学设计将铝片和铜片用导线相连,一组插入浓硝酸中,一组插入烧碱溶液中,分别形成了原电池,在这两个原电池中,负极分别为
A.铝片、铜片 B.铜片、铝片 C.铝片、铝片 D.铜片、铜片
③小明同学利用CO、氧气燃料电池作电源,电解质为KOH溶液,A电极上的反应式为
(2)若甲中装有足量的硫酸铜溶液,工作一段时间后,停止通电,欲使溶液恢复到起始状态,可向溶液中加入
A.Cu B.Cu2(OH)2CO3 C.Cu(OH)2 D.CuCO3
(3)通电后乙中发生的总反应方程式为
(4)欲用丙装置给铜镀银,则金属银应为
您最近一年使用:0次
填空题
|
适中
(0.65)
【推荐3】铅蓄电池是重要的二次电池。已知:铅蓄电池总的化学方程式为: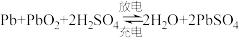 ,回答下列问题:
,回答下列问题:
(1)铅蓄电池负极材料是________ ,充电时,PbSO4在_________ (填“阳极”、“阴极”或“两个电极”)上_________ (填“生成或除去”)。
(2)铅蓄电池在充电时阳极接电源的_______ (正极/负极),放电时负极的电极反应式为__________ 。
(3)用铅蓄电池作为电源,电解饱和食盐水,电极均为惰性电极,电解饱和食盐水总反应的化学方程式为________ 。当铅蓄电池负极生成2molPbSO4时,_______ (阴极/阳极)产生_______ molH2.。
(4)电解饱和食盐水工业生产中,采用了_____ (阴/阳)离子交换膜,该交换膜的作用是_____ 。
A、避免氯气和氢氧化钠作用生成次氯酸而影响烧碱的质量
B、防止氯气和氢气混合引起爆炸
C、让氯离子从该电极通过
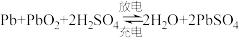 ,回答下列问题:
,回答下列问题:(1)铅蓄电池负极材料是
(2)铅蓄电池在充电时阳极接电源的
(3)用铅蓄电池作为电源,电解饱和食盐水,电极均为惰性电极,电解饱和食盐水总反应的化学方程式为
(4)电解饱和食盐水工业生产中,采用了
A、避免氯气和氢氧化钠作用生成次氯酸而影响烧碱的质量
B、防止氯气和氢气混合引起爆炸
C、让氯离子从该电极通过
您最近一年使用:0次
填空题
|
适中
(0.65)
名校
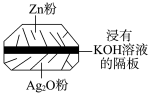
【推荐1】(1)微型纽扣电池在现代生活中有广泛应用.有一种银锌电池,其电极分别是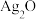 和
和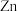 ,电解质溶液为
,电解质溶液为 溶液,电极反应为:
溶液,电极反应为: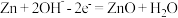 ,
,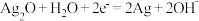 。根据上述反应式,完成下列题目。
。根据上述反应式,完成下列题目。
①下列叙述正确的是_______ 。
 .在使用过程中,K+流向Zn极
.在使用过程中,K+流向Zn极
 .使用过程中,电子由
.使用过程中,电子由 极经外电路流向
极经外电路流向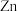 极
极
 .
.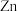 是负极,
是负极,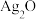 是正极
是正极
 .
.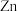 电极发生还原反应,
电极发生还原反应,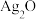 电极发生氧化反应
电极发生氧化反应
②写出电池的总反应式:________________________________________________________________ 。
③使用时,电解质溶液的
________ 。
(2)铅蓄电池是典型的可充型电池,电池总反应式为:Pb+PbO2+4H++2SO42-⇌2PbSO4+2H2O,请回答下列问题:①放电时,正极的电极反应式是_____________________________________________________________________ ;
②电解液中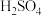 的浓度将变
的浓度将变_______ ;
③当外电路通过 电子时,理论上负极板的质量增加
电子时,理论上负极板的质量增加_______  。
。
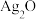 和
和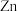 ,电解质溶液为
,电解质溶液为 溶液,电极反应为:
溶液,电极反应为: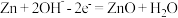 ,
,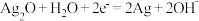 。根据上述反应式,完成下列题目。
。根据上述反应式,完成下列题目。
①下列叙述正确的是
 .在使用过程中,K+流向Zn极
.在使用过程中,K+流向Zn极 .使用过程中,电子由
.使用过程中,电子由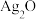 极经外电路流向
极经外电路流向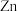 极
极 .
.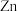 是负极,
是负极,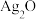 是正极
是正极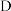 .
.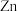 电极发生还原反应,
电极发生还原反应,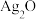 电极发生氧化反应
电极发生氧化反应②写出电池的总反应式:
③使用时,电解质溶液的

(2)铅蓄电池是典型的可充型电池,电池总反应式为:Pb+PbO2+4H++2SO42-⇌2PbSO4+2H2O,请回答下列问题:①放电时,正极的电极反应式是
②电解液中
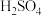 的浓度将变
的浓度将变③当外电路通过
 电子时,理论上负极板的质量增加
电子时,理论上负极板的质量增加 。
。
您最近一年使用:0次
填空题
|
适中
(0.65)
解题方法
【推荐2】化学电源在生产生活中有着广泛的应用,请回答下列问题:
(1)根据构成原电池的本质判断,下列化学(或离子)方程式正确且能设计成原电池的是___________(填字母,下同)。
(2)为了探究化学反应中的能量变化,某兴趣小组设计了如下两个实验(如图所示)。试回答下列问题:
①有关反应一段时间后的实验现象,下列说法正确的是___________ 。
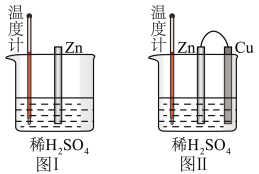
A.图I中温度计的示数高于图II的示数
B.图I中锌片是负极,图II中铜片是正极
C.图I和图II的气泡均产生于锌棒表面
D.图II中产生气体的速率比I慢
E.图I和图II中溶液酸性均增强
F.图II的外电路中电流方向Zn→Cu。
②在图II实验中,兴趣小组观察到的实验现象是___________ ,写出图II实验中铜上电极反应式___________ 。
③在图II实验中,如果把硫酸换成硫酸铜溶液,请写出电池总反应的离子方程式:___________ ;当电路中转移0.25mol电子时,消耗负极材料的质量为___________ g[M(Zn)=65g/mol]。
(3)根据原电池原理可以制造化学电池。如:电动汽车上用的铅蓄电池是由一组海绵状铅板和另一组结构相似的充满二氧化铅的铅板做为两电极,用H2SO4作电解质溶液构成。放电时,电池总反应为Pb+PbO2+2H2SO4=2PbSO4+2H2O。试写出放电时正极的电极反应式:___________ 。
(4)燃料电池的工作原理是将燃料和氧化剂(如O2)反应所放出的化学能直接转化为电能。现设计一燃料电池,以C为电极,CH3OH为燃料,采用氢氧化钠溶液为电解液,电池工作时消耗1molCH3OH,则电路中通过___________ mol电子。
(1)根据构成原电池的本质判断,下列化学(或离子)方程式正确且能设计成原电池的是___________(填字母,下同)。
| A.KOH+HCl=KCl+H2O | B.Cu+Fe3+=Fe2++Cu2+ |
| C.Na2O+H2O=2NaOH | D.Fe+H2SO4=FeSO4+H2↑ |
(2)为了探究化学反应中的能量变化,某兴趣小组设计了如下两个实验(如图所示)。试回答下列问题:
①有关反应一段时间后的实验现象,下列说法正确的是

A.图I中温度计的示数高于图II的示数
B.图I中锌片是负极,图II中铜片是正极
C.图I和图II的气泡均产生于锌棒表面
D.图II中产生气体的速率比I慢
E.图I和图II中溶液酸性均增强
F.图II的外电路中电流方向Zn→Cu。
②在图II实验中,兴趣小组观察到的实验现象是
③在图II实验中,如果把硫酸换成硫酸铜溶液,请写出电池总反应的离子方程式:
(3)根据原电池原理可以制造化学电池。如:电动汽车上用的铅蓄电池是由一组海绵状铅板和另一组结构相似的充满二氧化铅的铅板做为两电极,用H2SO4作电解质溶液构成。放电时,电池总反应为Pb+PbO2+2H2SO4=2PbSO4+2H2O。试写出放电时正极的电极反应式:
(4)燃料电池的工作原理是将燃料和氧化剂(如O2)反应所放出的化学能直接转化为电能。现设计一燃料电池,以C为电极,CH3OH为燃料,采用氢氧化钠溶液为电解液,电池工作时消耗1molCH3OH,则电路中通过
您最近一年使用:0次
填空题
|
适中
(0.65)
解题方法
【推荐3】能源、资源问题是当前人类社会面临的一项重大课题。直接利用物质燃烧提供热能在当今社会仍然占很大比重,但存在利用率低的问题。燃料电池将能量转化效率比直接燃烧效率高,H2、CH4、CH3OH都是重要的能源物质。
(1)其中氢氧燃料电池是常见的燃料电池,如图为氢氧燃料电池的工作原理示意图,a、b均为惰性电极。
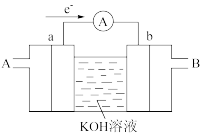
①使用时,空气从_____ 口通入(填“A”或“B”);负极是_____ (填“a”或“b”)。电流由_____ 流向_____ (填“a”或“b”)。其总反应方程式为_____ ,在碱性条件下,负极反应式为_____ 。
②假设使用的“燃料”是甲烷(酸性条件下),a极的电极反应为:_____ 。
(2)某同学设计如图的原电池,负极实验现象为_____ ,则正极的电极反应式为:_____ ,当导线中有3.01×1023个电子流过,溶液质量变化为_____ g。

(3)能把硫酸铜溶液改成氢氧化钠溶液吗_____ (填“能”或“不能”),为什么_____ 。
(1)其中氢氧燃料电池是常见的燃料电池,如图为氢氧燃料电池的工作原理示意图,a、b均为惰性电极。

①使用时,空气从
②假设使用的“燃料”是甲烷(酸性条件下),a极的电极反应为:
(2)某同学设计如图的原电池,负极实验现象为

(3)能把硫酸铜溶液改成氢氧化钠溶液吗
您最近一年使用:0次