已知25℃时溶解度:AgCl> AgI,若在5 mL含有KCl和KI各为0.01mol/L的溶液中,加入8 mL 0.01 mol/L AgNO3溶液,这时溶液中所含溶质的离子浓度大小关系正确的是
| A.c(K+)>c(NO3-)>c(Ag+)=c(Cl-)+c(I-) | B.c(K+)>c(NO3-)>c(Ag+)>c(Cl-)>c(I-) |
| C.c(NO3-)>c(K+)>c(Ag+)>c(Cl-)>c(I-) | D.c(K+)>c(NO3-)>c(Cl-)>c(Ag+)>c(I-) |
更新时间:2020-03-23 16:00:21
|
相似题推荐
单选题
|
适中
(0.65)
【推荐1】下列说法正确的是
| A.在一定温度下的饱和AgCl水溶液中,Ag+与Cl-的浓度乘积是一个常数 |
| B.已知AgCl的Ksp=1.8×10-10,则在任何含AgCl固体的溶液中,c(Ag+)=c(Cl-),且Ag+与Cl-浓度的乘积等于1.8×10-10mol2·L-2 |
| C.Ksp数值越大的难溶电解质在水中的溶解能力越强 |
| D.难溶电解质的溶解度很小,故外界条件改变,对它的溶解度没有影响 |
您最近一年使用:0次
单选题
|
适中
(0.65)
名校
解题方法
【推荐2】Mg(OH) 2在水中存在溶解平衡:Mg(OH)2(s) Mg2+(aq)+2OH-(aq),下列能使Mg(OH)2(s)减少的是
Mg2+(aq)+2OH-(aq),下列能使Mg(OH)2(s)减少的是
 Mg2+(aq)+2OH-(aq),下列能使Mg(OH)2(s)减少的是
Mg2+(aq)+2OH-(aq),下列能使Mg(OH)2(s)减少的是| A.加入MgCl2溶液 | B.加入少量NaOH固体 |
| C.加入NH4NO3溶液 | D.加入CH3COOK固体 |
您最近一年使用:0次
单选题
|
适中
(0.65)
【推荐1】25℃时,三种难溶银盐的Ksp与颜色如下表,下列说法正确的是( )
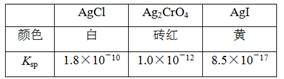

| A.AgCl、Ag2CrO4、AgI饱和溶液中c(Ag+)依次减小 |
| B.Ag2CrO4饱和溶液中c(Ag+)约为1.0×10-6mol·L-1 |
| C.向AgCl悬浊液中加入足量KI溶液,沉淀将由白色转化为黄色 |
| D.向等浓度的KCl与K2CrO4的混合溶液中滴加少量AgNO3溶液,将生成砖红色沉淀 |
您最近一年使用:0次
单选题
|
适中
(0.65)
名校
【推荐2】某温度下,向体积均为20.00mL、浓度均为0.1mol•L-1的NaCl溶液、Na2CrO4溶液中分别滴加0.1mol•L-1的AgNO3溶液,滴定过程中的pX(PX=-lgX,X=Cl-、CrO )与滴加AgNO3溶液体积的关系如图所示。(已知:lg3=0.47)下列说法错误的是
)与滴加AgNO3溶液体积的关系如图所示。(已知:lg3=0.47)下列说法错误的是
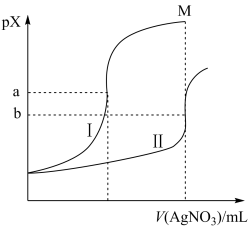
 )与滴加AgNO3溶液体积的关系如图所示。(已知:lg3=0.47)下列说法错误的是
)与滴加AgNO3溶液体积的关系如图所示。(已知:lg3=0.47)下列说法错误的是
| A.曲线Ⅰ表示AgNO3溶液滴定NaCl溶液的过程 |
| B.Ksp(Ag2CrO4)=4.0×10-3b |
| C.其他条件不变,如果NaCl溶液浓度改为0.05mol•L-1,则滴定终点向上移动 |
| D.M点的纵坐标约为2a-1.47 |
您最近一年使用:0次

 +H2O=Cl-+HCO
+H2O=Cl-+HCO +HClO
+HClO

