某学生探究小组将一批废弃的电子线路板简单处理后,得到含71%Cu、20%Al、5%Fe及少量Au、Pt等金属的混合物,并设计出如下制备硫酸铜晶体的路线:
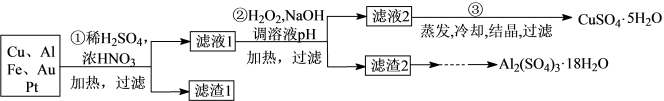
已知:Cu+4HNO3(浓)=Cu(NO3)2+2H2O+2NO2↑
回答下列问题:
(1)滤渣1的主要成分为___ 。
(2)第②步加入H2O2目的是将Fe2+氧化成Fe3+,其离子方程式为___ ;使用H2O2作为氧化剂的优点是___ 。
(3)用第③步所得CuSO4·5H2O晶体加热制备无水CuSO4的瓷质主要仪器___ 。
(4)由滤渣2制取Al2(SO4)3·18H2O,探究小组设计了三种方案:
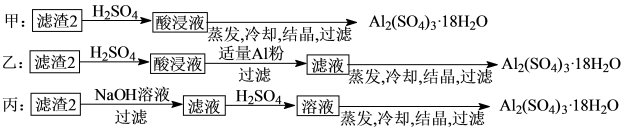
上述三种方案中,可行方案是___ ,其中不可行方案的原因是___ 。

已知:Cu+4HNO3(浓)=Cu(NO3)2+2H2O+2NO2↑
回答下列问题:
(1)滤渣1的主要成分为
(2)第②步加入H2O2目的是将Fe2+氧化成Fe3+,其离子方程式为
(3)用第③步所得CuSO4·5H2O晶体加热制备无水CuSO4的瓷质主要仪器
(4)由滤渣2制取Al2(SO4)3·18H2O,探究小组设计了三种方案:
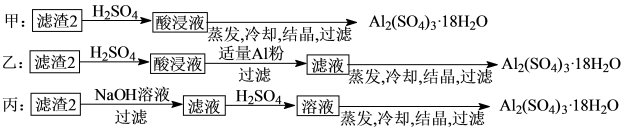
上述三种方案中,可行方案是
更新时间:2020-04-02 21:51:11
|
相似题推荐
解答题-原理综合题
|
适中
(0.65)
名校
【推荐1】建筑工地常用的NaNO2因外观和食盐相似,又有咸味,容易使人误食中毒,已知NaNO2能发生如下反应:2NaNO2+4HI=2NO↑+I2+2NaI+2H2O。(已知:淀粉遇I2变蓝色)
(1)上述反应的氧化剂是_____ ,氧化产物是____
(2)用双线桥标出上述反应电子转移的方向与数目:______
2NaNO2+4HI=2NO↑+I2+2NaI+2H2O
(3)根据上述反应,可用试纸和生活中常见的物质进行实验,以鉴别NaNO2和NaCl,实验可选用的物质有:
①水 ②淀粉碘化钾试纸 ③淀粉 ④白酒 ⑤食醋,下列合适的组合是_____ (填字母)。
A.③⑤ B.①②④ C.①②⑤ D.①②③⑤
(4)①某厂废切削液中,含有2%~5%的NaNO2,直接排放会造成污染,采用NH4Cl,能使NaNO2转化为不引起二次污染的N2,反应的化学方程式为________
该反应中的还原剂是________ ,氧化产物是_____ ,还原产物是______
②取200.00mL该厂废切削液,加入适量HI溶液,充分反应后,滴加一定浓度的Na2S2O3溶液,恰好完全反应时,消耗0.12mol Na2S2O3,计算所取废切削液中含NaNO2的质量。
(已知: ,写出计算过程,保留两位小数)
,写出计算过程,保留两位小数)
(1)上述反应的氧化剂是
(2)用双线桥标出上述反应电子转移的方向与数目:
2NaNO2+4HI=2NO↑+I2+2NaI+2H2O
(3)根据上述反应,可用试纸和生活中常见的物质进行实验,以鉴别NaNO2和NaCl,实验可选用的物质有:
①水 ②淀粉碘化钾试纸 ③淀粉 ④白酒 ⑤食醋,下列合适的组合是
A.③⑤ B.①②④ C.①②⑤ D.①②③⑤
(4)①某厂废切削液中,含有2%~5%的NaNO2,直接排放会造成污染,采用NH4Cl,能使NaNO2转化为不引起二次污染的N2,反应的化学方程式为
该反应中的还原剂是
②取200.00mL该厂废切削液,加入适量HI溶液,充分反应后,滴加一定浓度的Na2S2O3溶液,恰好完全反应时,消耗0.12mol Na2S2O3,计算所取废切削液中含NaNO2的质量。
(已知:
 ,写出计算过程,保留两位小数)
,写出计算过程,保留两位小数)
您最近一年使用:0次
解答题-实验探究题
|
适中
(0.65)
名校
解题方法
【推荐2】酸雨是大气污染的危害之一,二氧化硫(SO2)的含量是空气质量监测的一个重要指标。某兴趣小组拟用下列装置定量分析空气中SO2的含量:

(1)该组同学查资料得到的反应原理为:SO2与酸性KMnO4溶液反应的离子方程式为5SO2+2MnO4-+2H2O=5SO42-+2Mn2++4H+,SO2在该反应中是___________ (填“氧化剂”或“还原剂”)。
(2)通入空气前应进行的实验操作是___________ 。
(3)该实验中已经知道的数据有气体流速a L/min、酸性KMnO4溶液的体积b L,其浓度为c mol/L。若从气体通入到紫色恰好褪去,用时5分钟。则此次取样处的空气中二氧化硫含量为____________ g/L。(写出计算过程)

(1)该组同学查资料得到的反应原理为:SO2与酸性KMnO4溶液反应的离子方程式为5SO2+2MnO4-+2H2O=5SO42-+2Mn2++4H+,SO2在该反应中是
(2)通入空气前应进行的实验操作是
(3)该实验中已经知道的数据有气体流速a L/min、酸性KMnO4溶液的体积b L,其浓度为c mol/L。若从气体通入到紫色恰好褪去,用时5分钟。则此次取样处的空气中二氧化硫含量为
您最近一年使用:0次
解答题-实验探究题
|
适中
(0.65)
名校
【推荐3】亚氯酸钠 是一种重要的含氯消毒剂,易溶于水,在碱性溶液中比较稳定,遇酸放出
是一种重要的含氯消毒剂,易溶于水,在碱性溶液中比较稳定,遇酸放出 。一种由
。一种由 制备
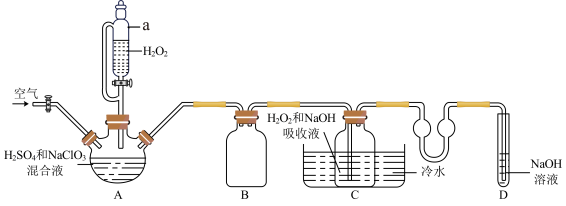
制备 晶体的实验装置如图(夹持装置略去)所示:
晶体的实验装置如图(夹持装置略去)所示:
已知:①饱和 溶液中析出的晶体成分与温度的关系如下表所示:
溶液中析出的晶体成分与温度的关系如下表所示:
② 易溶于水,在温度过高、浓度过大时易发生分解。
易溶于水,在温度过高、浓度过大时易发生分解。
回答下列问题:
(1)装置A为 发生装置,其中发生反应的离子方程式为
发生装置,其中发生反应的离子方程式为_______ 。
(2) 在装置C中生成
在装置C中生成 ,化学反应方程式为
,化学反应方程式为_______ , 的另一个作用是
的另一个作用是_______ ,装置C中冷水的作用是_______ 。
(3)从装置C中获得 晶体的方法是:在
晶体的方法是:在_______ (填“温度范围”)、_______ (填“常压”、“减压”)蒸发结晶、_______ (填“趁热”、“冷却”)过滤,50℃左右热水洗涤,低于60℃条件下烘干,得到 晶体。
晶体。
 是一种重要的含氯消毒剂,易溶于水,在碱性溶液中比较稳定,遇酸放出
是一种重要的含氯消毒剂,易溶于水,在碱性溶液中比较稳定,遇酸放出 。一种由
。一种由 制备
制备 晶体的实验装置如图(夹持装置略去)所示:
晶体的实验装置如图(夹持装置略去)所示:
已知:①饱和
 溶液中析出的晶体成分与温度的关系如下表所示:
溶液中析出的晶体成分与温度的关系如下表所示:| 温度/℃ |  | 38~60 |  |
| 晶体成分 |  |  |  分解成 分解成 和 和 |
 易溶于水,在温度过高、浓度过大时易发生分解。
易溶于水,在温度过高、浓度过大时易发生分解。回答下列问题:
(1)装置A为
 发生装置,其中发生反应的离子方程式为
发生装置,其中发生反应的离子方程式为(2)
 在装置C中生成
在装置C中生成 ,化学反应方程式为
,化学反应方程式为 的另一个作用是
的另一个作用是(3)从装置C中获得
 晶体的方法是:在
晶体的方法是:在 晶体。
晶体。
您最近一年使用:0次
解答题-无机推断题
|
适中
(0.65)
名校
解题方法
【推荐1】几种常见物质之间转化关系如图所示。
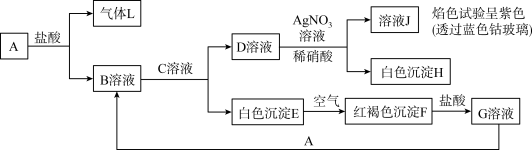
回答下列问题:
(1)C是______________ (填化学式,右同),H是_______________ 。
(2)E→F的化学方程式:_______________ 。
(3)在氢碘酸溶液中加入少量F,写出离子方程式:_______________ 。
(4)在B溶液中加入(NH4)2C2O4溶液,产生固体MC2O4·2H2O(M是A物质对应的元素)。该固体在空气中加热分解,得到分解产物的热重曲线如图所示。

①a点固体的物质的量为_______________ 。
②b→c的化学方程式为_______________ 。

回答下列问题:
(1)C是
(2)E→F的化学方程式:
(3)在氢碘酸溶液中加入少量F,写出离子方程式:
(4)在B溶液中加入(NH4)2C2O4溶液,产生固体MC2O4·2H2O(M是A物质对应的元素)。该固体在空气中加热分解,得到分解产物的热重曲线如图所示。

①a点固体的物质的量为
②b→c的化学方程式为
您最近一年使用:0次
解答题-工业流程题
|
适中
(0.65)
名校
解题方法
【推荐2】铁泥是钢铁厂废弃物,经分析其成分如下表:
已知杂质不溶于酸。
综合利用废弃物,对资源利用和环境保护具有现实意义,铁泥常用于制备铁红,实验室模拟其工艺流程如下:

(1)酸浸过程中Fe3O4与硫酸反应的离子方程式为___________ 。
(2)转化过程中发生反应的离子方程式为___________ 。检验转化是否完全所用的试剂是___________ 。
(3)沉铁后洗涤滤渣2,检验滤渣2是否洗涤干净的方法是:取少量最后一次的洗涤液于试管中,___________ ,则已经洗涤干净。
(4)煆烧步骤的化学反应方程式为___________ 。
| 成分 | Fe3O4 | Fe2O3 | FeO | Fe | 水分 | 杂质 |
| 质量分数% | 74.25 | 7.28 | 3.56 | 3.67 | 8.12 | 3.12 |
综合利用废弃物,对资源利用和环境保护具有现实意义,铁泥常用于制备铁红,实验室模拟其工艺流程如下:

(1)酸浸过程中Fe3O4与硫酸反应的离子方程式为
(2)转化过程中发生反应的离子方程式为
(3)沉铁后洗涤滤渣2,检验滤渣2是否洗涤干净的方法是:取少量最后一次的洗涤液于试管中,
(4)煆烧步骤的化学反应方程式为
您最近一年使用:0次
解答题-工业流程题
|
适中
(0.65)
【推荐3】高效净水剂聚合氯化铝铁(PAFC)的组成可表示为{ ,其中A1、Fe元素均为+3价},该物质广泛应用于日常生活用水和工业废水的处理。回答下列问题:
,其中A1、Fe元素均为+3价},该物质广泛应用于日常生活用水和工业废水的处理。回答下列问题:
(1)为检测PAFC中铝和铁元素的含量,采用如图所示流程进行。

已知:
回答下列回题:
① 中铝元素的化合价为
中铝元素的化合价为___________ 。
②步骤中的试剂A是___________ (填名称);步骤Ⅳ中生成的B是___________ (填化学式)。
③写出步骤Ⅲ发生反应的化学方程式:___________ 。
(2)某工厂欲以工业废料(铁、铁和铝的氧化物)为原料制取PAFC,设计如下流程:

①所得酸性溶液中,不能确定是否一定存在的阳离子是___________ (填元素符号);不能确定的原因是___________ (用离子方程式表示);为证明该离子确实存在,可采用的操作是___________ (指明所采用的试剂及观察到的现象)。
②往酸性溶液中加入试剂X的目的是___________ (用离子方程式表示)。
③调节pH的目的是___________ 。
(3)根据下列实验结果,求出氯化铝铁的化学式。
步骤①,取 样品,加入足量硝酸溶解后,再加入
样品,加入足量硝酸溶解后,再加入 溶液至不再有沉淀生成,过滤,洗涤,干燥后,称得固体质量为28.7g。
溶液至不再有沉淀生成,过滤,洗涤,干燥后,称得固体质量为28.7g。
步骤②:将步骤①中滤液与洗涤液混合,加入过量NaOH溶液,过滤,洗涤,干燥后,称得固体质量为10.7g。
氯化铝铁的化学式为___________ 。
 ,其中A1、Fe元素均为+3价},该物质广泛应用于日常生活用水和工业废水的处理。回答下列问题:
,其中A1、Fe元素均为+3价},该物质广泛应用于日常生活用水和工业废水的处理。回答下列问题:(1)为检测PAFC中铝和铁元素的含量,采用如图所示流程进行。

已知:

回答下列回题:
①
 中铝元素的化合价为
中铝元素的化合价为②步骤中的试剂A是
③写出步骤Ⅲ发生反应的化学方程式:
(2)某工厂欲以工业废料(铁、铁和铝的氧化物)为原料制取PAFC,设计如下流程:

①所得酸性溶液中,不能确定是否一定存在的阳离子是
②往酸性溶液中加入试剂X的目的是
③调节pH的目的是
(3)根据下列实验结果,求出氯化铝铁的化学式。
步骤①,取
 样品,加入足量硝酸溶解后,再加入
样品,加入足量硝酸溶解后,再加入 溶液至不再有沉淀生成,过滤,洗涤,干燥后,称得固体质量为28.7g。
溶液至不再有沉淀生成,过滤,洗涤,干燥后,称得固体质量为28.7g。步骤②:将步骤①中滤液与洗涤液混合,加入过量NaOH溶液,过滤,洗涤,干燥后,称得固体质量为10.7g。
氯化铝铁的化学式为
您最近一年使用:0次
解答题-实验探究题
|
适中
(0.65)
解题方法
【推荐1】Fe、Cu都是人类早期使用的金属,某校化学研究性学习小组的同学通过实验研究Fe、Cu及其化合物的相关性质。回答下列问题:
(1)甲同学取两束细铜丝用砂纸打磨后在酒精灯上加热至红热,再分别伸入盛有 、
、 的集气瓶中。则甲同学在两个集气瓶中观察到的现象是
的集气瓶中。则甲同学在两个集气瓶中观察到的现象是__________ 。

(2)乙同学为验证Fe在冷的浓硝酸中发生钝化但能和热的浓硝酸发生反应,设计了如图所示的实验装置,结果发现装置1中无明显现象,装置2中________ (填实验现象);为使装置2能控制反应的进行,请对装置2提出改进意见:_________ 。
(3)丙同学在Fe和热的浓硝酸反应后的溶液中加入一块Cu片,Cu片逐渐溶解,反应一段时间后Cu片不再溶解。
①丙同学依据反应现象得出Cu片溶解的原因是Cu和 发生了反应,则他依据的反应现象是
发生了反应,则他依据的反应现象是______ 。
②丁同学认为丙同学的结论不完全正确,理由是___________ 。
(4)请设计实验证明加入Cu片并反应完全后的溶液中含有 但不含
但不含 。写出具体的实验方案和实验现象:
。写出具体的实验方案和实验现象:_____________ 。
(1)甲同学取两束细铜丝用砂纸打磨后在酒精灯上加热至红热,再分别伸入盛有
 、
、 的集气瓶中。则甲同学在两个集气瓶中观察到的现象是
的集气瓶中。则甲同学在两个集气瓶中观察到的现象是
(2)乙同学为验证Fe在冷的浓硝酸中发生钝化但能和热的浓硝酸发生反应,设计了如图所示的实验装置,结果发现装置1中无明显现象,装置2中
(3)丙同学在Fe和热的浓硝酸反应后的溶液中加入一块Cu片,Cu片逐渐溶解,反应一段时间后Cu片不再溶解。
①丙同学依据反应现象得出Cu片溶解的原因是Cu和
 发生了反应,则他依据的反应现象是
发生了反应,则他依据的反应现象是②丁同学认为丙同学的结论不完全正确,理由是
(4)请设计实验证明加入Cu片并反应完全后的溶液中含有
 但不含
但不含 。写出具体的实验方案和实验现象:
。写出具体的实验方案和实验现象:
您最近一年使用:0次
解答题-实验探究题
|
适中
(0.65)
名校
【推荐2】甲同学采用如图Ⅰ所示装置验证铜与稀硝酸的反应,并用排水法收集NO气体。
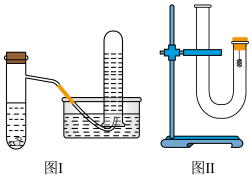
(1)反应过程中的实验现象是__________________________________________________ 。
(2)乙同学认为虽然收集到的气体为一氧化氮,但并不能说明反应中一定生成一氧化氮。你认为他的理由是______________________________________________________________ 。
(3)丙同学采用如图Ⅱ所示装置进行实验,证明了铜与稀硝酸反应生成一氧化氮。该同学的步骤如下表所示,请回答实验中的有关问题。
(4)从环境保护的角度看,丙同学的实验存在__________ 缺陷?你认为应如何改进__________ ?

(1)反应过程中的实验现象是
(2)乙同学认为虽然收集到的气体为一氧化氮,但并不能说明反应中一定生成一氧化氮。你认为他的理由是
(3)丙同学采用如图Ⅱ所示装置进行实验,证明了铜与稀硝酸反应生成一氧化氮。该同学的步骤如下表所示,请回答实验中的有关问题。
| 实验步骤 | 问题 |
| ①从U形管左端加入稀硝酸,直至充满U形管右端 | |
| ②用附有铜丝的胶塞塞住U形管右端,观察现象 | 实验现象是 |
| ③待反应停止后打开胶塞,观察实验现象 | 打开胶塞后的实验现象是 |
(4)从环境保护的角度看,丙同学的实验存在
您最近一年使用:0次
解答题-实验探究题
|
适中
(0.65)
【推荐3】氮及其化合物与生产生活关系密切。请完成下列填空:
(1)某学校化学学习小组为探究二氧化氮的性质,按下图所示装置进行实验。

①装置甲中盛放浓硝酸的仪器A的名称是__________________ , 装置丙中的试管内发生反应的离子方程式为:______________________________ 。
②实验过程中装置乙、丙中出现的现象分别是________________________ ;______________ 。
(2)NO在医疗上有重要的应用,曾被科学家作为研究的重要物质。现有容积为aL的试管盛满NO后倒扣于水槽中,再向试管中通入一定体积O2后,试管内气体的体积为试管容积的一半,则通入的O2的在相同条件下体积为____________ 。
A.0.75aL B.0.375aL C.0.625aL D.1.25aL
(3)在盛有一定量浓硝酸的试管中加入12.8g的铜片发生反应。请回答下列问题:
①开始阶段,反应的化学方程式为_______________________________ ,后一阶段生成的气体为
_______ ,若两者恰好完全反应整个反应过程共产生标准状况下气体2.24L,则反应过程中被还原的HNO3的物质的量为__________ mol.,参加反应的HNO3的物质的量为__________ mol.。
②反应结束后往试管中加入铜片,再加入少量20%的稀硫酸,这时铜片上又有气泡产生,反应的离子方程式为____________________________________________________ 。
(1)某学校化学学习小组为探究二氧化氮的性质,按下图所示装置进行实验。

①装置甲中盛放浓硝酸的仪器A的名称是
②实验过程中装置乙、丙中出现的现象分别是
(2)NO在医疗上有重要的应用,曾被科学家作为研究的重要物质。现有容积为aL的试管盛满NO后倒扣于水槽中,再向试管中通入一定体积O2后,试管内气体的体积为试管容积的一半,则通入的O2的在相同条件下体积为
A.0.75aL B.0.375aL C.0.625aL D.1.25aL
(3)在盛有一定量浓硝酸的试管中加入12.8g的铜片发生反应。请回答下列问题:
①开始阶段,反应的化学方程式为
②反应结束后往试管中加入铜片,再加入少量20%的稀硫酸,这时铜片上又有气泡产生,反应的离子方程式为
您最近一年使用:0次
解答题-工业流程题
|
适中
(0.65)
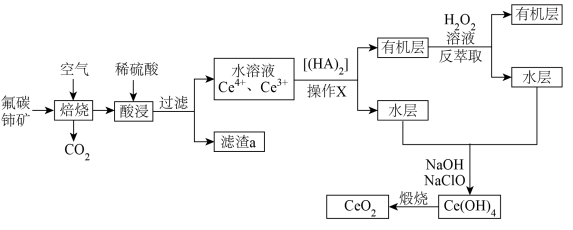
【推荐1】以氟碳铈矿(含 、
、 、
、 等)制备氧化铈
等)制备氧化铈 的流程如下:
的流程如下:
已知:在硫酸体系中, 在
在 中的溶解度大于其在水中的溶解度,
中的溶解度大于其在水中的溶解度, 与之相反。
与之相反。
(1)为提高酸浸效率通常采取的措施可以是将氟碳铈矿粉碎,还可以是___________ (任写一条)。
(2) 中
中 元素的化合价为
元素的化合价为___________ ;滤渣 的主要成分是
的主要成分是___________ 、___________ (填写化学式)。
(3)操作X需要的玻璃仪器有___________ 、___________ 。
(4)写出反萃取过程的离子方程式___________ 。
(5)常温下,向反萃取后的水层中先加入 调节
调节 使
使 完全沉淀,则调节
完全沉淀,则调节 应大于
应大于___________ (已知离子浓度小于 时,认为沉淀完全,
时,认为沉淀完全,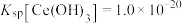 );再向产生的
);再向产生的 中加入
中加入 溶液,写出该反应的化学方程式
溶液,写出该反应的化学方程式___________ 。
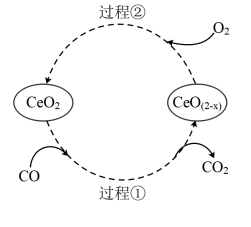
(6) 是汽车尾气净化催化剂中最重要的助剂,工作原理如图所示。写出过程①发生反应的化学方程式:
是汽车尾气净化催化剂中最重要的助剂,工作原理如图所示。写出过程①发生反应的化学方程式:___________ 。
 、
、 、
、 等)制备氧化铈
等)制备氧化铈 的流程如下:
的流程如下:
已知:在硫酸体系中,
 在
在 中的溶解度大于其在水中的溶解度,
中的溶解度大于其在水中的溶解度, 与之相反。
与之相反。(1)为提高酸浸效率通常采取的措施可以是将氟碳铈矿粉碎,还可以是
(2)
 中
中 元素的化合价为
元素的化合价为 的主要成分是
的主要成分是(3)操作X需要的玻璃仪器有
(4)写出反萃取过程的离子方程式
(5)常温下,向反萃取后的水层中先加入
 调节
调节 使
使 完全沉淀,则调节
完全沉淀,则调节 应大于
应大于 时,认为沉淀完全,
时,认为沉淀完全,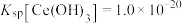 );再向产生的
);再向产生的 中加入
中加入 溶液,写出该反应的化学方程式
溶液,写出该反应的化学方程式(6)
 是汽车尾气净化催化剂中最重要的助剂,工作原理如图所示。写出过程①发生反应的化学方程式:
是汽车尾气净化催化剂中最重要的助剂,工作原理如图所示。写出过程①发生反应的化学方程式:
您最近一年使用:0次
解答题-工业流程题
|
适中
(0.65)
解题方法
【推荐2】某兴趣小组设计了利用MnO(含少量铁的氧化物和不溶性杂质)制备二氧化锰的两种方案流程如下:

已知:①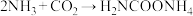 ;MnO+H2NCOONH4
;MnO+H2NCOONH4
 ;
;
②MnO易被空气中氧化; 难溶于水;
难溶于水; 受热易分解生成
受热易分解生成 与
与 ,其他硝酸盐相对难分解。
,其他硝酸盐相对难分解。
请回答:
(1)方案一:滤液1溶质的主要成分是_______ ,真空加热的目的是_______ 。
(2)下列说法不正确的是_______
A.步骤Ⅰ中,铁元素主要以 形式除去
形式除去
B.步骤Ⅳ和Ⅴ,步骤Ⅳ所得的滤液3和步骤Ⅴ生成的气体可以循环利用
C.相较方案二,方案一操作简单,步骤少,绿色环保更适宜工业生产。
(3)步骤Ⅰ,硝酸的质量分数选取50%的理由是_______ 。
(4)由碳酸锰在空气中灼烧获得的 结构比较疏松,步骤Ⅵ用硫酸溶解其中的
结构比较疏松,步骤Ⅵ用硫酸溶解其中的 后,再用合适浓度的
后,再用合适浓度的 氧化后,可得到结构相对致密的重质
氧化后,可得到结构相对致密的重质 精品。写出其中发生的离子反应方程式
精品。写出其中发生的离子反应方程式_______ 。
(5)碱土或稀土元素(A)和过渡金属(B)可以形成多种合金,广泛应用于催化、储氢等领域。图a给出某合金的理想结构晶胞图,b、c、d分别是其沿不同方向的投影示意图,此结构属六方晶系。

①写出该合金的组成_______ 。
②晶体沿c轴方向的投影图是_______ (填字母)

已知:①
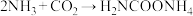 ;MnO+H2NCOONH4
;MnO+H2NCOONH4
 ;
;
②MnO易被空气中氧化;
 难溶于水;
难溶于水; 受热易分解生成
受热易分解生成 与
与 ,其他硝酸盐相对难分解。
,其他硝酸盐相对难分解。请回答:
(1)方案一:滤液1溶质的主要成分是
(2)下列说法不正确的是
A.步骤Ⅰ中,铁元素主要以
 形式除去
形式除去B.步骤Ⅳ和Ⅴ,步骤Ⅳ所得的滤液3和步骤Ⅴ生成的气体可以循环利用
C.相较方案二,方案一操作简单,步骤少,绿色环保更适宜工业生产。
(3)步骤Ⅰ,硝酸的质量分数选取50%的理由是
(4)由碳酸锰在空气中灼烧获得的
 结构比较疏松,步骤Ⅵ用硫酸溶解其中的
结构比较疏松,步骤Ⅵ用硫酸溶解其中的 后,再用合适浓度的
后,再用合适浓度的 氧化后,可得到结构相对致密的重质
氧化后,可得到结构相对致密的重质 精品。写出其中发生的离子反应方程式
精品。写出其中发生的离子反应方程式(5)碱土或稀土元素(A)和过渡金属(B)可以形成多种合金,广泛应用于催化、储氢等领域。图a给出某合金的理想结构晶胞图,b、c、d分别是其沿不同方向的投影示意图,此结构属六方晶系。

①写出该合金的组成
②晶体沿c轴方向的投影图是
您最近一年使用:0次
解答题-工业流程题
|
适中
(0.65)
【推荐3】高纯度氧化铝有广泛的用途,某研究小组研究用以下流程制取高纯度氧化铝:
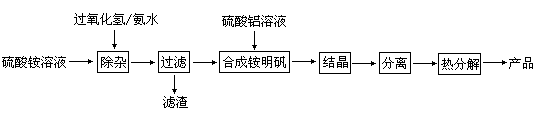
根据上述流程图填空:
(1)“除杂”操作是加入过氧化氢后,用氨水调节溶液的pH约为8.0,以除去硫酸铵溶液中的少量Fe2+。请写出在除去Fe2+离子的过程中,发生的主要反应的离子方程式____________________________ 。
(2)通常条件下Ksp〔Fe(OH)3〕=4.0×10—38,除杂后溶液中c(Fe3+)约为_____________ 。
(3)配制硫酸铝溶液时,需用硫酸酸化,酸化的目的是________________________ 。
(4)“结晶”这步操作中,母液经蒸发浓缩至溶液表面刚出现薄层晶体即停止加热,然后冷却结晶,得到铵明矾晶体(含结晶水)。母液不能蒸干的原因是____________ 。
(5)“分离”操作的名称是_____________ (填字母代号)。
A.蒸馏 B.分液 C.过滤
(6)铵明矾晶体的化学式为NH4Al(SO4)2·12H2O,在0.1mol/L铵明矾的水溶液中,离子浓度最大的离子是__________ ,离子浓度最小的离子是____________ 。

根据上述流程图填空:
(1)“除杂”操作是加入过氧化氢后,用氨水调节溶液的pH约为8.0,以除去硫酸铵溶液中的少量Fe2+。请写出在除去Fe2+离子的过程中,发生的主要反应的离子方程式
(2)通常条件下Ksp〔Fe(OH)3〕=4.0×10—38,除杂后溶液中c(Fe3+)约为
(3)配制硫酸铝溶液时,需用硫酸酸化,酸化的目的是
(4)“结晶”这步操作中,母液经蒸发浓缩至溶液表面刚出现薄层晶体即停止加热,然后冷却结晶,得到铵明矾晶体(含结晶水)。母液不能蒸干的原因是
(5)“分离”操作的名称是
A.蒸馏 B.分液 C.过滤
(6)铵明矾晶体的化学式为NH4Al(SO4)2·12H2O,在0.1mol/L铵明矾的水溶液中,离子浓度最大的离子是
您最近一年使用:0次



