2022年江苏省镇江市丹徒区中考模拟化学试题 (5)
江苏
九年级
模拟预测
2022-07-13
199次
整体难度:
适中
考查范围:
物质构成的奥秘、身边的化学物质、化学与社会发展、化学实验、物质的化学变化
2022年江苏省镇江市丹徒区中考模拟化学试题 (5)
江苏
九年级
模拟预测
2022-07-13
199次
整体难度:
适中
考查范围:
物质构成的奥秘、身边的化学物质、化学与社会发展、化学实验、物质的化学变化
一、选择题 添加题型下试题
选择题-单选题
|
容易(0.94)
解题方法
1. 下列属于纯净物的是
| A.干冰 | B.食盐 | C.香醋 | D.黄酒 |
【知识点】 纯净物和混合物的判断解读
您最近一年使用:0次
2022-05-10更新
|
168次组卷
|
4卷引用:2022年江苏省镇江市中考一模化学试题
选择题-单选题
|
容易(0.94)
解题方法
2. 下列物质的用途主要与其化学性质有关的是
| A.干冰用作人工降雨 | B.液氮可用于医疗手术 |
| C.铁粉用作食品保鲜 | D.铜丝用作制导线 |
您最近一年使用:0次
2022-06-15更新
|
83次组卷
|
3卷引用:2022年江苏省镇江市市区中考二模化学试题
选择题-单选题
|
适中(0.65)
解题方法
3. 化学与生活、生产关系密切。下列做法正确的是
| A.霉变食品,煮熟食用 | B.塑料回收,资源再生 |
| C.油锅起火,用水浇灭 | D.明矾净水,杀菌消毒 |
您最近一年使用:0次
2022-07-03更新
|
52次组卷
|
2卷引用:2022年江苏省镇江市丹徒区中考二模化学试题
选择题-单选题
|
适中(0.65)
解题方法
4. 下列物质归类正确的是
| 选项 | 归类 | 物质 |
| A | 金属材料 | 硬铝、陶瓷、青铜 |
| B | 糖类物质 | 淀粉、葡萄糖、维生素 |
| C | 铵态氮肥 | 碳铵、硝酸钾、硝酸铵 |
| D | 复合材料 | 玻璃钢、碳纤维、汽车轮胎 |
| A.A | B.B | C.C | D.D |
您最近一年使用:0次
2022-07-03更新
|
75次组卷
|
2卷引用:2022年江苏省镇江市丹徒区中考二模化学试题
选择题-单选题
|
适中(0.65)
5. 在“粗盐的初步提纯”实验中,下列操作正确的是( )
A.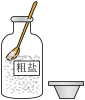 取用粗盐 取用粗盐 | B. 溶解粗盐 溶解粗盐 |
C.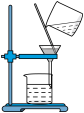 过滤粗盐水 过滤粗盐水 | D. 蒸干滤液 蒸干滤液 |
您最近一年使用:0次
2019-06-26更新
|
2797次组卷
|
64卷引用:江苏省苏州市2019年中考化学试题
江苏省苏州市2019年中考化学试题苏州市工业园区2019-2020学年九年级上学期期中化学试题考点04 化学实验基本操作-备战2020年中考化学考点天天刷江苏省苏州市常熟市2019-2020学年九年级上学期期中化学试题(已下线)专题14 实验操作与仪器使用《备战2020年中考化学真题分类汇编》(江苏省)湖北省黄冈市麻城市思源实验学校2019-2020学年九年级下学期4月在线考试化学试题(实验班)2020年广东省东莞市东莞中学初中部中考一模化学试题湖北省黄冈市罗田县万密斋初级中学2019-2020学年九年级下学期3月网络测试化学试题(已下线)课题11.1 生活中常见的盐 第1课时(练)-2019-2020学年九年级化学下册同步精品课堂(人教版)2020年江苏省苏州市昆山市九校联考中考模拟化学试题2020年福建省百校联合模拟中考化学试题(已下线)【万唯原创】2020年河北省中考化学面对面卷讲解册九年级第一部分九~十一单元(已下线)2020-2021学年九年级上学期第1章 化学的魅力 单元检测-九年级化学沪教版第一学期(试用本)同步精品课堂(上海专用)(已下线)主题 盐 化肥·基础必练2(已下线)主题 常见的酸碱盐·满分特训1(已下线)【万唯原创】2020年山西省中考化学面对面卷讲解册模块一第7-10讲(已下线)主题 盐 化肥·满分特训2(已下线)主题 盐 化肥?满分特训2(已下线)专题16: 常见仪器和基本实验操作(测试)--2021年中考化学一轮复习讲练测(人教版)(已下线)2020-2021学年人教版化学九年级下期末模拟卷-2020-2021学年九年级化学下册同步单元AB卷(人教版)(已下线)专题7.4 结晶现象(练习)——九年级化学下册同步精品课堂(科粤版)(已下线)考点04 化学实验基本操作-备战2021年中考化学考点天天刷(已下线)2021年中考化学全真模拟试卷(二)-2020-2021学年九年级化学下册同步单元AB卷(人教版)(已下线)2021中考广东省化学模拟试题(四)江苏省苏州市吴中区木渎实验中学2020-2021学年九年级上学期10月月考化学试题江苏省南京市栖霞区南京伯乐中学2020-2021学年九年级下学期月考化学试题2021年江苏省苏州市昆山市中考一调化学试题(已下线)必刷卷02-2021年中考化学考前信息必刷卷(扬州专用)福建省福州市鼓楼区福州二十二中2020-2021学年九年级下学期4月月考化学试题福建省泉州市永春县永春第一中学2019-2020学年九年级下学期4月月考化学试题(已下线)课题11.1.1 氯化钠和粗盐提纯-2021-2022学年九年级化学下册同步分层作业(人教版)江苏省苏州工业园区五校2021-2022学年九年级下学期3月线上教学评估化学试题福建省厦门市外国语学校2021-2022学年九年级下学期4月摸底练习化学试题2022年江苏省南京市玄武区中考一模化学试题(已下线)化学-(苏州卷)【试题猜想】2022年中考考前最后一卷2022年湖北省孝感黄冈咸宁三市中考适应性考试化学试题(三)2022年江西省南昌市中考第二次调研检测化学试题2022年江苏省镇江市市区中考二模化学试题2022年湖北省武汉市二中广雅中学5月月考化学试题2022年湖南省永州市蓝山县部分学校中考仿真模拟化学试题(二)2022年江苏省镇江市区中考二模化学试题2021年吉林省长春市汽车经济开发区中考三模化学试题2022年江苏省镇江市丹徒区中考模拟化学试题 (5)科粤版化学九年级下册课时练习:7.4 结晶现象第七章溶液检测卷---2021-2022学年九年级化学科粤版(2012)下册2023年吉林省长春市二道区英俊中学中考一模化学试题2023年重庆市中考押题化学试题(一)(已下线)金榜卷02-2023年中考化学考前一模名师押题金榜卷(南京专用)2023年3月山东省滨州市惠民县知识竞赛化学试题安徽省六安市金安区皋城中学2022-2023学年九年级下学期期中化学试题2023年江苏省淮安市淮安区中考一模化学试题2023年江苏省盐城市建湖县中考二模化学试题2023年江苏省盐城市滨海县中考二模化学试题(已下线)卷03-2023年中考化学考前押宝卷(陕西卷)2023年福建省泉州市泉港区教学质量检测化学试题2023年湖北省黄冈孝感咸宁三市初中学业考试适应性试化学试题(三)江苏省淮安市淮阴区2022-2023学年九年级下学期期中化学试题2023年陕西省西安市雁塔区陕西师范大学附属中学第九次模拟化学试题2023年6月湖北省襄阳市老河口市竹林桥中学中考模拟化学试题(已下线)第一章 化学的魅力(单元测试)-2023-2024学年九年级化学第一学期同步精品课堂(沪教版·上海)(已下线)专题08 盐 化肥(测试)-2024年中考化学一轮复习讲练测(全国通用)江苏省高邮市2023-2024学年九年级上学期期末联考化学试题2024年陕西省西安市滨河学校中考三模化学试题(已下线)黄金卷05(南京专用)-【赢在中考·黄金8卷】备战2024年中考化学模拟卷(南京专用)
选择题-单选题
|
较易(0.85)
解题方法
6. 下列实验方法正确的是
| A.用活性炭使硬水转化为软水 | B.用灼烧的方法区分羊毛和棉纱线 |
| C.用CuSO4溶液提纯蛋白质 | D.用淀粉溶液检验是否为加碘食盐 |
您最近一年使用:0次
2022-05-10更新
|
131次组卷
|
4卷引用:2022年江苏省镇江市中考一模化学试题
选择题-单选题
|
适中(0.65)
解题方法
7. 下列排列顺序正确的是
A.溶液的pH值: | B.氯元素的化合价: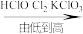 |
C.物质的溶解性: | D.铜元素质量分数: |
您最近一年使用:0次
2022-05-08更新
|
171次组卷
|
5卷引用:2022年江苏省镇江市中考一模化学试题
选择题-单选题
|
适中(0.65)
解题方法
8. 下列指定反应的化学方程式正确的是
A.实验室制二氧化碳: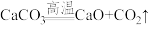 |
B.燃烧法除去CO2中少量的CO: |
C.用小苏打治疗胃酸过多: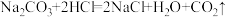 |
D.KO2与CO2反应生成碳酸钾和O2: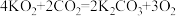 |
您最近一年使用:0次
2022-05-08更新
|
170次组卷
|
6卷引用:2022年江苏省镇江市中考一模化学试题
2022年江苏省镇江市中考一模化学试题2022年内蒙古通辽市科尔沁左翼中旗中考二模化学试题2022年江苏省镇江市中考模拟化学试题2022年江苏省镇江市丹徒区中考模拟化学试题 (5)2022年江苏省镇江市丹徒区中考模拟化学试题(6)(已下线)化学(哈尔滨卷)-学易金卷:2024年中考第二次模拟考试
9. 下列对实验现象的描述或实验操作正确的是
| A.红磷在空气中燃烧,产生大量白雾 |
| B.点燃或加热可燃性气体前,检测其纯度 |
| C.稀释浓硫酸时,将水倒入浓硫酸中,并不断搅拌 |
| D.蒸发食盐水时,待蒸发皿中水分蒸干后停止加热 |
您最近一年使用:0次
2022-05-10更新
|
138次组卷
|
4卷引用:2022年江苏省镇江市中考一模化学试题
选择题-单选题
|
适中(0.65)
解题方法
10. 二氧化氯可杀灭新型冠状病毒,下列说法不正确的是


| A.乙的溶液应避光保存 | B.整个转化过程中,氯元素化合价保持不变 |
| C.反应前后原子的种类和个数不变 | D.转化 2 中丙和丁的分子个数比为 2:1 |
您最近一年使用:0次
2022-06-14更新
|
145次组卷
|
4卷引用:2022年江苏省镇江市市区中考二模化学试题
选择题-单选题
|
适中(0.65)
解题方法
11. 在航天飞船中常用铝粉与高氯酸铵(NH4ClO4)的混合物为固体燃料。发射时,点燃的铝粉产生大量的热引发高氯酸铵发生下列反应: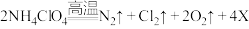 。下列说法不正确的是
。下列说法不正确的是
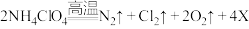 。下列说法不正确的是
。下列说法不正确的是| A.X 的化学式为 H2O | B.该反应属于分解反应 |
| C.反应过程中共有 3 种单质 | D.反应前后所有元素的化合价都发生了变化 |
您最近一年使用:0次
2022-06-14更新
|
115次组卷
|
3卷引用:2022年江苏省镇江市市区中考二模化学试题
12. 如图为 NaHCO3分解实验装置。下列说法不正确的是
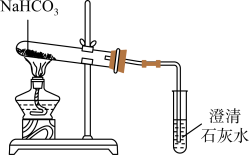

| A.试管内固体逐渐消失 | B.石灰水混浊,说明反应生成了 CO2 |
| C.充分加热后的固体溶于水,滴加酚酞,变红 | D.加热时试管口应略向下倾斜 |
【知识点】 碳酸氢钠、碳酸钠、碳酸钙解读 物质的加热解读
您最近一年使用:0次
2022-06-13更新
|
198次组卷
|
5卷引用:2022年江苏省镇江市市区中考二模化学试题
2022年江苏省镇江市市区中考二模化学试题2022年江苏省镇江市区中考二模化学试题2022年江苏省镇江市丹徒区中考模拟化学试题 (5)(已下线)课题11.1 生活中常见的盐 第1课时(练习)-2022-2023学年九年级化学下册同步精品课堂(人教版)2023分层教学_人教版_第十一单元 课题1生活中常见的盐第2课时_中等题(已审)
选择题-单选题
|
适中(0.65)
名校
解题方法
13. 下列物质的转化在给定条件下均能实现的是
A. |
B. |
C. |
D. |
您最近一年使用:0次
2022-05-10更新
|
226次组卷
|
4卷引用:2022年江苏省镇江市中考一模化学试题
选择题-单选题
|
适中(0.65)
解题方法
14. 下列实验操作中(括号内为待检验物质或杂质),能达到实验目的的是
| 选项 | 物质 | 目的 | 主要实验操作 |
| A | N2(O2) | 除杂 | 足量碳粉、点燃的方法 |
| B | K2SO4溶液中的(NH4)2SO4 | 检验 | 取样于试管中,滴入Ba(OH)2溶液,微热,在管口放湿润的红色石蕊试纸,观察试纸颜色变化 |
| C | NaCl溶液、Na2CO3溶液 | 鉴别 | 取样,分别滴入AgNO3溶液,观察是否出现沉淀 |
| D | NaNO3和Ba(NO3)2的混合液 | 分离 | 先加入适量的Na2SO4溶液,过滤,洗涤,再向滤渣中加入一定量的稀HNO3,充分搅拌 |
| A.A | B.B | C.C | D.D |
您最近一年使用:0次
2022-07-03更新
|
87次组卷
|
2卷引用:2022年江苏省镇江市丹徒区中考二模化学试题
选择题-单选题
|
适中(0.65)
解题方法
15. 如图是用CaSO4吸收NH3、CO2生产(NH4)2SO4和CaO的流程,下列说法不正确的是


| A.该流程的缺点是能耗较大 |
| B.CaSO4制浆的目的是增大气体的吸收速率 |
| C.理论上,生产5.6tCaO,需要1.7tNH3参加反应 |
| D.若CaSO4的量不足,(NH4)2SO4中可能会混有NH4HCO3、(NH4)2CO3等杂质 |
您最近一年使用:0次
2022-06-30更新
|
64次组卷
|
2卷引用:2022年江苏省镇江市丹徒区中考二模化学试题
16. 下列说法正确的是
| A.离子中所含的质子数一定不等于电子数 |
| B.不饱和溶液转变成饱和溶液,溶质质量分数一定增大 |
| C.向某食盐样品中滴加淀粉溶液,不变蓝,该食盐一定不是加碘的盐 |
| D.Cu(OH)2加热会变为黑色,新制的Cu(OH)2与葡萄糖溶液混合加热,一定也变为黑色 |
您最近一年使用:0次
2022-07-03更新
|
85次组卷
|
3卷引用:2022年江苏省镇江市丹徒区中考二模化学试题
选择题-单选题
|
适中(0.65)
名校
解题方法
17. NaCl和KNO3的溶解度表及溶解度曲线如下。下列说法不正确的是

温度 | 10 | 20 | 30 | 40 | 50 | |
溶解度S/g | NaCl | 35.8 | 36.0 | 36.3 | 36.6 | 37.0 |
KNO3 | 21.9 | 31.6 | 45.8 | 63.9 | 85.5 | |

| A.甲曲线表示的固体是KNO3的溶解度曲线 |
| B.KNO3中混有少量NaCl,可用冷却热饱和溶液的方法提纯KNO3 |
| C.将T2℃时饱和的甲、乙溶液分别降温到T1℃,甲析出晶体的质量一定大于乙 |
| D.将b点的甲溶液降温到T1℃,加甲固体或恒温蒸发一定量的水均可得到a点的溶液 |
您最近一年使用:0次
2022-05-08更新
|
264次组卷
|
5卷引用:2022年江苏省镇江市中考一模化学试题
选择题-单选题
|
较难(0.4)
18. 将Ba(OH)2溶液分别与MgCl2溶液、稀盐酸反应后的废液加入同一烧杯中,再向其中逐滴滴加稀硫酸,产生沉淀的质量与滴加的稀硫酸质量关系如图所示。下列说法中不正确的是


| A.M点溶液中滴加酚酞试液,酚酞变红色 | B.N点沉淀的成分为1种 |
| C.该稀硫酸的溶质质量分数为9.8% | D.m=75.7 |
您最近一年使用:0次
2022-07-03更新
|
101次组卷
|
2卷引用:2022年江苏省镇江市丹阳市网上适应性(二模)化学试题
二、多选题 添加题型下试题
多选题
|
较难(0.4)
19. 将Ba(OH)2溶液滴入50.0 g MgSO4和HCl的混合溶液中,产生的沉淀质量与滴加Ba(OH)2溶液体积的关系如图所示。下列说法不正确的是


| A.M点溶液中含有三种溶质 |
| B.N点溶液的pH小于Q点溶液的pH |
| C.混合溶液中HCl的质量分数为7.3% |
| D.若V1:V2=2:1,则m=43.65 |
您最近一年使用:0次
2022-06-30更新
|
109次组卷
|
2卷引用:2022年江苏省镇江市丹徒区中考二模化学试题
三、选择题 添加题型下试题
选择题-单选题
|
困难(0.15)
解题方法
20. 已知: :
: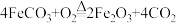 .46.4gFeCO3粉末在空气中加热一段时间,得到剩余固体30.4g,剩余固体中加入300g质量分数为19.6%的稀硫酸,充分反应,所得溶液质量为330.4g。下列说法不正确的是
.46.4gFeCO3粉末在空气中加热一段时间,得到剩余固体30.4g,剩余固体中加入300g质量分数为19.6%的稀硫酸,充分反应,所得溶液质量为330.4g。下列说法不正确的是
 :
: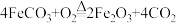 .46.4gFeCO3粉末在空气中加热一段时间,得到剩余固体30.4g,剩余固体中加入300g质量分数为19.6%的稀硫酸,充分反应,所得溶液质量为330.4g。下列说法不正确的是
.46.4gFeCO3粉末在空气中加热一段时间,得到剩余固体30.4g,剩余固体中加入300g质量分数为19.6%的稀硫酸,充分反应,所得溶液质量为330.4g。下列说法不正确的是| A.剩余固体中含两种物质 |
| B.加热时,有1.6gO2参加反应 |
| C.剩余固体中Fe、O元素质量比为14:5 |
| D.剩余固体与稀硫酸的反应中,共消耗39.2gH2SO4 |
您最近一年使用:0次
2022-07-03更新
|
368次组卷
|
2卷引用:2022年江苏省镇江市丹徒区中考二模化学试题
四、填空与简答 添加题型下试题
填空与简答-填空题
|
适中(0.65)
解题方法
21. 用化学符号表示:
(1)硅元素____________ ;
(2)合成氨气的氮气____________ ;
(3)人体缺少____________ 元素会骨质疏松;
(4)相对分子质量最小的氧化物____________ 。
(1)硅元素
(2)合成氨气的氮气
(3)人体缺少
(4)相对分子质量最小的氧化物
您最近一年使用:0次
2022-05-08更新
|
138次组卷
|
4卷引用:2022年江苏省镇江市中考一模化学试题
填空与简答-填空题
|
适中(0.65)
解题方法
22. 选择下列适当的物质填空(选填字母序号):
A.硫酸铜 B.稀硫酸 C.明矾 D.氢氧化钠 E.硝酸钾 F.维生素 G.油脂 H.碳酸氢钠
(1)可用于金属除锈的是_______ 。
(2)在蔬菜、水果中富含_______ 。
(3)可配制波尔多液的是_______ 。
(4)可治疗胃酸过多的是_______ 。
(5)常作家庭净水剂的是_______ 。
(6)可作农业复合肥的是_______ 。
A.硫酸铜 B.稀硫酸 C.明矾 D.氢氧化钠 E.硝酸钾 F.维生素 G.油脂 H.碳酸氢钠
(1)可用于金属除锈的是
(2)在蔬菜、水果中富含
(3)可配制波尔多液的是
(4)可治疗胃酸过多的是
(5)常作家庭净水剂的是
(6)可作农业复合肥的是
您最近一年使用:0次
2022-06-29更新
|
49次组卷
|
2卷引用:2022年江苏省镇江市丹阳市网上适应性(二模)化学试题
五、实验题 添加题型下试题
实验题
|
较易(0.85)
23. 用如图所示实验验证质量守恒定律。

(1)红磷燃烧的化学方程式为_______ 。
(2)下列关于该实验的说法正确的是 (选填序号)。

(1)红磷燃烧的化学方程式为
(2)下列关于该实验的说法正确的是 (选填序号)。
| A.必须保证左盘装置不漏气 | B.必须保证红磷足量 | C.实验中气球先变大后变小 |
【知识点】 实验探究质量守恒定律解读 化学方程式的书写解读
您最近一年使用:0次
2022-06-29更新
|
58次组卷
|
3卷引用:2022年江苏省镇江市丹阳市网上适应性(二模)化学试题
六、填空与简答 添加题型下试题
填空与简答-流程题
|
适中(0.65)
解题方法
24. 碳酸钠是一种重要的无机化工原料。
(1)用途。
①作为洗涤剂,因为其水溶液呈_______ 性。
②用于生产玻璃,生产中其与二氧化硅在高温下反应生成硅酸钠(Na2SiO3)和二氧化碳,反应的化学方程式为_______ 。
(2)获取。
①古代就在碱水湖“冬天捞碱”,因为其溶解度随温度升高而_______ (选填“升高”或“降低”)。
②吕布兰法:1791年,法国医生吕布兰以食盐、浓硫酸、木炭和石灰石为原料,开创了制碳酸钠的先河,其主要原理如下:
第一步:


第二步:





此法因原料利用不充分、_______ 等原因,逐渐为索尔维法代替。
③索尔维法:1859年,比利时人索尔维用食盐、氨水、二氧化碳为原料制得纯碱,其工业流程简化如下图:

流程中可循环使用的物质有NH3和X,则X的化学式为_______ 。
④侯氏制碱法:1943年侯德榜留学海外归来,对索尔维法进行改进,向上述流程中的混合溶液加入食盐,促进_______ 结晶析出作氨肥,提高了原料利用率。
(1)用途。
①作为洗涤剂,因为其水溶液呈
②用于生产玻璃,生产中其与二氧化硅在高温下反应生成硅酸钠(Na2SiO3)和二氧化碳,反应的化学方程式为
(2)获取。
①古代就在碱水湖“冬天捞碱”,因为其溶解度随温度升高而
②吕布兰法:1791年,法国医生吕布兰以食盐、浓硫酸、木炭和石灰石为原料,开创了制碳酸钠的先河,其主要原理如下:
第一步:



第二步:






此法因原料利用不充分、
③索尔维法:1859年,比利时人索尔维用食盐、氨水、二氧化碳为原料制得纯碱,其工业流程简化如下图:

流程中可循环使用的物质有NH3和X,则X的化学式为
④侯氏制碱法:1943年侯德榜留学海外归来,对索尔维法进行改进,向上述流程中的混合溶液加入食盐,促进
您最近一年使用:0次
2022-06-29更新
|
148次组卷
|
3卷引用:2022年江苏省镇江市丹阳市网上适应性(二模)化学试题
填空与简答-流程题
|
容易(0.94)
解题方法
25. 从卤水(主要含MgCl2、NaCl、CaCl2等)中制取六水合氯化镁(MgCl2·6H2O)的流程如下:

(1)“过滤”时用到的玻璃仪器有烧杯、漏斗、____________ 。
(2)“洗涤”时,证明已洗净的方法:取最后一次洗涤的滤液,向其中滴加___________ 溶液,无明显现象。
(3)溶液X可用____________ (选填序号)。
a.稀HCl b.稀H2SO4 c.稀HNO3
(4)“系列操作”包括:蒸发浓缩、_____________ 、过滤等。

(1)“过滤”时用到的玻璃仪器有烧杯、漏斗、
(2)“洗涤”时,证明已洗净的方法:取最后一次洗涤的滤液,向其中滴加
(3)溶液X可用
a.稀HCl b.稀H2SO4 c.稀HNO3
(4)“系列操作”包括:蒸发浓缩、
您最近一年使用:0次
2022-05-08更新
|
278次组卷
|
4卷引用:2022年江苏省镇江市中考一模化学试题
填空与简答-填空题
|
适中(0.65)
解题方法
26. 某废水中氨氮(以NH3形式存在)含量过高,直接排放会导致水体富营养化。次氯酸(一种弱酸,化学式为HClO)可除去废水中的NH3,反应产生空气中含量最高的气体,同时溶液酸性增强。
(1)反应的化学方程式为_______ 。
(2)若废水的碱性过强,NH3的去除率会_______ (选填“升高”、“降低”或“无影响”)。
(1)反应的化学方程式为
(2)若废水的碱性过强,NH3的去除率会
您最近一年使用:0次
2022-06-29更新
|
68次组卷
|
2卷引用:2022年江苏省镇江市丹阳市网上适应性(二模)化学试题
七、实验题 添加题型下试题
实验题
|
适中(0.65)
解题方法
27. 请结合下图回答问题。

(1)写出有标号的仪器名称:①_______ ,②_______ 。
(2)实验室用双氧水和二氧化锰制取O2,可选用装置_______ (选填序号)和E组合,反应的化学方程式为_______ 。
(3)实验室可用装置B、C组合制取CO2,反应的化学方程式为_______ 。
(4)用如图装置制取纯净、干燥的H2。

①生成H2反应的化学方程式_______ 。
②F装置相对于B装置的优点有_______ 。
③G装置中的X溶液可选用_______ (选填序号)。
a.NaOH溶液 b.饱和NaHCO3溶液
④H装置的作用是_______ 。
⑤I装置中的Y溶液为_______ 。

(1)写出有标号的仪器名称:①
(2)实验室用双氧水和二氧化锰制取O2,可选用装置
(3)实验室可用装置B、C组合制取CO2,反应的化学方程式为
(4)用如图装置制取纯净、干燥的H2。

①生成H2反应的化学方程式
②F装置相对于B装置的优点有
③G装置中的X溶液可选用
a.NaOH溶液 b.饱和NaHCO3溶液
④H装置的作用是
⑤I装置中的Y溶液为
您最近一年使用:0次
2022-06-29更新
|
67次组卷
|
2卷引用:2022年江苏省镇江市丹阳市网上适应性(二模)化学试题
八、科学探究题 添加题型下试题
科学探究题
|
较难(0.4)
解题方法
28. 某兴趣小组对硫酸铜溶液与碱溶液的反应进行了探究。
I.向烧碱溶液中滴加适量硫酸铜溶液,产生蓝色固体,反应的化学方程式为_______ 。
Ⅱ.向硫酸铜溶液中滴加适量氨水,产生绿色固体,对绿色固体作如下探究:
【资料】常见绿色固体有碱式碳酸铜【Cu2(OH)2CO3】和碱式硫酸铜【Cu4(OH)6SO4】,都不溶于水,都能与酸反应。
【分析】(1)甲同学认为不可能是Cu2(OH)2CO3并得到一致认同,他的理由是_______ 。
(2)乙同学进行了实验:取适量绿色固体,加入足量的_______ 溶液,振荡后滴加_______ 溶液,产生白色沉淀,则该固体是碱式硫酸铜。
Ⅲ.继续滴加氨水,固体逐渐溶解,溶液变蓝色,经处理获得蓝色晶体。
【资料】该蓝色晶体为【Cux(NH3)y(H2O)z】SO4,在150℃下分解为硫酸铜、氨气和水。
【实验】取26.4g蓝色晶体用下图装置进行实验探究。

(3)控制温度在150℃持续加热一段时间,并持续通入N2,测得稀硫酸增重6.8g。
(4)停止加热,冷却至室温,加入过量浓NaOH溶液,生成9.8g沉淀。证明NaOH溶液过量的方法:静置,向上层清液中滴加_______ 溶液,无现象。
【结论】该蓝色晶体的化学式为_______ 。
【讨论】若把稀H2SO4换成浓H2SO4,则测得的【Cux(NH3)y(H2O)z】SO4中_______ (选填“x”、“y”或“z”)值会偏小。
I.向烧碱溶液中滴加适量硫酸铜溶液,产生蓝色固体,反应的化学方程式为
Ⅱ.向硫酸铜溶液中滴加适量氨水,产生绿色固体,对绿色固体作如下探究:
【资料】常见绿色固体有碱式碳酸铜【Cu2(OH)2CO3】和碱式硫酸铜【Cu4(OH)6SO4】,都不溶于水,都能与酸反应。
【分析】(1)甲同学认为不可能是Cu2(OH)2CO3并得到一致认同,他的理由是
(2)乙同学进行了实验:取适量绿色固体,加入足量的
Ⅲ.继续滴加氨水,固体逐渐溶解,溶液变蓝色,经处理获得蓝色晶体。
【资料】该蓝色晶体为【Cux(NH3)y(H2O)z】SO4,在150℃下分解为硫酸铜、氨气和水。
【实验】取26.4g蓝色晶体用下图装置进行实验探究。

(3)控制温度在150℃持续加热一段时间,并持续通入N2,测得稀硫酸增重6.8g。
(4)停止加热,冷却至室温,加入过量浓NaOH溶液,生成9.8g沉淀。证明NaOH溶液过量的方法:静置,向上层清液中滴加
【结论】该蓝色晶体的化学式为
【讨论】若把稀H2SO4换成浓H2SO4,则测得的【Cux(NH3)y(H2O)z】SO4中
您最近一年使用:0次
2022-07-03更新
|
120次组卷
|
2卷引用:2022年江苏省镇江市丹阳市网上适应性(二模)化学试题
九、填空与简答 添加题型下试题
填空与简答-推断题
|
适中(0.65)
29. 有一包粉末,是由Na2SO4、NaOH、CuSO4、NaCl、BaSO4、Na2CO3中的一种或几种组成,为确定其成分,实验如下:
(1)取样,加水,搅拌,得到无色澄清溶液M,则该粉末中一定不含有___________ 。
(2)向溶液M中加入过量Ba(NO3)2溶液,有沉淀生成,过滤,得到沉淀和溶液N,取溶液N少量,滴入酚酞,变红,则该粉末中一定含有___________ 。
(3)向步骤(2)得到的沉淀中加入足量稀HCl,沉淀全部消失且有气泡,则该粉末中一定含有________ ,不含有__________ 。
(4)进一步确定粉末成分,另取溶液N,滴入过量HNO3和AgNO3溶液,有沉淀生成,则粉末中还含有NaCl。写出滴入HNO3时发生反应的化学方程式__________ 。
(1)取样,加水,搅拌,得到无色澄清溶液M,则该粉末中一定不含有
(2)向溶液M中加入过量Ba(NO3)2溶液,有沉淀生成,过滤,得到沉淀和溶液N,取溶液N少量,滴入酚酞,变红,则该粉末中一定含有
(3)向步骤(2)得到的沉淀中加入足量稀HCl,沉淀全部消失且有气泡,则该粉末中一定含有
(4)进一步确定粉末成分,另取溶液N,滴入过量HNO3和AgNO3溶液,有沉淀生成,则粉末中还含有NaCl。写出滴入HNO3时发生反应的化学方程式
您最近一年使用:0次
2022-06-30更新
|
108次组卷
|
2卷引用:2022年江苏省镇江市丹徒区中考二模化学试题
十、综合应用题 添加题型下试题
综合应用题
|
困难(0.15)
解题方法
30. 铁及其化合物在生活、生产中应用广泛。
(一)铁的相关知识
(1)用铁锅烹煮食物,说明铁具有__________ 性;
(2)世卫组织曾多次推荐中国的铁锅作为烹饪用具,铁锅相对于其它烹饪用具的优势是___________ 。
(3)由生铁制成的铁锅初次使用前,需“烤蓝”处理,即高温烈焰使其表面形成致密的Fe3O4膜,该层膜隔绝了铁与空气中的__________ 接触,以防生锈;
(4)铁锈蚀的原理: 写出Fe(OH)2转化为Fe(OH)3的化学方程式
写出Fe(OH)2转化为Fe(OH)3的化学方程式________ 。
(5)工业上,常用稀HCl去除铁锈(用Fe2O3·xH2O表示),其反应的化学方程式是__________ 。
(二)氯化铁晶体(FeCl3﹒nH2O)的制备
以工业烧渣(含Fe2O3、FeO及少量二氧化硅)为原料生产氯化铁晶体的流程如下:

资料:FeCl3溶液在加热条件下易转化为Fe(OH)3,在HCl气体的保护下能阻止此转化的发生。
(6)X的化学式是___________ 。
(7)“氧化”中,加入H2O2是将酸性条件下的+2价铁转化为+3价的铁,该反应的化学方程式是__________ 。
(8)FeC13溶液中含有盐酸,不会影响氯化铁晶体纯度,其理由是________________ 。
(9)“一系列操作”含…、洗涤、晾干,洗涤时为减少晶体损失,最好选用__________ (选填序号)。
a.冷水 b.热水 c.95%的乙醇溶液
(三)氯化铁晶体的热重分析
经科研人员测定,以上得到的是FeCl3﹒nH2O和Fe(OH)3的混合物。称取该混合物样品64.8g,用以下装置进行热分解实验。

已知:Mr(FeCl3)=162.5、Mr(Fe(OH)3)=107
【资料】
①氯化铁晶体在120℃开始分解,生成Fe(OH)3、H2O、HCl,200℃分解完全;
②在220℃时,Fe(OH)3开始分解为Fe2O3,500℃时分解完全;
③无水CaC12作为干燥剂,不吸收HCl。
(10)装配好实验装置后,要先__________ 。
(11)加热前后均需通入N2,加热后通N2的目的是__________ 。
(12)加热玻璃管,测得500℃时B、C的质量变化如上表,玻璃管内剩余固体的质量为24.0g。
①样品中铁元素的质量为__________ g;
②n=___________ 。
(13)实验结束,不改变原有装置,将N2改为通入CO,对24.0g剩余固体继续加热一段时间,冷却,得到黑色粉末20.0g,该黑色粉末的成分是__________ 。
(一)铁的相关知识
(1)用铁锅烹煮食物,说明铁具有
(2)世卫组织曾多次推荐中国的铁锅作为烹饪用具,铁锅相对于其它烹饪用具的优势是
(3)由生铁制成的铁锅初次使用前,需“烤蓝”处理,即高温烈焰使其表面形成致密的Fe3O4膜,该层膜隔绝了铁与空气中的
(4)铁锈蚀的原理:
 写出Fe(OH)2转化为Fe(OH)3的化学方程式
写出Fe(OH)2转化为Fe(OH)3的化学方程式(5)工业上,常用稀HCl去除铁锈(用Fe2O3·xH2O表示),其反应的化学方程式是
(二)氯化铁晶体(FeCl3﹒nH2O)的制备
以工业烧渣(含Fe2O3、FeO及少量二氧化硅)为原料生产氯化铁晶体的流程如下:

资料:FeCl3溶液在加热条件下易转化为Fe(OH)3,在HCl气体的保护下能阻止此转化的发生。
(6)X的化学式是
(7)“氧化”中,加入H2O2是将酸性条件下的+2价铁转化为+3价的铁,该反应的化学方程式是
(8)FeC13溶液中含有盐酸,不会影响氯化铁晶体纯度,其理由是
(9)“一系列操作”含…、洗涤、晾干,洗涤时为减少晶体损失,最好选用
a.冷水 b.热水 c.95%的乙醇溶液
(三)氯化铁晶体的热重分析
经科研人员测定,以上得到的是FeCl3﹒nH2O和Fe(OH)3的混合物。称取该混合物样品64.8g,用以下装置进行热分解实验。

已知:Mr(FeCl3)=162.5、Mr(Fe(OH)3)=107
【资料】
①氯化铁晶体在120℃开始分解,生成Fe(OH)3、H2O、HCl,200℃分解完全;
②在220℃时,Fe(OH)3开始分解为Fe2O3,500℃时分解完全;
③无水CaC12作为干燥剂,不吸收HCl。
(10)装配好实验装置后,要先
(11)加热前后均需通入N2,加热后通N2的目的是
| 温度/℃ | 室温 | 500 |
| B装置/g | 200.0 | 218.9 |
| C装置/g | 200.0 | 221.9 |
(12)加热玻璃管,测得500℃时B、C的质量变化如上表,玻璃管内剩余固体的质量为24.0g。
①样品中铁元素的质量为
②n=
(13)实验结束,不改变原有装置,将N2改为通入CO,对24.0g剩余固体继续加热一段时间,冷却,得到黑色粉末20.0g,该黑色粉末的成分是
您最近一年使用:0次
2022-07-03更新
|
433次组卷
|
2卷引用:2022年江苏省镇江市丹徒区中考二模化学试题
试卷分析
整体难度:适中
考查范围:物质构成的奥秘、身边的化学物质、化学与社会发展、化学实验、物质的化学变化
试卷题型(共 30题)
题型
数量
选择题
19
多选题
1
填空与简答
6
实验题
2
科学探究题
1
综合应用题
1
试卷难度
知识点分析
细目表分析 导出
| 题号 | 难度系数 | 详细知识点 | 备注 |
| 一、选择题 | |||
| 1 | 0.94 | 纯净物和混合物的判断 | 单选题 |
| 2 | 0.94 | 空气中各成分的用途 二氧化碳的用途 金属的物理通性与用途 金属与氧气反应 | 单选题 |
| 3 | 0.65 | 常见几种净化水操作的比较 对人体健康危害的物质 有机材料对环境的影响及应对措施 灭火原理与方法 | 单选题 |
| 4 | 0.65 | 金属材料和非金属材料 常见化肥的种类及性质 糖类的组成与作用 常见物品质材的辨别 | 单选题 |
| 5 | 0.65 | 粗盐提纯 量筒的正确使用方法和注意事项 酒精灯的正确使用方法和注意事项 固体药品的取用 | 单选题 |
| 6 | 0.85 | 硬水的危害及软化方法 对人体健康危害的物质 羊毛、合成纤维、棉的鉴别 物质鉴别——选用试剂鉴别 | 单选题 |
| 7 | 0.65 | 根据化学式计算元素质量分数 化合价代数和的计算与应用 溶液酸碱性及pH相关关系 常见物质的溶解性 | 单选题 |
| 8 | 0.65 | 化学方程式的书写 制取二氧化碳的原理 二氧化碳不可燃、不支持燃烧性质 盐类参与的反应 | 单选题 |
| 9 | 0.65 | 测定空气中氧气的含量实验的过程 氢气的检验和验纯 浓硫酸的稀释 蒸发 | 单选题 |
| 10 | 0.65 | 质量守恒定律的微观解释 微粒图像的分析及应用 化合价代数和的计算与应用 | 单选题 |
| 11 | 0.65 | 分解反应 根据方程式推测化学式 单质和化合物的判断 常见元素、原子团的化合价 | 单选题 |
| 12 | 0.85 | 碳酸氢钠、碳酸钠、碳酸钙 物质的加热 | 单选题 |
| 13 | 0.65 | 铁在氧气中燃烧及其实验 碱的通性 中和反应的概念及微观本质 盐类参与的反应 | 单选题 |
| 14 | 0.65 | 碳单质的可燃性 盐类参与的反应 铵根离子的验证 | 单选题 |
| 15 | 0.65 | 不含杂质的化学方程式计算 碱的通性 盐类参与的反应 | 单选题 |
| 16 | 0.65 | 离子中各类微粒间数值关系 饱和溶液和不饱和溶液的转换 葡萄糖、淀粉的检验 | 单选题 |
| 17 | 0.65 | 结晶分离混合物 固体溶解度曲线的应用 图像分析溶质质量分数的变化 | 单选题 |
| 18 | 0.4 | 溶液和化学方程式的综合计算 常见的酸碱指示剂及其变色情况 盐类参与的反应 | 单选题 |
| 20 | 0.15 | 有关质量守恒定律的计算 不含杂质的化学方程式计算 根据化学式计算元素质量比 酸的通性 | 单选题 |
| 二、多选题 | |||
| 19 | 0.4 | 溶质质量分数结合化学方程式的计算 碱的通性 溶液的酸碱性的判断与pH的测定 盐类参与的反应 | |
| 三、填空与简答 | |||
| 21 | 0.65 | 氧化物的定义 元素符号书写及含义 化学式书写及读法 某些元素的缺乏症 | 填空题 |
| 22 | 0.65 | 常见几种酸的用途 常见盐的俗名、用途 常见化肥的种类及性质 维生素的来源 | 填空题 |
| 24 | 0.65 | 化学方程式的书写 根据方程式推测化学式 固体溶解度的影响因素 碳酸氢钠、碳酸钠、碳酸钙 | 流程题 |
| 25 | 0.94 | 盐类参与的反应 常见酸碱盐的溶解性 过滤 几种常见阴、阳离子的鉴别 | 流程题 |
| 26 | 0.65 | 化学方程式的书写 空气各成分及其体积分数 中和反应的概念及微观本质 | 填空题 |
| 29 | 0.65 | 常见的酸碱指示剂及其变色情况 盐类参与的反应 设计实验探究物质的成分 | 推断题 |
| 四、实验题 | |||
| 23 | 0.85 | 实验探究质量守恒定律 化学方程式的书写 | |
| 27 | 0.65 | 过氧化氢制取氧气实验 制取二氧化碳的原理 浓硫酸做干燥剂 常见仪器及制材的辨认 | |
| 五、科学探究题 | |||
| 28 | 0.4 | 化学方程式的书写 碱的通性 盐类参与的反应 设计实验探究物质的成分 | |
| 六、综合应用题 | |||
| 30 | 0.15 | 用质量守恒定律确定物质组成 化学方程式的书写 金属的物理通性与用途 酸的通性 | |



