金属和金属材料与生产生活和社会发展的关系非常密切。
(1)生活中常用铁锅炒菜主要利用了铁的___________ 性;厨房中的铁锅容易生锈,其原因是铁与空气中的___________ 和水等发生了化学反应。
(2)经检测,世界上最大的青铜器“司母戊鼎”中含有铜、锡等金属,某同学为探究铜、锡与铁的金属活动性顺序,设计了如表所示实验(金属片均已打磨,且形状大小相同,试管中所用5%的稀盐酸体积相同)。
【实验记录与分析】
【查阅资料】锡元素(Sn)的常见化合价是+2价。根据实验现象推测实验三的试管中锡与盐酸发生反应的化学方程式__________________ 。
(3)向m克AgNO3、Cu(NO3)2、Fe(NO3)2的混合溶液中加入Zn粉,充分反应后,过滤所得溶液的质量仍为m克。则下列说法错误的是_________ (多选)。
A滤渣中一定有Ag、Cu、Fe
B滤液中一定没有AgNO3
C滤液中一定含有Zn(NO3)2、Fe(NO3)2
D该过程至少发生了三个化学反应
(1)生活中常用铁锅炒菜主要利用了铁的
(2)经检测,世界上最大的青铜器“司母戊鼎”中含有铜、锡等金属,某同学为探究铜、锡与铁的金属活动性顺序,设计了如表所示实验(金属片均已打磨,且形状大小相同,试管中所用5%的稀盐酸体积相同)。
【实验记录与分析】
| 实验一 | 实验二 | 实验三 | |
| 实验操作 | 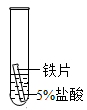 |  |  |
| 实验现象 | 立即产生气泡,速率较快 | 无明显现象 | 立即产生气泡,速率较慢 |
| 实验结论 | 铁、铜、锡的金属活动顺序由强到弱为 | ||
【查阅资料】锡元素(Sn)的常见化合价是+2价。根据实验现象推测实验三的试管中锡与盐酸发生反应的化学方程式
(3)向m克AgNO3、Cu(NO3)2、Fe(NO3)2的混合溶液中加入Zn粉,充分反应后,过滤所得溶液的质量仍为m克。则下列说法错误的是
A滤渣中一定有Ag、Cu、Fe
B滤液中一定没有AgNO3
C滤液中一定含有Zn(NO3)2、Fe(NO3)2
D该过程至少发生了三个化学反应
2020·西藏·中考真题 查看更多[4]
西藏2020年中考化学试题(已下线)8.3.2 金属资源的保护-2020-2021学年九年级化学下册同步基础知识速练(人教版)(已下线)实验活动4 金属的物理性质和某些化学性质-2020-2021学年九年级化学下册同步基础知识速练(人教版)(已下线)专题11 金属及金属材料- 决胜2023年中考化学一轮地毯式复习(全国通用)
更新时间:2020/09/10 02:01:31
|
相似题推荐
科学探究题
|
适中
(0.65)
解题方法
【推荐1】铜及其化合物有广泛的应用。
Ⅰ.铜的获得和应用
(1)西汉时期《淮南万毕术》中有“曾青得铁则化为铜”的记载,其中蕴含化学反应的类型是_______ 。
(2)我国古代制黄铜的原理如图1。
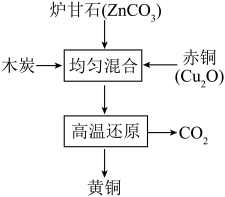
图1
①黄铜的硬度比铜和锌都_______ (选填“大”或“小”)。
②木炭还原Cu2O的化学方程式为_______ 。
(3)铜可用于制导线,主要利用了铜的_______ 性。
(4)CuSO4可配制波尔多液等。向铜粉中加入稀H2SO4,通入O2并加热可得到CuSO4溶液,反应的化学方程式为_______ 。
Ⅱ.实验及产物组成测定
如图2为某小组同学所做的实验及现象。
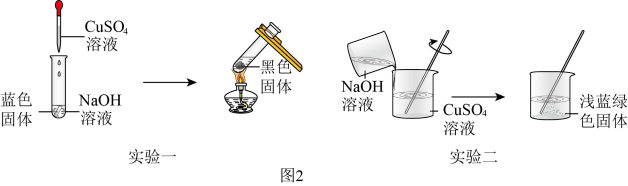
资料:①NaOH和CuSO4溶液混合可生成Cu(OH)2、Cux(OH)y(SO4)z(铜为+2价)等多种产物。
②68℃时,Cu(OH)2发生分解:300℃左右,Cux(OH)y(SO4)z发生分解,生成铜的氧化物和气体。
(一)实验一中蓝色固体为Cu(OH)2,则黑色固体是_______ 。
(二)将实验二反应后的物质过滤、洗涤、低温干燥得浅蓝绿色固体样品。小组同学称取27.6g样品,在老师的指导下进行下列实验。
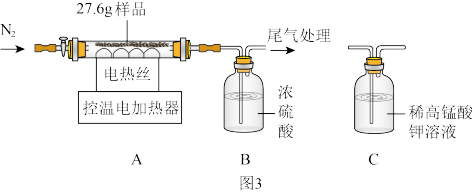
(1)装配好装置后,实验前先要_______ 。
(2)控制温度为68℃,对样品进行热分解,至固体质量不再减少,再通一段时间N2.冷却后测得装置B增重1.8g。则样品中含Cu(OH)2和Cux(OH)y(SO4)z。
①再通一段时间N2的目的是_______ 。
②27.6g样品中Cu(OH)2的质量为_______ g。
(3)取出装置A中加热后的剩余固体,溶于适量稀盐酸后,再向溶液中加入过量BaCl2溶液,得11.65g沉淀;继续加入过量NaOH溶液,沉淀质量增加了24.5g,则Cux(OH)y(SO4)z中,x:y:z=_______ 。
Ⅲ.样品的热重分析
另取27.6g样品,利用图3装置控制温度由低到高加热分解,测得A中剩余固体质量与加热时间的关系如图4。
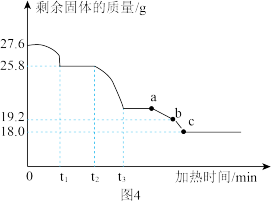
(1)t1~t2段固体质量未发生变化的原因是_______ 。
(2)用装置C替代装置B,t2~t3段观察到C中溶液褪色,说明样品加热分解时生成了_______ 。
(3)a点为黑色固体。b点固体中铜、氧元素质量比为_______ 。
(4)写出a~c段发生反应的化学方程式:_______ 。
Ⅰ.铜的获得和应用
(1)西汉时期《淮南万毕术》中有“曾青得铁则化为铜”的记载,其中蕴含化学反应的类型是
(2)我国古代制黄铜的原理如图1。

图1
①黄铜的硬度比铜和锌都
②木炭还原Cu2O的化学方程式为
(3)铜可用于制导线,主要利用了铜的
(4)CuSO4可配制波尔多液等。向铜粉中加入稀H2SO4,通入O2并加热可得到CuSO4溶液,反应的化学方程式为
Ⅱ.实验及产物组成测定
如图2为某小组同学所做的实验及现象。

资料:①NaOH和CuSO4溶液混合可生成Cu(OH)2、Cux(OH)y(SO4)z(铜为+2价)等多种产物。
②68℃时,Cu(OH)2发生分解:300℃左右,Cux(OH)y(SO4)z发生分解,生成铜的氧化物和气体。
(一)实验一中蓝色固体为Cu(OH)2,则黑色固体是
(二)将实验二反应后的物质过滤、洗涤、低温干燥得浅蓝绿色固体样品。小组同学称取27.6g样品,在老师的指导下进行下列实验。

(1)装配好装置后,实验前先要
(2)控制温度为68℃,对样品进行热分解,至固体质量不再减少,再通一段时间N2.冷却后测得装置B增重1.8g。则样品中含Cu(OH)2和Cux(OH)y(SO4)z。
①再通一段时间N2的目的是
②27.6g样品中Cu(OH)2的质量为
(3)取出装置A中加热后的剩余固体,溶于适量稀盐酸后,再向溶液中加入过量BaCl2溶液,得11.65g沉淀;继续加入过量NaOH溶液,沉淀质量增加了24.5g,则Cux(OH)y(SO4)z中,x:y:z=
Ⅲ.样品的热重分析
另取27.6g样品,利用图3装置控制温度由低到高加热分解,测得A中剩余固体质量与加热时间的关系如图4。

(1)t1~t2段固体质量未发生变化的原因是
(2)用装置C替代装置B,t2~t3段观察到C中溶液褪色,说明样品加热分解时生成了
(3)a点为黑色固体。b点固体中铜、氧元素质量比为
(4)写出a~c段发生反应的化学方程式:
您最近一年使用:0次
科学探究题
|
适中
(0.65)
解题方法
【推荐2】化学实验是认识物质的重要途径。
(1)验证金属的物理性质
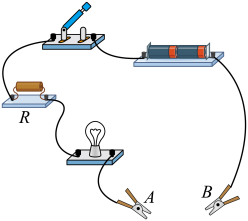
①用锤头反复敲打铝片、铁片、铜片,发现金属片_______ ,说明金属具有延展性。
②如图所示,将铝丝、铁丝、铜丝分别接入A、B端口,闭合开关,看到小灯泡均发光。说明以上金属具有_______ 。
(2)探究金属的活动性顺序。
某研究小组为探究铁、铜、铝的金属活动性顺序,进行了如下三个实验(其中金属均已打磨,且形状、大小相同,试管中所用5%的盐酸体积相同)。
【实验记录与分析】
【实验反思与拓展】
①三种金属加入盐酸前都用砂纸将表面打磨,目的是_______ ,实验三发生反应的化学方程式为_______ 。
②某酸雨多发地区,欲铸一座金属雕像,应选用Fe、Cu、Al三种金属中的_______ 为原材料更合适。
③探究上述三种金属的活动性,除采用金属与酸溶液反应的方法外,还可选用的方法是_______ (写出你所用方法中所用药品)。
④实验中,如果所用金属形状、大小不同,是否一定能得出正确的结论?_______ (选填“是”或“否),理由是_______ 。
⑤根据“性质决定用途”的思路,用“一”进行连线_______ 。


(1)验证金属的物理性质
①用锤头反复敲打铝片、铁片、铜片,发现金属片
②如图所示,将铝丝、铁丝、铜丝分别接入A、B端口,闭合开关,看到小灯泡均发光。说明以上金属具有
(2)探究金属的活动性顺序。
某研究小组为探究铁、铜、铝的金属活动性顺序,进行了如下三个实验(其中金属均已打磨,且形状、大小相同,试管中所用5%的盐酸体积相同)。
【实验记录与分析】
| 实验一 | 实验二 | 实验三 | |
| 实验操作 | 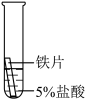 | 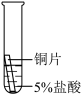 | 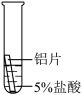 |
| 实验现象 | 立即产生气泡,速率较慢 | 无明显现象 | 立即产生气泡,速率较快 |
| 实验结论 | 铁、铜、铝的金属活动性由强到弱的顺序为 | ||
①三种金属加入盐酸前都用砂纸将表面打磨,目的是
②某酸雨多发地区,欲铸一座金属雕像,应选用Fe、Cu、Al三种金属中的
③探究上述三种金属的活动性,除采用金属与酸溶液反应的方法外,还可选用的方法是
④实验中,如果所用金属形状、大小不同,是否一定能得出正确的结论?
⑤根据“性质决定用途”的思路,用“一”进行连线

您最近一年使用:0次
科学探究题
|
适中
(0.65)
解题方法
【推荐3】某研究性学习小组学完金属的冶炼后,以“铁的冶炼”为主题展开项目式学习。
【任务一】铁的冶炼实验
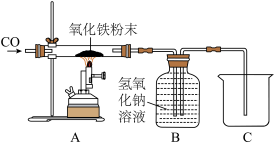
【实验分析】
(1)实验开始和结束时,均需通一会CO,实验开始时先通入CO的目的是______ 。
(2)B装置的作用是______ 。
(3)实验时可观察到硬质玻璃管内固体由______ 色变为黑色。
实验后老师指出,CO与Fe2O3在不同温度下反应时,Fe2O3因失氧程度不同会生成其他铁的氧化物或铁单质。于是同学们对实验后A装置硬质玻璃管内的黑色固体的成分产生好奇,于是开展如下任务二。
(4)【任务二】探究硬质玻璃管内黑色固体的成分
【提出问题】该黑色固体的成分是什么?
【查阅资料】铁的氧化物有Fe2O3、Fe3O4、FeO三种,其中FeO、Fe3O4均为不溶于水的黑色固体;其中Fe3O4具有磁性,可以被磁铁吸引,FeO无磁性,不能被磁铁吸引。
【作出猜想】该黑色固体含有Fe3O4、FeO、Fe中的一种或多种。
【设计实验】
步骤②中发生反应的化学方程式为______ 。
【拓展延伸】(结合极值法探究物质组成)某同学改变温度后再次进行上述实验,加热一段时间后取反应后的固体粉末,使用仪器测得粉末中铁元素和氧元素的质量比为5:2,据此推断其组成可能是______ (填字母)。
A.FeO B.Fe3O4、Fe2O3 C.FeO、Fe3O4 D.Fe、FeO
【任务一】铁的冶炼实验

【实验分析】
(1)实验开始和结束时,均需通一会CO,实验开始时先通入CO的目的是
(2)B装置的作用是
(3)实验时可观察到硬质玻璃管内固体由
实验后老师指出,CO与Fe2O3在不同温度下反应时,Fe2O3因失氧程度不同会生成其他铁的氧化物或铁单质。于是同学们对实验后A装置硬质玻璃管内的黑色固体的成分产生好奇,于是开展如下任务二。
(4)【任务二】探究硬质玻璃管内黑色固体的成分
【提出问题】该黑色固体的成分是什么?
【查阅资料】铁的氧化物有Fe2O3、Fe3O4、FeO三种,其中FeO、Fe3O4均为不溶于水的黑色固体;其中Fe3O4具有磁性,可以被磁铁吸引,FeO无磁性,不能被磁铁吸引。
【作出猜想】该黑色固体含有Fe3O4、FeO、Fe中的一种或多种。
【设计实验】
| 实验步骤 | 实验操作 | 实验现象 | 实验结论 |
| ① | 取实验所得黑色固体于白纸上, 用磁铁置于固体上方 | 样品中含有 Fe、Fe3O4、FeO | |
| ② | 将①中磁铁吸引的黑色固体放入试管中, 加入足量 应后倒去上层清液 | 有红色固体生成,充分反 应后,仍有黑色固体剩余 |
【拓展延伸】(结合极值法探究物质组成)某同学改变温度后再次进行上述实验,加热一段时间后取反应后的固体粉末,使用仪器测得粉末中铁元素和氧元素的质量比为5:2,据此推断其组成可能是
A.FeO B.Fe3O4、Fe2O3 C.FeO、Fe3O4 D.Fe、FeO
您最近一年使用:0次
科学探究题
|
适中
(0.65)
名校
解题方法
【推荐1】铁、铝、铜是常见的三种金属。同学们发现生活中的铝和铜制品表面一般不用防锈,而铁制品一般需要做防锈处理。
【提出问题】这是不是因为铁、铝、铜三种金属中铁的活动性最强呢?
【实验探究】同学们对这三种金属的活动性顺序展开了探究,请你参与探究并填写空格。
将粗细相同的铁丝、铝丝、铜丝分别插入体积相同、溶质质量分数也相同的稀盐酸中:
__________________
【讨论交流】为什么同一个实验得出了两种结论呢?同学们带着这个疑问查阅了相关资料,明白了铝丝在稀盐酸中短时间内无气泡,是因为铝表面致密的氧化膜会先与盐酸反应。
【反思评价】做金属性质实验时需将金属进行打磨,打磨的目的是____________ , 铁与盐酸反应的方程式是___________________ 。
【实验验证】为了进一步确认铁、铝、铜这三种金属的活动性顺序,同学们又将两根粗细相同的、 打磨过的铁丝分别插入硫酸铝溶液、硫酸铜溶液中:
写出铁与硫酸铜溶液反应的化学方程式__________________________ 。
【拓展迁移】若只有一支盛有少量稀盐酸的试管,只需合理安排金属丝的插入顺序(能与盐酸反应的要一次将盐酸消耗完),也能证明铁、铝、铜这三种金属的活动性顺序。金属丝的插入顺序为_______________________________ 。
【提出问题】这是不是因为铁、铝、铜三种金属中铁的活动性最强呢?
【实验探究】同学们对这三种金属的活动性顺序展开了探究,请你参与探究并填写空格。
将粗细相同的铁丝、铝丝、铜丝分别插入体积相同、溶质质量分数也相同的稀盐酸中:
| 操作 |  | 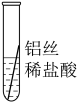 | 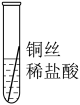 | 根据现象得出金属活动性顺序 |
| 片刻后现象 | 有少量气泡 | 无气泡 | 无气泡 | Fe>Al,Fe>Cu |
| 几分钟后现象 | 有少量气泡 | 有大量气泡 | 无气泡 | _________ |
【讨论交流】为什么同一个实验得出了两种结论呢?同学们带着这个疑问查阅了相关资料,明白了铝丝在稀盐酸中短时间内无气泡,是因为铝表面致密的氧化膜会先与盐酸反应。
【反思评价】做金属性质实验时需将金属进行打磨,打磨的目的是
【实验验证】为了进一步确认铁、铝、铜这三种金属的活动性顺序,同学们又将两根粗细相同的、 打磨过的铁丝分别插入硫酸铝溶液、硫酸铜溶液中:
| 操作 | 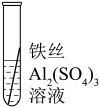 |  | 根据现象得出金属活动性顺序 |
| 现象 | 无明显现象 | Al>Fe>Cu |
【拓展迁移】若只有一支盛有少量稀盐酸的试管,只需合理安排金属丝的插入顺序(能与盐酸反应的要一次将盐酸消耗完),也能证明铁、铝、铜这三种金属的活动性顺序。金属丝的插入顺序为
您最近一年使用:0次
科学探究题
|
适中
(0.65)
解题方法
【推荐2】学习完金属的化学性质,同学们来到实验室进行锌、铜、银三种金属活动性顺序的探究活动。实验桌上老师提供的药品有:锌片、铜片、银片、硫酸锌溶液、硫酸铜溶液、硝酸银溶液和稀硫酸。
【制定计划】在老师的指导下,经过讨论,同学们设计出了以下几种实验方案:
方案一:铜片、锌片、银片、稀硫酸;
方案二:锌片、银片、硫酸铜溶液;
方案三:锌片、铜片、硫酸铜溶液、硝酸银溶液。
【分析与讨论】(1)有同学认为方案一不可行,原因是_____ 。
(2)方案二中涉及反应的化学方程式为_____ 。
【进行实验】小华同学选用方案三进行如下探究请你帮他完成表格中的空白。
【反思与评价】探究活动结束后,同学们分享自己的收获与不足,并进行反思:
(5)有同学提出,小华的实验中不用硫酸铜溶液也能得到相同的实验结论,简要说明其验证方法_____ 。
【拓展与延伸】(6)好奇地小华在老师的指导下,把一定量的锌粒加入硫酸铜和硝酸银的混合溶液中,充分反应后,过滤,发现滤液呈无色。此时,滤渣中一定含有的物质是_____ (填物质名称)。
【制定计划】在老师的指导下,经过讨论,同学们设计出了以下几种实验方案:
方案一:铜片、锌片、银片、稀硫酸;
方案二:锌片、银片、硫酸铜溶液;
方案三:锌片、铜片、硫酸铜溶液、硝酸银溶液。
【分析与讨论】(1)有同学认为方案一不可行,原因是
(2)方案二中涉及反应的化学方程式为
【进行实验】小华同学选用方案三进行如下探究请你帮他完成表格中的空白。
| 实验一 | 实验二 | |
| 实验操作 | 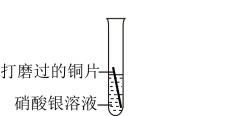 | 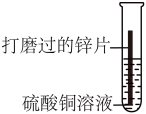 |
| 实验现象 | (3) | 锌片表面有红色物质析出,溶液由蓝色变为无色 |
| 实验结论 | (4)小华得出三种金属活动性由强到弱的顺序为 | |
(5)有同学提出,小华的实验中不用硫酸铜溶液也能得到相同的实验结论,简要说明其验证方法
【拓展与延伸】(6)好奇地小华在老师的指导下,把一定量的锌粒加入硫酸铜和硝酸银的混合溶液中,充分反应后,过滤,发现滤液呈无色。此时,滤渣中一定含有的物质是
您最近一年使用:0次
【推荐3】某实验小组同学利用老师提供的试剂:锌片、铜片、硫酸铜溶液、硝酸银溶液探究锌、铜、银三种金属的活动性顺序,请你参与他们的实验探究。
【实验目的】探究锌、铜、银三种金属活动性顺序。
【进行实验】请你帮他完成表格。
【实验结论】据上述实验,小明得出三种金属活动性顺序是________ 。
【反思与评价】实验②反应的化学方程式为_______ 。探究金属活动性顺序时,除了上述实验中已经用到的方法外,还可以根据______ 进行判断(任写一种)。
【实验目的】探究锌、铜、银三种金属活动性顺序。
【进行实验】请你帮他完成表格。
| 实验操作 | 实验现象 | 分析与结论 |
①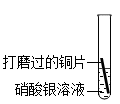 | 金属活动性:Cu>Ag,反应的化学方程式为 | |
②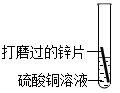 | 有红色固体析出,溶液由蓝色逐渐变为无色 | 金属活动性:Zn>Cu |
【反思与评价】实验②反应的化学方程式为
您最近一年使用:0次
科学探究题
|
适中
(0.65)
名校
解题方法
【推荐1】某兴趣小组对铁生锈的影响因素进行探究。
实验1:探究铁生锈的条件
【进行实验】
如图所示,取三根洁净无锈的铁钉,分别放置在三个不同环境中,一周后观察铁钉生锈情况并记录如下。
【解释与结论】
(1)对比实验_______ (填序号),可以得出铁生锈与水有关。
(2)由上述实验可知,铁生锈的条件是_______ 。
实验2:探究NaCl溶液的浓度对铁生锈速率的影响
【进行实验】
室温下,取大小、形状相同的光亮铁丝,用下图装置完成实验并记录如下。
【解释与结论】
(3)导管内液面上升的原因是_______ 。
(4)a=_______ 。
(5)依据实验①~④,可以得出的结论是_______ 。
【反思与评价】
(6)小组同学重复实验⑤,得到以下数据:
则原实验⑤失败的可能原因是_______ 。
(7)综合上述实验结果,铁制品的防护需尽量避免与水、氧气、_______ 接触。
实验1:探究铁生锈的条件
【进行实验】
如图所示,取三根洁净无锈的铁钉,分别放置在三个不同环境中,一周后观察铁钉生锈情况并记录如下。
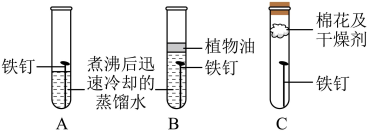
| 实验 | A | B | C |
| 现象 | 在液面附近,铁钉生锈严重 | 铁钉无明显变化 | 铁钉无明显变化 |
(1)对比实验
(2)由上述实验可知,铁生锈的条件是
实验2:探究NaCl溶液的浓度对铁生锈速率的影响
【进行实验】
室温下,取大小、形状相同的光亮铁丝,用下图装置完成实验并记录如下。
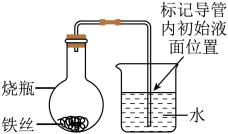
| 实验 编号 | 烧瓶内液体(用于浸润铁丝)用量 | 放置不同时间,导管内液面上升高度(cm) | ||
| 1小时 | 2小时 | 3小时 | ||
| ① | 2.0mL蒸馏水 | 0.1 | 0.7 | 3.2 |
| ② | 1.5mL蒸馏水+0.5mL10%NaCl溶液 | 0.3 | 1.5 | 5.0 |
| ③ | 1.0mL蒸馏水+amL10%NaCl溶液 | 0.8 | 3.3 | 7.9 |
| ④ | 0.5mL蒸馏水+1.5mL10%NaCl溶液 | 1.1 | 4.7 | 9.1 |
| ⑤ | 2mL10%NaCl溶液 | 0 | 0 | 0 |
(3)导管内液面上升的原因是
(4)a=
(5)依据实验①~④,可以得出的结论是
【反思与评价】
(6)小组同学重复实验⑤,得到以下数据:
| 烧瓶内液体(用于浸润铁丝)用量 | 放置不同时间,导管内液面上升高度(cm) | ||
| 1小时 | 2小时 | 3小时 | |
| 2mL10%NaCl溶液 | 1.4 | 5.7 | 10.0 |
(7)综合上述实验结果,铁制品的防护需尽量避免与水、氧气、
您最近一年使用:0次
【推荐2】金属的锈蚀与保护是初中化学的核心知识,某兴趣小组关于铜锈蚀和铁除锈、冶炼等进行如下实验探究。
【任务一】铜的锈蚀
某同学设计实验探究铜锈蚀产生铜绿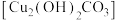 的条件(如图所示)。一段时间后,在A和B、D中没有观察到明显现象,C中铜片表面有铜绿。
的条件(如图所示)。一段时间后,在A和B、D中没有观察到明显现象,C中铜片表面有铜绿。
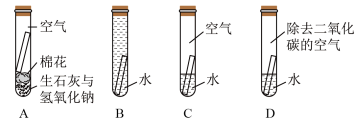
(1)实验中用的蒸馏水事先煮沸再冷却,目的是_____ 。
(2)A中生石灰与氢氧化钠的作用是_____ 。
(3)A、B、D与C对比,说明铜片锈蚀需要的物质是_____ 。
【任务二】铁的除锈
(4)写出一条生活中常见防止铁生锈的方法:_____ 。
(5)写出用稀盐酸除铁锈的化学方程式:_____ 。
(6)工业上用 还原
还原 。如图是48g氧化铁与过量的
。如图是48g氧化铁与过量的 反应,在不同温度下所得固体的质量和固体成分的图象。请回答问题。
反应,在不同温度下所得固体的质量和固体成分的图象。请回答问题。
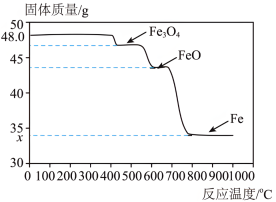
①获得铁的温度应不低于_____ ℃。(选填“400”“600”或“800”)
②图中
_____ 。
③为防止生成的铁在高温下氧化,可以进行的操作是_____ 。
【任务一】铜的锈蚀
某同学设计实验探究铜锈蚀产生铜绿
 的条件(如图所示)。一段时间后,在A和B、D中没有观察到明显现象,C中铜片表面有铜绿。
的条件(如图所示)。一段时间后,在A和B、D中没有观察到明显现象,C中铜片表面有铜绿。
(1)实验中用的蒸馏水事先煮沸再冷却,目的是
(2)A中生石灰与氢氧化钠的作用是
(3)A、B、D与C对比,说明铜片锈蚀需要的物质是
【任务二】铁的除锈
(4)写出一条生活中常见防止铁生锈的方法:
(5)写出用稀盐酸除铁锈的化学方程式:
(6)工业上用
 还原
还原 。如图是48g氧化铁与过量的
。如图是48g氧化铁与过量的 反应,在不同温度下所得固体的质量和固体成分的图象。请回答问题。
反应,在不同温度下所得固体的质量和固体成分的图象。请回答问题。
①获得铁的温度应不低于
②图中

③为防止生成的铁在高温下氧化,可以进行的操作是
您最近一年使用:0次
科学探究题
|
适中
(0.65)
解题方法
【推荐3】实验小组的同学发现从超市购买的月饼盒中有一个小纸袋,上面写着“脱氧剂,主要成分:碳粉、铁粉”。他们对纸袋中的固体产生了兴趣,进行了以下探究。
【提出问题】该固体是否变质了呢?变质后的物质是什么?
【猜想与假设】猜想①:固体没有变质,有C、Fe猜想②:固体部分变质,有_______ 猜想③:体全部变质,有C、Fe2O3
【实验探究】小明设计实验方案并进行了如下实验:
【提出质疑】小红通过查找资料得知Fe+2FeCl3=3FeCl2,认为小明得出“猜想①正确”的结论不严密,粉末中还可能含有Fe2O3,为了探究是否含有Fe2O3,小红先用物理方法除去了铁粉,她的方法是_____ ,然后进行了如下实验:
【得出结论】小红同学经过实验探究确定了该固体的成分。
【交流与讨论】经过讨论后,大家一致认为:“脱氧剂”除了有脱氧作用以外,还有_____ 作用。
【反思与评价】“脱氧剂”是利用铁生锈原理制成的,它对食品防腐起着重要的作用。但生活中的铁制品因生锈会造成大量的浪费,请你写出一条防止铁制品生锈的方法:____________ 。
【提出问题】该固体是否变质了呢?变质后的物质是什么?
【猜想与假设】猜想①:固体没有变质,有C、Fe猜想②:固体部分变质,有
【实验探究】小明设计实验方案并进行了如下实验:
| 实验步骤 | 实验现象 | 实验结论 |
| 取固体粉末置于试管中,向试管中加入一定量的稀盐酸 | 有气泡产生,上层清液为浅绿色;有黑色固体剩余 | 猜想③不正确。猜想①正确,写出有气泡产生的化学方程式 |
【提出质疑】小红通过查找资料得知Fe+2FeCl3=3FeCl2,认为小明得出“猜想①正确”的结论不严密,粉末中还可能含有Fe2O3,为了探究是否含有Fe2O3,小红先用物理方法除去了铁粉,她的方法是
| 实验步骤 | 实验现象 | 实验结论 |
| 取除尽铁粉后的固体粉末置于试管中,向试管中加入足量的稀盐酸,振荡,静置 | 猜想②正确,写出发生反应的化学方程式: |
【得出结论】小红同学经过实验探究确定了该固体的成分。
【交流与讨论】经过讨论后,大家一致认为:“脱氧剂”除了有脱氧作用以外,还有
【反思与评价】“脱氧剂”是利用铁生锈原理制成的,它对食品防腐起着重要的作用。但生活中的铁制品因生锈会造成大量的浪费,请你写出一条防止铁制品生锈的方法:
您最近一年使用:0次
科学探究题
|
适中
(0.65)
解题方法
【推荐1】世界上每年都有将近总产量十分之一的钢铁锈蚀,造成了巨大的经济损失。为探究铁锈蚀的原因,某校学习小组以铁的腐蚀为项目进行拓展探究:
[知识回顾]铁制品锈蚀的条件及观察到出现锈蚀的现象是___________ ;
[实验活动]小明同学设计实验方案并按如图装置进行实验,当铁丝足量,时间足够长后,除观察到铁丝表面出现红棕色,还能观察到的实验现象是_____________ ,其原因是_____________ ;
[拓展探究]小强同学取铁钉用砂纸打磨,称其质量,按下图装置进行实验,放置3天,再取出铁钉称量。在不同温度下重复实验,得到铁钉质量增加情况如下表:
[提出质疑]有同学认为小强的实验未能真实反映50℃以后铁钉腐蚀的快慢,理由是50℃以后铁钉质量没有变化。请分析铁钉质量没有变化的原因是______________ ,请改进实验方案证明你的分析_____________ ;
[反思交流]请你写出一条生活中防止铁制品锈蚀的有效措施:___________ 。
[知识回顾]铁制品锈蚀的条件及观察到出现锈蚀的现象是
[实验活动]小明同学设计实验方案并按如图装置进行实验,当铁丝足量,时间足够长后,除观察到铁丝表面出现红棕色,还能观察到的实验现象是
[拓展探究]小强同学取铁钉用砂纸打磨,称其质量,按下图装置进行实验,放置3天,再取出铁钉称量。在不同温度下重复实验,得到铁钉质量增加情况如下表:
 | 温度/℃ | 10 | 20 | 30 | 40 | 50 | 60 | 70 |
| 铁钉质量增加/g | 0.02 | 0.04 | 0.08 | 0.16 | 0.18 | 0.18 | 0.18 | |
| 解释与结论:小强同学的实验是探究 | ||||||||
[反思交流]请你写出一条生活中防止铁制品锈蚀的有效措施:
您最近一年使用:0次
【推荐2】钢丝棉是一种由低碳钢制成的细丝,直径约0.125-0.189毫米。小科利用钢丝棉探究铁制品锈蚀的条件,实验如下:
【资料】①干燥剂可以吸收空气中的水蒸气
②一定条件下,碳和氯化钠都可加快铁的锈蚀,但两者一般不参加反应。
【实验步骤】
步骤一:取3个50mL活塞润滑性良好的注射器,检查气密性后备用,如图1所示。
步骤三:移动活塞,使它们均处于46mL刻度处,再用橡皮帽封住注射孔(如图所示)。
步骤四:每隔一定时间,观察到的实验现象如表。
(1)检查注射器气密性:先用橡皮帽封住注射孔,用手向外拉动活塞,放手后观察到__________________ ,则气密性良好。
(2)甲、乙说明铁生锈与________ 有关,比较乙、丙实验现象得到的论:_______ 。乙、丙中锈斑是红棕色的固体物质,该物质的化学式是:____ 。
(3)钢铁生锈还需要氧气,请你利用本实验数据计算出空气中氧气的体积分数为________ 。
(4)铁锈蚀后应及时除锈的原因是__________ 。
【实验拓展】
(5)影响铁制品锈蚀快慢除上述因素外,你认为还有___ (写出1点即可),请设计实验方案___ 。
【资料】①干燥剂可以吸收空气中的水蒸气
②一定条件下,碳和氯化钠都可加快铁的锈蚀,但两者一般不参加反应。
【实验步骤】
步骤一:取3个50mL活塞润滑性良好的注射器,检查气密性后备用,如图1所示。
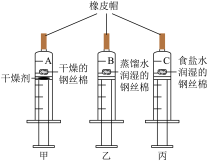
步骤三:移动活塞,使它们均处于46mL刻度处,再用橡皮帽封住注射孔(如图所示)。
步骤四:每隔一定时间,观察到的实验现象如表。
| 5分钟 | 20分钟 | 1小时 | 5小时 | |
| 甲 | 无现象 | 无现象 | 无现象 | 无现象 |
| 乙 | 出现少许锈斑,活塞未明显移动 | 出现明显锈斑,活塞移动少许 | 锈斑增多,活塞移动明显 | 锈蚀严重,活塞处于39mL刻度处 |
| 丙 | 出现明显锈斑,活塞移动少许 | 锈斑增多,活塞移动明显 | 锈斑严重,活塞处于39mL刻度处 | 锈蚀严重,活塞处于39mL刻度处 |
(2)甲、乙说明铁生锈与
(3)钢铁生锈还需要氧气,请你利用本实验数据计算出空气中氧气的体积分数为
(4)铁锈蚀后应及时除锈的原因是
【实验拓展】
(5)影响铁制品锈蚀快慢除上述因素外,你认为还有
您最近一年使用:0次
科学探究题
|
适中
(0.65)
【推荐3】人类文明与社会进步同金属材料密切相关。
(1)2018年12月29日,南京长江大桥恢复通车。为保证大桥的使用寿命,下列防锈措 施可行的是___ 。
A.用抗腐蚀性能优异的合金制造造桥零部件B.刷防锈漆
C.桥身表面镀一层黄金D.给某些部位涂油
(2)造桥需要钢铁,工业炼铁的原料有铁矿石、石灰石、___ 和热空气;钢铁材料分为生铁和钢,这两种铁合金的主要区别就在于 ___ 。
(3)将光亮镁条放入一定量的氯化铵溶液中,发现最终生成灰白色固体[Mgx(OH)yClz]外, 还有气体生成。某同学对该现象作如下探究。
(一)生成气体可能是 H2、HCl、NH3 中的一种或几种。
【查阅资料】
①浓硫酸既可以吸收水,也可吸收氨气;
②常温下,氨气和氯化氢气体反应生成白色固体氯化铵(NH4Cl);
③2NH3+3CuO 3Cu+N2+3H2O;
3Cu+N2+3H2O;
④H2+CuO Cu+H2O。
Cu+H2O。
【实验探究】收集气体,将气体通过如图装置(各步反应均完全);
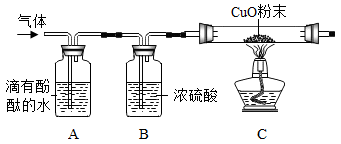
①A装置中出现红色,证明有___ ;
②A、B 实验装置___ (填“能”或“不能”)对调,理由是 ___ ;
③C 中玻璃管内观察到___ ,证明有H2。
【反思与评价】他认为不需要单独检验HCl,就能证明HCl不存在,请你评价这种说法是 否合理并说明理由___ 。
(二)过滤、洗涤、一定温度下烘干得灰白色固体。
【查阅资料】灰白色固体Mgx(OH)yClz 受热会分解,只生成MgO和HCl。
【实验探究】
取一定量灰白色固体样品,充分加热,得到4g白色固体和3.65g气体。
【结论】
①x : z=___ ;
②若所得灰白色固体的相对分子质量为153,则所得灰白色固体的化学式是___ 。
【反思与评价】
由同学认为,不属于任何数据,就可以求出x:z的值,请你说出理由___
(1)2018年12月29日,南京长江大桥恢复通车。为保证大桥的使用寿命,下列防锈措 施可行的是
A.用抗腐蚀性能优异的合金制造造桥零部件B.刷防锈漆
C.桥身表面镀一层黄金D.给某些部位涂油
(2)造桥需要钢铁,工业炼铁的原料有铁矿石、石灰石、
(3)将光亮镁条放入一定量的氯化铵溶液中,发现最终生成灰白色固体[Mgx(OH)yClz]外, 还有气体生成。某同学对该现象作如下探究。
(一)生成气体可能是 H2、HCl、NH3 中的一种或几种。
【查阅资料】
①浓硫酸既可以吸收水,也可吸收氨气;
②常温下,氨气和氯化氢气体反应生成白色固体氯化铵(NH4Cl);
③2NH3+3CuO
 3Cu+N2+3H2O;
3Cu+N2+3H2O;④H2+CuO
 Cu+H2O。
Cu+H2O。【实验探究】收集气体,将气体通过如图装置(各步反应均完全);

①A装置中出现红色,证明有
②A、B 实验装置
③C 中玻璃管内观察到
【反思与评价】他认为不需要单独检验HCl,就能证明HCl不存在,请你评价这种说法是 否合理并说明理由
(二)过滤、洗涤、一定温度下烘干得灰白色固体。
【查阅资料】灰白色固体Mgx(OH)yClz 受热会分解,只生成MgO和HCl。
【实验探究】
取一定量灰白色固体样品,充分加热,得到4g白色固体和3.65g气体。
【结论】
①x : z=
②若所得灰白色固体的相对分子质量为153,则所得灰白色固体的化学式是
【反思与评价】
由同学认为,不属于任何数据,就可以求出x:z的值,请你说出理由
您最近一年使用:0次



