定量研究既是化学的重要思想,也是研究化学变化的重要方法。“青附”学习小组走进实验室,从定量角度探究化学变化、应用化学知识。
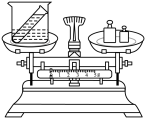
(1)“青附”学习小组想用如图装置探究质量守恒定律,请回答下列问题。
①确定研究对象:可以选择的化学反应是___________ 。(填字母)
A.盐酸和大理石反应,生成氯化钙、水和二氧化碳
B.氢氧化钠溶液和硫酸铜溶液反应,生成硫酸钠和氢氧化铜
②进行实验:反应前后天平指针不发生偏转。
③得出结论:参加化学反应的各物质的质量总和,等于反应后生成的各物质的质量总和。
④迁移应用:下列现象能用质量守恒定律解释的是___________ (填字母)。
A.镁条燃烧时,生成的白色粉末的质量大于镁条质量
B.氢气燃烧时,参加反应的氢气和氧气的体积大于生成水的体积
C.水结冰前后质量保持不变
⑤实质探究:质量守恒定律成立的微观原因是:___________ 。
(2)“青附”学习小组欲配制50g溶质质量分数为10%的氯化钠溶液,按如图所示步骤进行操作。

步聚①计算:需氯化钠___________ g,水___________ mL(室温时,水的密度约为1.0g/mL)
步骤②___________ (写步骤名称),调节天平平衡后称取所需的氯化钠固体时,发现托盘天平的指针偏左,此时应___________ (填字母)。
A.调节天平平衡螺母 B.增加适量氯化钠
C.增加砝码 D.减少适量氯化钠
步骤③溶解:用量筒量取所需的水,倒入盛有NaC1固体的烧杯中,用玻璃棒搅拌,搅拌的目的是___________ 。这样得到的溶液即是50g溶质质量分数为10%的NaC1溶液。
步骤④装瓶存放:配好的溶液在装入试剂瓶时不小心洒出少许,则其溶质质量分数___________ (填“变大”“变小”“不变”)。
(3)“青附”学习小组的同学分别继续按照下表的数据配制了A、B、C、D四组溶液,请分析并回答下列问题。
a.上述四组溶液属于饱和溶液的是___________ 。(填字母)
b.取等质量的氯化钠和硝酸钾固体各mg,按照如图进行实验。
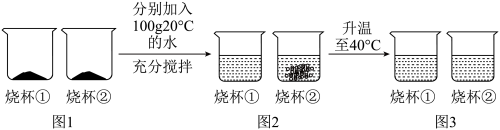
m的取值范围是___________ ,图1烧杯①中盛放的物质是___________ 。(填化学式)

(1)“青附”学习小组想用如图装置探究质量守恒定律,请回答下列问题。
①确定研究对象:可以选择的化学反应是
A.盐酸和大理石反应,生成氯化钙、水和二氧化碳
B.氢氧化钠溶液和硫酸铜溶液反应,生成硫酸钠和氢氧化铜
②进行实验:反应前后天平指针不发生偏转。
③得出结论:参加化学反应的各物质的质量总和,等于反应后生成的各物质的质量总和。
④迁移应用:下列现象能用质量守恒定律解释的是
A.镁条燃烧时,生成的白色粉末的质量大于镁条质量
B.氢气燃烧时,参加反应的氢气和氧气的体积大于生成水的体积
C.水结冰前后质量保持不变
⑤实质探究:质量守恒定律成立的微观原因是:
(2)“青附”学习小组欲配制50g溶质质量分数为10%的氯化钠溶液,按如图所示步骤进行操作。

步聚①计算:需氯化钠
步骤②
A.调节天平平衡螺母 B.增加适量氯化钠
C.增加砝码 D.减少适量氯化钠
步骤③溶解:用量筒量取所需的水,倒入盛有NaC1固体的烧杯中,用玻璃棒搅拌,搅拌的目的是
步骤④装瓶存放:配好的溶液在装入试剂瓶时不小心洒出少许,则其溶质质量分数
(3)“青附”学习小组的同学分别继续按照下表的数据配制了A、B、C、D四组溶液,请分析并回答下列问题。
| 序号 | 温度/℃ | 水的质量/g | 加入的固体及质量g | 所得溶液的质量/g |
| A | 20 | 50 | 硝酸钾20 | 65.8 |
| B | 40 | 100 | 硝酸钾65 | 163.9 |
| C | 20 | 100 | 氯化钠40 | 136.0 |
| D | 40 | 100 | 氯化钠40 | 136.6 |
b.取等质量的氯化钠和硝酸钾固体各mg,按照如图进行实验。

m的取值范围是
更新时间:2023-11-21 09:35:01
|
相似题推荐
综合应用题
|
适中
(0.65)
解题方法
【推荐1】请回答下列问题。
(一)用如图所示的 个实验验证质量守恒定律。
个实验验证质量守恒定律。
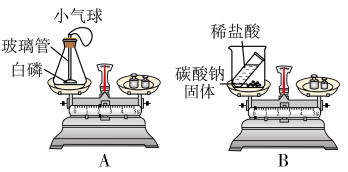
(1)图A所示实验:在实验前要在锥形瓶底部铺一层细沙,其作用是______ 。实验过程中,可看到气球的变化情况是 ______ 。
(2)在B实验中,实验前天平示数为102.2克,实验后天平示数为100克,该反应______ (填“遵循”、“不遵循”)质量守恒定律。
(二)现代生活中,人们越来越注重微量元素的摄取。碘元素对人体有着至关重要的作用。下图是某地市场销售的一种“加碘食盐”包装袋上的部分说明,请回答下列问题:

(3)碘酸钾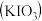 中碘元素、氧元素的质量比是
中碘元素、氧元素的质量比是________ 。
(4)计算一袋500g碘盐中含碘酸钾的质量是_________ mg (结果精确到0.1mg。)
(一)用如图所示的
 个实验验证质量守恒定律。
个实验验证质量守恒定律。
(1)图A所示实验:在实验前要在锥形瓶底部铺一层细沙,其作用是
(2)在B实验中,实验前天平示数为102.2克,实验后天平示数为100克,该反应
(二)现代生活中,人们越来越注重微量元素的摄取。碘元素对人体有着至关重要的作用。下图是某地市场销售的一种“加碘食盐”包装袋上的部分说明,请回答下列问题:

(3)碘酸钾
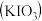 中碘元素、氧元素的质量比是
中碘元素、氧元素的质量比是(4)计算一袋500g碘盐中含碘酸钾的质量是
您最近一年使用:0次
综合应用题
|
适中
(0.65)
解题方法
【推荐2】(1)下列试剂:①氧化铜粉末、②石灰石块、③锌粒、④试剂瓶中的盐酸,要用药匙取用的是_____________ ,用滴管取用的是_____________ 。
(2)地壳中含量最多的元素是_____________ ,写出它组成的单质与磷反应的化学方程式是_____________ 。
(3)无数实验证明,参加化学反应的各物质的_____________ ,等于反应后生成的各物质的_____________ 。这个规律叫做质量守恒定律。
(4)工业上可利用“铝热反应”焊接钢轨,其原理是用铝将某些金属从其氧化物中置换出来,若用铝与四氧化三铁反应来制取50.4kg铁,理论上需要消耗铝的质量是多少?_____
(2)地壳中含量最多的元素是
(3)无数实验证明,参加化学反应的各物质的
(4)工业上可利用“铝热反应”焊接钢轨,其原理是用铝将某些金属从其氧化物中置换出来,若用铝与四氧化三铁反应来制取50.4kg铁,理论上需要消耗铝的质量是多少?
您最近一年使用:0次
综合应用题
|
适中
(0.65)
【推荐3】化学兴趣小组的同学利用如图所示的装置,对质量守恒定律进行探究。试回答下列问题。

(1)I.提出问题:白磷在空气中燃烧遵循质量守恒定律吗?
Ⅱ.设计实验:小明同学将一定质量的白磷放入装置内,称得A装置的总质量为208.3g。然后将红热的玻璃管伸入瓶内,并立即塞紧橡胶塞。
Ⅲ.观察现象:此时观察到锥形瓶内的现象是_________ ,装置冷却后,再次称得A装置的总质量为208.3g。
Ⅳ.总结:①该反应遵循质量守恒定律。
②在实验设计上,玻璃管上方系一个瘪气球的目的是____________ 。
③实验结束后(锥形瓶已冷却至室温),发现瓶中白磷过量,为防止白磷在空气中燃烧,将锥形瓶瓶口倒置于盛满水的水槽中,拔下瓶塞,发现水进入锥形瓶中,则进入瓶中的水约占锥形瓶容积的________ ,原因是________ 。
(2)小兵同学认为碳酸钠与稀盐酸反应(化学方程式为Na₂CO3+2HCl=2NaCl+H2O+CO2↑)也遵循质量守恒定律。于是他设计了B装置,药品及装置的总质量为308.5g,反应结束后,他与小明的实验进行对比:冷却至室温,气球胀大的是_______ (填“A”或“B”即或“A和B”);称量反应后药品及装置的总质量为308.3g,你认为小兵同学数据减少的原因可能是_____ (填字母)。
A 稀盐酸不足
B 碳酸钠中含有不与稀盐酸反应的杂质
C 装置气密性不好
D 气球受到浮力的影响
(3)小结:由质量守恒定律可,化学反应前后一定不变的是________ (填序号)。
①原子数目
②原子的种类
③分子数目
④分子的种类
⑤元素的种类
⑥物质的总质量
⑦物质的种类
(4)某登山运动员要登上最高峰一一珠程朗玛峰峰顶,需要自带氧气。假如每名运动员冲顶时消耗自带液氧4.8kg,若在实验室用高锰酸钾为原料制取相同质量的氧气,则需要高锰酸钾的质量为__________ 。

(1)I.提出问题:白磷在空气中燃烧遵循质量守恒定律吗?
Ⅱ.设计实验:小明同学将一定质量的白磷放入装置内,称得A装置的总质量为208.3g。然后将红热的玻璃管伸入瓶内,并立即塞紧橡胶塞。
Ⅲ.观察现象:此时观察到锥形瓶内的现象是
Ⅳ.总结:①该反应遵循质量守恒定律。
②在实验设计上,玻璃管上方系一个瘪气球的目的是
③实验结束后(锥形瓶已冷却至室温),发现瓶中白磷过量,为防止白磷在空气中燃烧,将锥形瓶瓶口倒置于盛满水的水槽中,拔下瓶塞,发现水进入锥形瓶中,则进入瓶中的水约占锥形瓶容积的
(2)小兵同学认为碳酸钠与稀盐酸反应(化学方程式为Na₂CO3+2HCl=2NaCl+H2O+CO2↑)也遵循质量守恒定律。于是他设计了B装置,药品及装置的总质量为308.5g,反应结束后,他与小明的实验进行对比:冷却至室温,气球胀大的是
A 稀盐酸不足
B 碳酸钠中含有不与稀盐酸反应的杂质
C 装置气密性不好
D 气球受到浮力的影响
(3)小结:由质量守恒定律可,化学反应前后一定不变的是
①原子数目
②原子的种类
③分子数目
④分子的种类
⑤元素的种类
⑥物质的总质量
⑦物质的种类
(4)某登山运动员要登上最高峰一一珠程朗玛峰峰顶,需要自带氧气。假如每名运动员冲顶时消耗自带液氧4.8kg,若在实验室用高锰酸钾为原料制取相同质量的氧气,则需要高锰酸钾的质量为
您最近一年使用:0次
综合应用题
|
适中
(0.65)
解题方法
【推荐1】海水中含有大量的氯化钠,从海水中得到的食盐,不仅是必不可少的生活用品,更是重要的化工原料。
(1)目前从海水中提取食盐的方法主要为“盐田法”,主要生产流程如下图所示:

①在蒸发池中促进水蒸发,主要是利用了______ 。(填选项序号之一)
A.太阳能 B.潮汐能 C.地热能 D.化学能
②上述流程中得到的卤水是该温度下氯化钠的______ 溶液(填“饱和”“不饱和”之一)。
②海水“晒盐”得到的粗盐,往往含有可溶性杂质和不溶性杂质(如泥沙)等,可以对其进行分离和提纯,得到精盐。
I、除去粗盐中不溶性杂质的步骤有:溶解、______ 、蒸发结晶。
Ⅱ、除去难溶性杂质后的食盐水中还含有MgCl2、CaCl2、Na2SO4等杂质,可向食盐水中加入下列三种过量试剂,将杂质转化为沉淀。所加试剂顺序依次可以是______ 。(填选项序号之一)
A.Na2CO3、NaOH、BaCl2
B.BaCl2、Na2CO3、NaOH
C.NaOH、Na2CO3、BaCl2
III、过滤去除沉淀后,再加入适量的盐酸,将溶液的pH调为______ (填数字),得到精盐水。
(2)用精盐水制得的纯碱(Na2CO3)样品中往往含有少量氯化钠。化学小组的同学取22g纯碱样品,将其全部放入一洁净的烧杯中,然后加100g水,搅拌,使固体完全溶解,配制成不饱和溶液。再向烧杯中逐滴加入溶质质量分数为10%的稀盐酸,反应过程中产生气体的质量与所滴入稀盐酸的质量关系曲线如下图所示,试回答:

①该纯碱样品中氯化钠的质量为______ g(计算结果精确至0.1g)。
②当滴入稀盐酸73g时(即图中A点),烧杯中溶液里存在的酸根阴离子是______ (填离子符号)。
③当滴入稀盐酸146g时(即图中B点)恰好完全反应,试通过计算,求此时所得不饱和溶液的质量______ (计算结果精确至0.1g)。
(1)目前从海水中提取食盐的方法主要为“盐田法”,主要生产流程如下图所示:

①在蒸发池中促进水蒸发,主要是利用了
A.太阳能 B.潮汐能 C.地热能 D.化学能
②上述流程中得到的卤水是该温度下氯化钠的
②海水“晒盐”得到的粗盐,往往含有可溶性杂质和不溶性杂质(如泥沙)等,可以对其进行分离和提纯,得到精盐。
I、除去粗盐中不溶性杂质的步骤有:溶解、
Ⅱ、除去难溶性杂质后的食盐水中还含有MgCl2、CaCl2、Na2SO4等杂质,可向食盐水中加入下列三种过量试剂,将杂质转化为沉淀。所加试剂顺序依次可以是
A.Na2CO3、NaOH、BaCl2
B.BaCl2、Na2CO3、NaOH
C.NaOH、Na2CO3、BaCl2
III、过滤去除沉淀后,再加入适量的盐酸,将溶液的pH调为
(2)用精盐水制得的纯碱(Na2CO3)样品中往往含有少量氯化钠。化学小组的同学取22g纯碱样品,将其全部放入一洁净的烧杯中,然后加100g水,搅拌,使固体完全溶解,配制成不饱和溶液。再向烧杯中逐滴加入溶质质量分数为10%的稀盐酸,反应过程中产生气体的质量与所滴入稀盐酸的质量关系曲线如下图所示,试回答:

①该纯碱样品中氯化钠的质量为
②当滴入稀盐酸73g时(即图中A点),烧杯中溶液里存在的酸根阴离子是
③当滴入稀盐酸146g时(即图中B点)恰好完全反应,试通过计算,求此时所得不饱和溶液的质量
您最近一年使用:0次
综合应用题
|
适中
(0.65)
【推荐2】某实验室欲配制一定溶质质量分数的 溶液,现实验室只有含少量
溶液,现实验室只有含少量 的
的 固体药品.
固体药品.
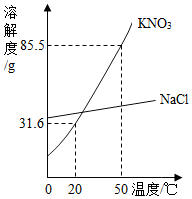
(1)如图所示为 和
和 的溶解度曲线,50℃时,将85.5g固体药品溶于100g水中,得到的是
的溶解度曲线,50℃时,将85.5g固体药品溶于100g水中,得到的是
______ 的溶液(填“饱和”或“不饱和”).
(2)将 提纯的方法是
提纯的方法是 ______ .
(3)小明用提纯后的 固体配制100g溶质质量分数为5%的
固体配制100g溶质质量分数为5%的 溶液,其操作步骤是:计算、
溶液,其操作步骤是:计算、 _____ 、量取、溶解.经检测,小明所配溶液中 溶质质量分数偏小,其原因可能是
溶质质量分数偏小,其原因可能是 ______ .
① 固体仍然不纯; ②溶解前,烧杯中有水;
固体仍然不纯; ②溶解前,烧杯中有水;
③量取水时,俯视读数; ④装瓶时,有少量溶液洒出.
(4)将所配制的硝酸钾溶液的溶质质量分数变为3%,需加入溶质质量分数为1%的硝酸钾溶液______ g。
 溶液,现实验室只有含少量
溶液,现实验室只有含少量 的
的 固体药品.
固体药品.
(1)如图所示为
 和
和 的溶解度曲线,50℃时,将85.5g固体药品溶于100g水中,得到的是
的溶解度曲线,50℃时,将85.5g固体药品溶于100g水中,得到的是
(2)将
 提纯的方法是
提纯的方法是 (3)小明用提纯后的
 固体配制100g溶质质量分数为5%的
固体配制100g溶质质量分数为5%的 溶液,其操作步骤是:计算、
溶液,其操作步骤是:计算、  溶质质量分数偏小,其原因可能是
溶质质量分数偏小,其原因可能是 ①
 固体仍然不纯; ②溶解前,烧杯中有水;
固体仍然不纯; ②溶解前,烧杯中有水;③量取水时,俯视读数; ④装瓶时,有少量溶液洒出.
(4)将所配制的硝酸钾溶液的溶质质量分数变为3%,需加入溶质质量分数为1%的硝酸钾溶液
您最近一年使用:0次
综合应用题
|
适中
(0.65)
真题
名校
【推荐3】工业上通过如下转化可制得KClO3晶体:

(1)完成I中反应的化学方程式:NaCl+3H2O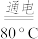 NaClO3+3
NaClO3+3________ ↑
(2)II中析出晶体后的母液是的KClO3的___________ (填“饱和”或“不饱和”)溶液。写出母液中所有溶质的化学式:_____________________________ 。
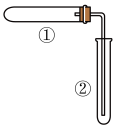
(3)用下图装轩置(夹持、加热装置已略去)进行实验,②中有现象,但该现象不能作为判断①中发生了化学反应的依据的是___________ 。

(1)完成I中反应的化学方程式:NaCl+3H2O
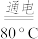 NaClO3+3
NaClO3+3(2)II中析出晶体后的母液是的KClO3的
(3)用下图装轩置(夹持、加热装置已略去)进行实验,②中有现象,但该现象不能作为判断①中发生了化学反应的依据的是

| 选项 | ①中实验 | ②中现象 |
| A | 加热氯酸钾和二氧化锰的混合物 | 伸入试管内的带火星的木条复燃 |
| B | 加热碱式碳酸铜固体 | 澄清石灰水变浑浊 |
| C | 加热铜丝 | 伸入水中导管口有气泡冒出 |
| D | 加热氯化铵和熟石灰的混合物 | 酚酞溶液变红 |
您最近一年使用:0次
【推荐1】Ⅰ、水、溶液与人类的生产生活关系紧密。
(1)过氧化氢溶液是生活中常用一种外用消毒液,俗称双氧水,其溶剂是______ 。
(2)水很难能除去衣服、餐具上的油污,但洗涤剂能除去,是因为其具有______ 功能。
Ⅱ、下图是利用海水提取粗盐的过程。

(3)图中①是______ (填“蒸发”或“冷却”)池。
(4)在①中,海水中氯化钠的质量分数逐渐______ (填“变小”或“不变”或“变大”)。
(5)母液为氯化钠的______ (填“饱和”或“不饱和”)溶液。
Ⅲ、如图是配制50g溶质质量分数为5%的NaCl溶液的操作示意图
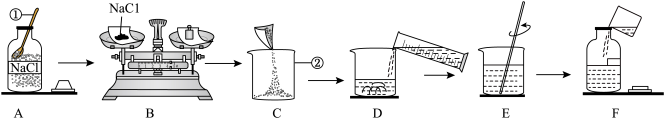
(6)A和F处瓶塞放置正确的是______ (填“A”或“F”):B处应称取氯化钠的质量是______ g;
(7)E处玻璃棒的作用是______ ;F处装瓶虽有液体洒落,但对试剂瓶中的溶液的浓度无影响,原因是______ ;
(8)将已配好的50g质量分数为5%的NaCl溶液变成质量分数为16%的NaCl溶液,用于选种实验。需要再加NaCl的质量是______ g(计算结果精确到0.1)。
(1)过氧化氢溶液是生活中常用一种外用消毒液,俗称双氧水,其溶剂是
(2)水很难能除去衣服、餐具上的油污,但洗涤剂能除去,是因为其具有
Ⅱ、下图是利用海水提取粗盐的过程。

(3)图中①是
(4)在①中,海水中氯化钠的质量分数逐渐
(5)母液为氯化钠的
Ⅲ、如图是配制50g溶质质量分数为5%的NaCl溶液的操作示意图

(6)A和F处瓶塞放置正确的是
(7)E处玻璃棒的作用是
(8)将已配好的50g质量分数为5%的NaCl溶液变成质量分数为16%的NaCl溶液,用于选种实验。需要再加NaCl的质量是
您最近一年使用:0次
综合应用题
|
适中
(0.65)
解题方法
【推荐2】海洋是人类千万年来取之不尽、用之不竭的巨大资源宝库,其中蕴藏着丰富的食盐资源。
(1)粗盐提纯。海水提取的粗盐中含有可溶性的CaCl2、MgCl2、Na2SO4等杂质,通过如下操作进行提纯:①加入Na2CO3溶液②加入NaOH溶液③加入BaCl2溶液④滴入稀盐酸至无气泡产生⑤过滤⑥溶解。正确的操作顺序是_______ (按顺序填标号,不得重复)。
(2)配制溶液。某同学在实验室配制50g15%的氯化钠溶液,过程如下图所示:_______ ml(水的密度为lg/ml)。
②下列做法会导致所配溶液溶质质量分数偏大的是_______ (填选项序号)。
A.氯化钠固体中有杂质 B.量取水时俯视读数 C.溶解时用玻璃棒不断搅拌
(3)现有NaCl和CaCl2的固体混合物50g,将其全部放入一洁净的烧杯中,然后加入足量蒸馏水,搅拌,固体物质完全溶解。再向烧杯中逐滴加入溶质质量分数为10.6%的Na2CO3溶液,滴入Na2CO3溶液的质量与生成沉淀的质量关系如图所示。试回答:_______ (写离子符号)。
②当滴入Na2CO3溶液的质量为100g时(即图中A点),恰好完全反应,通过计算求原固体混合物中NaCl的质量分数_______ (计算结果精确到0.1%)。
(1)粗盐提纯。海水提取的粗盐中含有可溶性的CaCl2、MgCl2、Na2SO4等杂质,通过如下操作进行提纯:①加入Na2CO3溶液②加入NaOH溶液③加入BaCl2溶液④滴入稀盐酸至无气泡产生⑤过滤⑥溶解。正确的操作顺序是
(2)配制溶液。某同学在实验室配制50g15%的氯化钠溶液,过程如下图所示:

②下列做法会导致所配溶液溶质质量分数偏大的是
A.氯化钠固体中有杂质 B.量取水时俯视读数 C.溶解时用玻璃棒不断搅拌
(3)现有NaCl和CaCl2的固体混合物50g,将其全部放入一洁净的烧杯中,然后加入足量蒸馏水,搅拌,固体物质完全溶解。再向烧杯中逐滴加入溶质质量分数为10.6%的Na2CO3溶液,滴入Na2CO3溶液的质量与生成沉淀的质量关系如图所示。试回答:
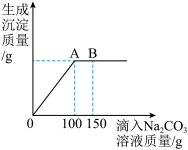
②当滴入Na2CO3溶液的质量为100g时(即图中A点),恰好完全反应,通过计算求原固体混合物中NaCl的质量分数
您最近一年使用:0次
【推荐3】 2024年7月,即将在青岛召开的国际水大会的主题是“水——生命之源,发展之基”。下列问题均围绕水展开,请你认真思考并回答问题。
(1)①如图是自来水厂的工艺流程图,自来水厂使用的净水方法有_______ 。(填选项序号之一)

①沉降②过滤③煮沸④蒸馏⑤灭菌
A.①②⑤B.①③④C.②③⑤ D.③④⑤
②二氧化氯常用于自来水消毒,其工业制取原理是: ,则X的化学式为
,则X的化学式为________ 。
(2)水是常用的溶剂,能够溶解很多物质形成溶液。小明同学想配制200g溶质质量分数为10%的氯化钠溶液,按如图所示步骤操作。

请填空:
①计算:需氯化钠________ g,水________ mL(室温时,水的密度约为1.0g/mL)
②称量:调节天平平衡后称量所需的氯化钠固体时,发现托盘天平的指针偏左,此时应________ 。(填选项序号之一)
A.调节天平平衡螺母B.增加适量氯化钠C.减少适量氯化钠
③溶解:用量筒量取所需的水,倒入盛有氯化钠的烧杯中,用玻璃棒搅拌。搅拌的目的________ 。
④装瓶贴标签。
⑤下列情况可能会导致溶质质量分数偏小的是________ (填选项序号之一)。
A.量取水时俯视读数
B.量筒中的水倒入烧杯中时,有部分残留
C.氯化钠不纯,含有难溶性杂质
D.取用已配制好的氯化钠溶液时,有少量溶液洒在瓶外
(3)2023年10月11日,我国首艘氢燃料电池动力示范船“三峡氢舟1”号在湖北宜昌完成首航,这标志着氢燃料电池技术在我国内河船舶应用实现零的突破。若通过电解水的方式获取氢气,通过化学方程式进行计算,电解7.2㎏水能产生多少氢气?(计算结果精确至0.1㎏)
(1)①如图是自来水厂的工艺流程图,自来水厂使用的净水方法有

①沉降②过滤③煮沸④蒸馏⑤灭菌
A.①②⑤B.①③④C.②③⑤ D.③④⑤
②二氧化氯常用于自来水消毒,其工业制取原理是:
 ,则X的化学式为
,则X的化学式为(2)水是常用的溶剂,能够溶解很多物质形成溶液。小明同学想配制200g溶质质量分数为10%的氯化钠溶液,按如图所示步骤操作。

请填空:
①计算:需氯化钠
②称量:调节天平平衡后称量所需的氯化钠固体时,发现托盘天平的指针偏左,此时应
A.调节天平平衡螺母B.增加适量氯化钠C.减少适量氯化钠
③溶解:用量筒量取所需的水,倒入盛有氯化钠的烧杯中,用玻璃棒搅拌。搅拌的目的
④装瓶贴标签。
⑤下列情况可能会导致溶质质量分数偏小的是
A.量取水时俯视读数
B.量筒中的水倒入烧杯中时,有部分残留
C.氯化钠不纯,含有难溶性杂质
D.取用已配制好的氯化钠溶液时,有少量溶液洒在瓶外
(3)2023年10月11日,我国首艘氢燃料电池动力示范船“三峡氢舟1”号在湖北宜昌完成首航,这标志着氢燃料电池技术在我国内河船舶应用实现零的突破。若通过电解水的方式获取氢气,通过化学方程式进行计算,电解7.2㎏水能产生多少氢气?(计算结果精确至0.1㎏)
您最近一年使用:0次
【推荐1】国以农为本,农以种为先。跨学科实践活动“选好种”开展如下:
已知:20℃时,盐水的密度与溶质质量分数的对照表如下:
Ⅰ.选种:水稻盐水选种所用的盐水密度为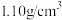 ,选种时将稻种加入配好的盐水中,静置一段时间后,用漏勺捞去浮于上层的劣种。
,选种时将稻种加入配好的盐水中,静置一段时间后,用漏勺捞去浮于上层的劣种。
(1)由表中信息可知,水稻选种时,需配制的盐水的溶质质量分数是___________ 。
(2)每个兴趣小组各配制50g上述盐水溶液,步骤如下:
①计算:配制上述溶液时,需氯化钠___________ g,水___________ mL。(水的密度是 )
)
②称量:称量需要的仪器有:托盘天平、药匙、量筒和___________ 。在称量氯化钠的过程中,发现托盘天平指针偏右,此时应___________ (填操作方法)直至平衡。量取水时选用的量筒的量程最合适的是___________ (填“25mL”、“50mL”或“100mL”)。
③溶解:溶解过程中,使用玻璃棒搅拌的目的是___________ 。
④存放:将配制好的溶液装入试剂瓶中,盖好瓶塞并贴上标签。
(3)反思:在配制过程中,导致氯化钠溶液溶质质量分数偏小的可能原因有___________(填字母)。
Ⅱ.浸种:
(4)选好的稻种置于4%的盐水中浸泡30分钟左右,可防细菌性病害。若要将50g溶质质量分数为14%的盐水稀释成4%的浸种盐水,需加水多少克?(写出计算过程)
已知:20℃时,盐水的密度与溶质质量分数的对照表如下:
密度( ) ) | 1.0 | 1.03 | 1.07 | 1.09 | 1.10 | 1.12 | 1.13 |
| 溶质质量分数(%) | 2 | 4 | 8 | 12 | 14 | 16 | 18 |
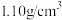 ,选种时将稻种加入配好的盐水中,静置一段时间后,用漏勺捞去浮于上层的劣种。
,选种时将稻种加入配好的盐水中,静置一段时间后,用漏勺捞去浮于上层的劣种。(1)由表中信息可知,水稻选种时,需配制的盐水的溶质质量分数是
(2)每个兴趣小组各配制50g上述盐水溶液,步骤如下:
①计算:配制上述溶液时,需氯化钠
 )
)②称量:称量需要的仪器有:托盘天平、药匙、量筒和
③溶解:溶解过程中,使用玻璃棒搅拌的目的是
④存放:将配制好的溶液装入试剂瓶中,盖好瓶塞并贴上标签。
(3)反思:在配制过程中,导致氯化钠溶液溶质质量分数偏小的可能原因有___________(填字母)。
| A.用量筒量取水时俯视读数 | B.用来配制溶液的烧杯刚用少量蒸馏水润洗过 |
| C.氯化钠固体中含有杂质 | D.配好的溶液装瓶时不小心洒出 |
Ⅱ.浸种:
(4)选好的稻种置于4%的盐水中浸泡30分钟左右,可防细菌性病害。若要将50g溶质质量分数为14%的盐水稀释成4%的浸种盐水,需加水多少克?(写出计算过程)
您最近一年使用:0次
综合应用题
|
适中
(0.65)
【推荐2】尿素[CO(NH2)2]是一种目前使用量较大的一种化学氮肥,适用于各种土壤和植物易保存,使用方便。
(1)尿素是一种含氮量很高的氮肥,它能使作物_____________ ;
(2)溶质质量分数32.5%的尿素溶液可用作柴油汽车尾气处理液,用尿素溶液处理柴油汽车尾气(含NO)时的化学方程式如下(反应条件略去):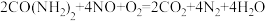 。现用含20Kg上述尿素溶液处理汽车尾气,请你回答下列问题:
。现用含20Kg上述尿素溶液处理汽车尾气,请你回答下列问题:
①配制上述尿素溶液,所需尿素的质量是___________ kg,水的体积是____________ L(水的密度1g/mL);
②计算用上述尿素溶液可除去的NO的质量是________ ?
③上述反应中,若尿素中氮元素为aKg,则生成的氮气中氮元素的质量是否为akg?________ 填“是”或“否”),原因是_______________ 。
(1)尿素是一种含氮量很高的氮肥,它能使作物
(2)溶质质量分数32.5%的尿素溶液可用作柴油汽车尾气处理液,用尿素溶液处理柴油汽车尾气(含NO)时的化学方程式如下(反应条件略去):
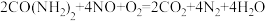 。现用含20Kg上述尿素溶液处理汽车尾气,请你回答下列问题:
。现用含20Kg上述尿素溶液处理汽车尾气,请你回答下列问题:①配制上述尿素溶液,所需尿素的质量是
②计算用上述尿素溶液可除去的NO的质量是
③上述反应中,若尿素中氮元素为aKg,则生成的氮气中氮元素的质量是否为akg?
您最近一年使用:0次
综合应用题
|
适中
(0.65)
【推荐3】水是一切生物生存所必须的宝贵资源,我们应该了解有关水的一些知识。
(1)为了防止水的污染,下列做法有利于保护水资源的是_____ (填序号):
①抑制水中所有动、植物的生长 ②不任意排放工业废水 ③大量使用化肥农药 ④生活污水经过净化处理后再排放
(2)有一种环保型消毒液发生器,其中发生的反应是氯化钠和水在通电条件下反应生成氢氧化钠、氢气和氯气(Cl2),该反应的化学方程式为_____ ;从能量变化角度看,该反应将电能转化为_____ 能。
(3)溶液在生产生活中有广泛的应用。某同学配置溶液时,在用量筒量取所需水的过程中,他俯视读数,这样配置得到的溶液溶质质量分数会_____ (填“偏大”、“偏小”或“无影响”).10%的CaCl2溶液可用作路面保湿剂,欲配置100kg该路面保湿剂,需要水的质量_____ kg。
(4)人们常饮用的一种矿泉水的标签如图所示,其中所含镁离子的离子符号为_____ ,该矿泉水是_____ (填“中性”“酸性”或“碱性”),人体吸收该矿泉水中含有的某一元素可以防止佝偻病,这种元素是_____ (填元素符号)。

(1)为了防止水的污染,下列做法有利于保护水资源的是
①抑制水中所有动、植物的生长 ②不任意排放工业废水 ③大量使用化肥农药 ④生活污水经过净化处理后再排放
(2)有一种环保型消毒液发生器,其中发生的反应是氯化钠和水在通电条件下反应生成氢氧化钠、氢气和氯气(Cl2),该反应的化学方程式为
(3)溶液在生产生活中有广泛的应用。某同学配置溶液时,在用量筒量取所需水的过程中,他俯视读数,这样配置得到的溶液溶质质量分数会
(4)人们常饮用的一种矿泉水的标签如图所示,其中所含镁离子的离子符号为

您最近一年使用:0次



