解题方法
1 . 宋朝王希孟的《千里江山图》历经千年,依旧色彩艳丽的关键在于使用了石青、石绿、赭石等传统颜料。某化学兴趣小组对石青和石绿的性质进行了以下探究。
查阅资料:石青的主要成分是2CuCO3•Cu(OH)2,石绿的主要成分是CuCO3•Cu(OH)2,都可称为碱式碳酸铜;碱式碳酸铜的化学式可表示为xCuCO3•yCu(OH)2,其中“•”表示合的意思,x、y为正整数;CuCO3、Cu(OH)2受热时会分解得到相应的氧化物。
I.探究石青和石绿的化学性质
(1)《本草纲目》载:铜得紫阳之气(二氧化碳、水蒸气、氧气)而生绿,绿久则成石,谓之石绿。请用化学方程式表示石绿的形成过程:_______ 。
(2)取少量石青粉末于试管中,充分加热后观察到试管中固体变黑,产生的气体通入到盛有澄清石灰水的烧杯中,溶液变浑浊。该黑色固体为_______ (填化学式)。
(3)取少量石绿粉末于试管中,加入足量稀硫酸,观察到固体溶解,产生气泡,溶液由无色变成蓝色。溶液中含有的盐类物质为_______ (填化学式)。
结论:碱式碳酸铜受热可分解,且可与酸反应。
II.测定某种碱式碳酸铜[为xCuCO3•yCu(OH)2]的组成。
利用如图所示装置进行实验(实验中每一步吸收都是完全的)。_______ ;②装入药品:③打开活塞K,鼓人空气;④一段时间后关闭活塞K,称量相关装置的质量;⑤点燃酒精灯,至装置B中无气泡产生;⑥打开活塞K,鼓入空气;⑦熄灭酒精灯;⑧一段时间后关闭活塞K,称量相关装置质量。
注:碱石灰主要成分为氢氧化钠和氧化钙固体,能吸收水和二氧化碳。
(5)C装置中U形管内碱石灰的作用是_______ 。
(6)若碱式碳酸铜已完全分解,实验后装置B增重4.5g,装置C增重4.4g,则该碱式碳酸铜的化学式可表示为_______ 。
III.感悟青绿
在古代,广义上青色可以代指绿色一蓝色一紫色一黑色,“青色”在文化意义上是一种虚指的颜色,常见的有玄青(氧化铜),曾青(硫酸铜),丹青(铜),青绿(碱式碳酸铜),这些颜色是中国文化的一个缩影。
(7)“曾青转化为丹青”的化学反应原理是_______ (用化学方程式表示)。
查阅资料:石青的主要成分是2CuCO3•Cu(OH)2,石绿的主要成分是CuCO3•Cu(OH)2,都可称为碱式碳酸铜;碱式碳酸铜的化学式可表示为xCuCO3•yCu(OH)2,其中“•”表示合的意思,x、y为正整数;CuCO3、Cu(OH)2受热时会分解得到相应的氧化物。
I.探究石青和石绿的化学性质
(1)《本草纲目》载:铜得紫阳之气(二氧化碳、水蒸气、氧气)而生绿,绿久则成石,谓之石绿。请用化学方程式表示石绿的形成过程:
(2)取少量石青粉末于试管中,充分加热后观察到试管中固体变黑,产生的气体通入到盛有澄清石灰水的烧杯中,溶液变浑浊。该黑色固体为
(3)取少量石绿粉末于试管中,加入足量稀硫酸,观察到固体溶解,产生气泡,溶液由无色变成蓝色。溶液中含有的盐类物质为
结论:碱式碳酸铜受热可分解,且可与酸反应。
II.测定某种碱式碳酸铜[为xCuCO3•yCu(OH)2]的组成。
利用如图所示装置进行实验(实验中每一步吸收都是完全的)。
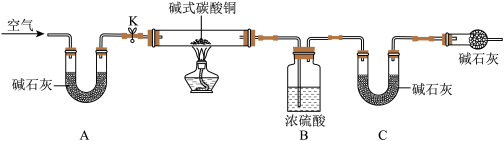
注:碱石灰主要成分为氢氧化钠和氧化钙固体,能吸收水和二氧化碳。
(5)C装置中U形管内碱石灰的作用是
(6)若碱式碳酸铜已完全分解,实验后装置B增重4.5g,装置C增重4.4g,则该碱式碳酸铜的化学式可表示为
III.感悟青绿
在古代,广义上青色可以代指绿色一蓝色一紫色一黑色,“青色”在文化意义上是一种虚指的颜色,常见的有玄青(氧化铜),曾青(硫酸铜),丹青(铜),青绿(碱式碳酸铜),这些颜色是中国文化的一个缩影。
(7)“曾青转化为丹青”的化学反应原理是
您最近半年使用:0次
解题方法
2 . 小江发现家里的菜刀上标注了“304”字样,为了解其含义及材质成分,开展了如下探究。
【查阅资料】
①食品级304不锈钢是指含铬18%、镍8%以及其他金属和非金属的不锈钢。
②铬(Cr)是一种银白色金属,在空气中能形成一层致密的氧化膜。
【提出问题】铬、铁、铜的金属活动性强弱顺序如何?
【猜想假设】
(1)猜想1:Cr>Fe>Cu;猜想2:______ 。猜想3:Fe>Cu>Cr。
【进行实验】
(2)步骤1:取大小相等的三种金属片,用砂纸打磨,打磨的目的是______ 。
步骤2:再分别放入三支装有等量等浓度的稀硫酸的试管中。
【反思评价】
(3)Cr在化合物中常显+3价,则Cr与稀硫酸反应的化学方程式为________ 。
(4)铁制品表面镀铬可以起到_______ 的作用。
【查阅资料】
①食品级304不锈钢是指含铬18%、镍8%以及其他金属和非金属的不锈钢。
②铬(Cr)是一种银白色金属,在空气中能形成一层致密的氧化膜。
【提出问题】铬、铁、铜的金属活动性强弱顺序如何?
【猜想假设】
(1)猜想1:Cr>Fe>Cu;猜想2:
【进行实验】
(2)步骤1:取大小相等的三种金属片,用砂纸打磨,打磨的目的是
步骤2:再分别放入三支装有等量等浓度的稀硫酸的试管中。
| 实验操作 | 实验现象 | 实验结论 |
| ①将铁片放入稀硫酸溶液中 | 铁片表面产生气泡较慢,溶液逐渐变为 | 猜想 |
| ②将铬片放入稀硫酸溶液中 | 铬片表面产生气泡较快 | |
| ③将铜片片放入稀硫酸溶液中 | 无明显现象 |
【反思评价】
(3)Cr在化合物中常显+3价,则Cr与稀硫酸反应的化学方程式为
(4)铁制品表面镀铬可以起到
您最近半年使用:0次
解题方法
3 . “天宫课堂”中王亚平老师做了泡腾片实验,往飘浮在空中的蓝色水球中放入半片泡腾片,泡腾片与水作用,不断产生小气泡,水球逐渐变大。小美非常感兴趣,于是购买了维C泡腾片,与小组同学一起开展探究活动。
活动一:检索标签信息
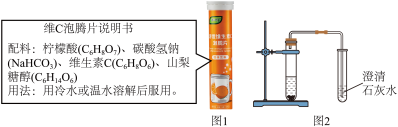
图1为维C泡腾片标签上的部分内容。
(1)维C泡腾片配料中的维生素C(C6H8O6)、碳酸氢钠(NaHCO3)和柠檬酸(C6H8O7),从组成上看,三种物质的共同点是_______ 。
(2)下列关于维生素C(化学式为C6H8O6)的说法正确的是_______(填字母编号)。
(3)根据用法提示,推测_______ 可能导致泡腾片成分发生改变。
活动二:探究泡腾片的发泡原理
【查阅资料】
(4)①碳酸氢钠(NaHCO3)俗称“小苏打”,与酸反应会生成二氧化碳;
②柠檬酸是一种酸,其化学式可表示为H3C6H5O7。
③碳酸氢钠和柠檬酸是泡腾片中的崩解剂,其作用是使泡腾片迅速崩解和融化,加水后两者发生如下反应:
_______ (填化学式)。
【设计并进行实验】
(5)小组同学利用图2装置探究维C泡腾片溶于水发生的反应,并验证生成的气体。将该气体通入盛有澄清石灰水的试管中,观察到的现象是澄清石灰水变浑浊,请写出此反应的化学方程式_______ ,证明该气体是二氧化碳。
【交流讨论】
(6)小美同学提出,维C泡腾片遇到其他液体也能产生气泡吗?他们设计并进行了以下4个实验,将4片同样的泡腾片同时放入四个盛有10mL不同液体的烧杯中。
(7)以上实验还能得出的结论是_______ 。
【实验启示】
(8)维C泡腾片保存方法是_______ 。
活动三:测定维C泡腾片中碳酸氢钠的含量
称量相关实验用品质量,将本品4g投入蒸馏水中(反应原理见活动二查阅资料③),待不再产生气体后,称量锥形瓶及瓶内所有物质的总质量。装置如图3所示,相关数据如表:

(9)生成的二氧化碳质量为_______ g;
(10)根据以上数据计算碳酸氢钠的质量分数_______ 。
活动一:检索标签信息

图1为维C泡腾片标签上的部分内容。
(1)维C泡腾片配料中的维生素C(C6H8O6)、碳酸氢钠(NaHCO3)和柠檬酸(C6H8O7),从组成上看,三种物质的共同点是
(2)下列关于维生素C(化学式为C6H8O6)的说法正确的是_______(填字母编号)。
| A.维生素C属于氧化物 |
| B.维生素C的相对分子质量为176 |
| C.维生素C由6个碳原子、8个氢原子和6个氧原子构成 |
| D.维生素C中C、H、O元素的质量比为9:1:12 |
(3)根据用法提示,推测
活动二:探究泡腾片的发泡原理
【查阅资料】
(4)①碳酸氢钠(NaHCO3)俗称“小苏打”,与酸反应会生成二氧化碳;
②柠檬酸是一种酸,其化学式可表示为H3C6H5O7。
③碳酸氢钠和柠檬酸是泡腾片中的崩解剂,其作用是使泡腾片迅速崩解和融化,加水后两者发生如下反应:

【设计并进行实验】
(5)小组同学利用图2装置探究维C泡腾片溶于水发生的反应,并验证生成的气体。将该气体通入盛有澄清石灰水的试管中,观察到的现象是澄清石灰水变浑浊,请写出此反应的化学方程式
【交流讨论】
(6)小美同学提出,维C泡腾片遇到其他液体也能产生气泡吗?他们设计并进行了以下4个实验,将4片同样的泡腾片同时放入四个盛有10mL不同液体的烧杯中。
| 实验 | 实验现象 | 实验结论 | |
| 实验1 | 放入水中 | 水中有大量气泡产生; | 有水存在,维C泡腾片才能产生CO2 |
| 实验2 | 放入植物油中 | 植物油中无明显现象; | |
| 实验3 | 放入酒精中 | 酒精中无明显现象; | |
| 实验4 | 放入白醋中 | 白醋(主要成分为醋酸和水)中 | |
(7)以上实验还能得出的结论是
【实验启示】
(8)维C泡腾片保存方法是
活动三:测定维C泡腾片中碳酸氢钠的含量
称量相关实验用品质量,将本品4g投入蒸馏水中(反应原理见活动二查阅资料③),待不再产生气体后,称量锥形瓶及瓶内所有物质的总质量。装置如图3所示,相关数据如表:

| 反应前/g | 反应后/g | ||
| 锥形瓶 | 蒸馏水 | 维C泡腾片 | 锥形瓶及瓶内所有物质 |
| 70.00 | 50.00 | 4.00 | 123.78 |
(9)生成的二氧化碳质量为
(10)根据以上数据计算碳酸氢钠的质量分数
您最近半年使用:0次
4 . 某兴趣小组为验证质量守恒定律,进行了以下探究:

【探究一】甲小组做了镁条在空气中燃烧的实验(图1)
(1)镁条与氧气的化学方程式为_______________ ,反应现象为_______________ 。
(2)小组同学称得燃烧产物的质量大于反应物镁条的质量,你认为该反应_______ (填“遵守”或“不遵守”)质量守恒定律。
〖探究一〗小红按图2装置改进实验,验证了质量守恒定律,却发现产物中还有一些黄色固体。
【提出问题】黄色固体是什么呢?
【查阅资料】①氧化镁为白色固体;
②镁能与氮气反应生成黄色的氮化镁(Mg3N2)固体;
③氮化镁可与水反应生成氨气,氨气能使酚酞溶液变红。
【做出猜想】黄色固体为Mg3N2。
【实验探究】
(3)
【反思交流】
(4)空气中N2的含量远大于O2的含量,而镁条在空气中燃烧生成的MgO却远多于Mg3N2,你认为可能的原因是_______________ 。
【拓展延伸】
(5)如果用图2装置(气密性良好)和药品(足量)测定空气中氧气含量,该实验所测得的氧气体积分数__________ (填“大于”、“小于”或“等于”)五分之一。
(6)2.4g镁条在盛有氧气和氮气的混合气体的密闭容器中完全燃烧,所得固体质量为a克,则a取值范围是__________ (结果保留1位小数)。

【探究一】甲小组做了镁条在空气中燃烧的实验(图1)
(1)镁条与氧气的化学方程式为
(2)小组同学称得燃烧产物的质量大于反应物镁条的质量,你认为该反应
〖探究一〗小红按图2装置改进实验,验证了质量守恒定律,却发现产物中还有一些黄色固体。
【提出问题】黄色固体是什么呢?
【查阅资料】①氧化镁为白色固体;
②镁能与氮气反应生成黄色的氮化镁(Mg3N2)固体;
③氮化镁可与水反应生成氨气,氨气能使酚酞溶液变红。
【做出猜想】黄色固体为Mg3N2。
【实验探究】
(3)
| 实验操作 | 实验现象及结论 | |
| 如图,取燃烧产物于烧杯B 中,加入适量 | 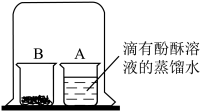 | 现象: 结论:燃烧产物中含Mg3N2 |
【反思交流】
(4)空气中N2的含量远大于O2的含量,而镁条在空气中燃烧生成的MgO却远多于Mg3N2,你认为可能的原因是
【拓展延伸】
(5)如果用图2装置(气密性良好)和药品(足量)测定空气中氧气含量,该实验所测得的氧气体积分数
(6)2.4g镁条在盛有氧气和氮气的混合气体的密闭容器中完全燃烧,所得固体质量为a克,则a取值范围是
您最近半年使用:0次
23-24九年级上·全国·期中
5 . 高锰酸钾是一种重要的化工产品,某种生产高锰酸钾的工业流程如图所示。流程中箭头进入的是投料(即反应物),出去的是生成物(包括主产物和副产物)。

(1)“Ⅰ混合加热”步骤中发生的主要是______ (填“物理”或“化学”)变化;
(2)分析完成“Ⅱ氧化反应”中的化学方程式:2MnO2+4KOH+O2
______ ;
(3)“Ⅲ电解”步骤中所发生化学反应的主要能量转化形式为:______ 能转化为化学能;
(4)在整个生产流程中,可循环利用的物质主要是______ (填化学式);
(5)经干燥等操作得到KMnO4晶体时温度不宜过高,是因为KMnO4受热易分解,请写出该反应的化学方程式_______ 。

(1)“Ⅰ混合加热”步骤中发生的主要是
(2)分析完成“Ⅱ氧化反应”中的化学方程式:2MnO2+4KOH+O2

(3)“Ⅲ电解”步骤中所发生化学反应的主要能量转化形式为:
(4)在整个生产流程中,可循环利用的物质主要是
(5)经干燥等操作得到KMnO4晶体时温度不宜过高,是因为KMnO4受热易分解,请写出该反应的化学方程式
您最近半年使用:0次
名校
解题方法
6 . 某化学小组同学做镁条在空气中燃烧实验时,发现生成物中还有少量淡黄色固体,针对这一现象,他们开展了如下探究。
【探究目的】探究淡黄色固体是镁与空气中什么物质反应产生的?
【查阅资料】I、稀有气体一般不与其他物质反应。
Ⅱ、光亮的镁条放入沸水中,表面会附有白色固体。
Ⅲ、镁条与二氧化碳反应有黑色固体生成。
【提出猜想】分析空气中各种成分,进行猜想:
猜想1:氧气:猜想2:___________ :猜想3:二氧化碳:猜想4:水蒸气
小明认为猜想3和猜想4都不合理,原因是___________ 。
【实验一】镁条与氧气的反应
甲同学采用控制变量法探究了影响过氧化氢制取氧气速度的某种因素,进行了三次实验并记录各收集相同体积氧气所需要的时间如表:
表中x=___________ 。
实验结论:在相同条件下,过氧化氢溶液浓度越大,产生氧气速率越快。
收集纯净的氧气,将镁条打磨光亮,点燃,伸入盛满氧气的集气瓶中,发出耀眼白光,生成白色固体。写出该反应的文字表达式___________ 。
【实验二】镁条与氮气的反应
收集纯净的氮气,将镁条打磨光亮,点燃,伸入盛氮气的集气瓶中,瓶内壁附着一层淡黄色的固体。
【实验结论】综上分析,关于镁在空气中燃烧产生淡黄色固体的猜想中,猜想___________ 成立。
【拓展交流】如果用足量的镁替代红磷进行空气组成实验,实验测得氧气体积与氧气所占空气真实比例相比较会___________ (填“偏大”或“偏小”)。
【探究目的】探究淡黄色固体是镁与空气中什么物质反应产生的?
【查阅资料】I、稀有气体一般不与其他物质反应。
Ⅱ、光亮的镁条放入沸水中,表面会附有白色固体。
Ⅲ、镁条与二氧化碳反应有黑色固体生成。
【提出猜想】分析空气中各种成分,进行猜想:
猜想1:氧气:猜想2:
小明认为猜想3和猜想4都不合理,原因是
【实验一】镁条与氧气的反应
甲同学采用控制变量法探究了影响过氧化氢制取氧气速度的某种因素,进行了三次实验并记录各收集相同体积氧气所需要的时间如表:
| 过氧化氢的浓度 | 过氧化氢溶液质量(g) | 二氧化锰质量(g) | 收集时间(s) | |
| 1 | 10% | 20 | 1 | 40 |
| 2 | 15% | 20 | 1 | 20 |
| 3 | 20% | x | 1 | 12 |
实验结论:在相同条件下,过氧化氢溶液浓度越大,产生氧气速率越快。
收集纯净的氧气,将镁条打磨光亮,点燃,伸入盛满氧气的集气瓶中,发出耀眼白光,生成白色固体。写出该反应的文字表达式
【实验二】镁条与氮气的反应
收集纯净的氮气,将镁条打磨光亮,点燃,伸入盛氮气的集气瓶中,瓶内壁附着一层淡黄色的固体。
【实验结论】综上分析,关于镁在空气中燃烧产生淡黄色固体的猜想中,猜想
【拓展交流】如果用足量的镁替代红磷进行空气组成实验,实验测得氧气体积与氧气所占空气真实比例相比较会
您最近半年使用:0次
解题方法
7 . 二氧化碳一直备受人类关注,它对维持自然界生态平衡有着非常重要的作用。某兴趣小组围绕CO2开展主题研究。
资料一:1630年,海尔蒙特常在一些洞穴底部发现一种能使燃着的蜡烛熄灭的气体,后来被证实是二氧化碳。
资料二:柠檬酸为无色晶体,易溶于水,具有酸性;常温下稳定,加热至175℃会分解。


Ⅰ.制备
(1)实验室制备二氧化碳反应的符号表达式是____ 。
Ⅱ.探究
(2)二氧化碳常在洞穴底部被发现的原因是_____ 。
图-1是某饮料的部分标签,某同学设计实验证明该饮料中含有CO2。
【实验探究】
(3)请完善下面的表格。
【交流反思】
同学们经过讨论,一致认为方案一比较合理,方案二也可能是该饮料中的柠檬酸随气体进入试管从而引起试剂a的变色。
【深入探究】
(4)同学们决定在方案二实验的基础上,不增加任何试剂,仅通过一步实验操作即可确认不是因为柠檬酸引起的变色。该操作及现象是_____ ,该反应的符号表达式为_____ 。
Ⅲ.二氧化碳对环境的影响
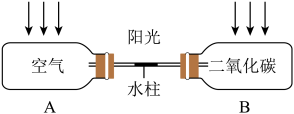
(5)同学们设计了图-3所示的实验装置来验证二氧化碳的温室效应,该实验装置是通过_____ 来判断二氧化碳与空气的温室效应强弱的。
(6)“碳中和”是指排放的二氧化碳被植物的_____ 作用、人工转化等形式消耗掉,即“碳排放”=“碳吸收”,图-4是科学家以二氧化碳为原料制取炭黑的流程图,可以有效实现“碳吸收”。
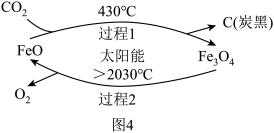
①过程1发生反应的符号表达式是____ 。
②过程2中太阳能转化为____ 能。
③此流程中可循环使用的物质有____ 。
④计算Fe3O4的相对分子质量____ (请列式求算)
(7)下列措施中,有利于缓解温室效应的是____ (填字母序号)。
a.焚烧秸秆
b.利用太阳能、风能
c.减少化石燃料的使用
d.植树造林,增大植被面积
资料一:1630年,海尔蒙特常在一些洞穴底部发现一种能使燃着的蜡烛熄灭的气体,后来被证实是二氧化碳。
资料二:柠檬酸为无色晶体,易溶于水,具有酸性;常温下稳定,加热至175℃会分解。



Ⅰ.制备
(1)实验室制备二氧化碳反应的符号表达式是
Ⅱ.探究
(2)二氧化碳常在洞穴底部被发现的原因是
图-1是某饮料的部分标签,某同学设计实验证明该饮料中含有CO2。
【实验探究】
(3)请完善下面的表格。
| 实验操作 | 实验现象 | 结论与解释 | |
| 如图-2所示,导管另一端伸入盛有试剂a的试管中 | 方案一:试剂a为澄清石灰水 | 饮料含有CO2。试管中反应符号表达式为 | |
| 方案二:试剂a为 | 试管中液体变成红色 | 饮料含有CO2 | |
【交流反思】
同学们经过讨论,一致认为方案一比较合理,方案二也可能是该饮料中的柠檬酸随气体进入试管从而引起试剂a的变色。
【深入探究】
(4)同学们决定在方案二实验的基础上,不增加任何试剂,仅通过一步实验操作即可确认不是因为柠檬酸引起的变色。该操作及现象是
Ⅲ.二氧化碳对环境的影响
(5)同学们设计了图-3所示的实验装置来验证二氧化碳的温室效应,该实验装置是通过
(6)“碳中和”是指排放的二氧化碳被植物的

①过程1发生反应的符号表达式是
②过程2中太阳能转化为
③此流程中可循环使用的物质有
④计算Fe3O4的相对分子质量
(7)下列措施中,有利于缓解温室效应的是
a.焚烧秸秆
b.利用太阳能、风能
c.减少化石燃料的使用
d.植树造林,增大植被面积
您最近半年使用:0次
解题方法
8 . 某化学小组受英国科学家法拉第所著《蜡烛的化学史》的启发,对蜡烛进行了探究。
[查阅资料]硫酸铜是一种白色粉末,具有吸水性,吸水后变为蓝色。
[进行实验]
[结论]蜡烛燃烧是___________ (填固体、液体或气体)在燃烧,蜡烛在空气中燃烧的文字表达式为___________ 。
[查阅资料]硫酸铜是一种白色粉末,具有吸水性,吸水后变为蓝色。
[进行实验]
| 编号 | 实验步骤 | 实验现象 | 实验结论 |
| Ⅰ | 用小刀从蜡烛上切一块石蜡,放入水中 | 石蜡浮在水面上,且石蜡块无明显变化 | 石蜡硬度小,密度比水 |
| Ⅱ |  | 外焰处的铁纱窗出现红热的环,内焰及焰心处的铁纱窗无明显变化 | |
| Ⅲ |  | 伸入焰心的导管引出白烟,且 | 焰心处有可燃物 |
| Ⅳ |  | 澄清石灰水 | 蜡烛燃烧生成了水和二氧化碳 |
您最近半年使用:0次
9 . 科学探究和证据推理是化学学科的核心素养。化学兴趣小组对“测定空气中氧气的含量”实验进行探究,并基于证据进行推理分析。
(一)氧气是参与“氧循环”的重要物质。

(1)图3为空气成分示意图,物质A为___________ 。
(2)若测出空气中氧气体积分数小于1/5,可能的原因是___________ (答一点)。
(3)利用图1装置测定空气中氧气含量并结合传感器技术,测得实验过程中容器内气体压强、温度的变化趋势如图2所示。请结合实验原理,解释引起DE段气体压强变化的操作是:________ 。
(二)Ι用红磷测定空气中氧气的含量
(4)写出红磷在空气中燃烧的文字表达式:___________ 。
(5)某同学利用图1所示装置进行实验,步骤如下:
①用弹簧夹夹紧胶皮管;
②点燃燃烧匙内的红磷,立即伸入瓶中并塞紧瓶塞;
③待装置冷却后打开弹簧夹;
④观察并记录水面的变化情况。多次实验发现,集气瓶内水平面上升始终小于1/5。
同学们查阅资料得知,当空气中氧气的体积分数降至约为7%以下时,红磷不再燃烧。由此可知,燃烧红磷法测定结果不够准确的原因的是___________ 。
Ⅱ用镁条测定空气中氧气的含量
(6)某同学进行图2所示实验时发现,产物中有少许黄色固体。
【提出问题】黄色固体是什么呢?
【查阅资料】①氧化镁为白色固体;
②镁能与空气中的氮气反应生成黄色的氮化镁(Mg3N2)固体;
③氮化镁可与水反应生成氨气
【做出猜想】黄色固体为Mg3N2
【实验过程】进行图3所示实验:取燃烧产物于烧杯B中,加入适量水,然后用大烧杯罩住小烧杯A和B。
【实验结论】观察到的现象________ ,据此可推断燃烧产物中含氮化镁(Mg3N2)。
【反思交流】进行图2所示实验时,在确保规范操作的前提下,该同学所测得的空气中氧气的体积分数____ (填“大于”“小于”或“等于”)1/5。
(一)氧气是参与“氧循环”的重要物质。

(1)图3为空气成分示意图,物质A为
(2)若测出空气中氧气体积分数小于1/5,可能的原因是
(3)利用图1装置测定空气中氧气含量并结合传感器技术,测得实验过程中容器内气体压强、温度的变化趋势如图2所示。请结合实验原理,解释引起DE段气体压强变化的操作是:
(二)Ι用红磷测定空气中氧气的含量

(4)写出红磷在空气中燃烧的文字表达式:
(5)某同学利用图1所示装置进行实验,步骤如下:
①用弹簧夹夹紧胶皮管;
②点燃燃烧匙内的红磷,立即伸入瓶中并塞紧瓶塞;
③待装置冷却后打开弹簧夹;
④观察并记录水面的变化情况。多次实验发现,集气瓶内水平面上升始终小于1/5。
同学们查阅资料得知,当空气中氧气的体积分数降至约为7%以下时,红磷不再燃烧。由此可知,燃烧红磷法测定结果不够准确的原因的是
Ⅱ用镁条测定空气中氧气的含量
(6)某同学进行图2所示实验时发现,产物中有少许黄色固体。
【提出问题】黄色固体是什么呢?
【查阅资料】①氧化镁为白色固体;
②镁能与空气中的氮气反应生成黄色的氮化镁(Mg3N2)固体;
③氮化镁可与水反应生成氨气
【做出猜想】黄色固体为Mg3N2
【实验过程】进行图3所示实验:取燃烧产物于烧杯B中,加入适量水,然后用大烧杯罩住小烧杯A和B。
【实验结论】观察到的现象
【反思交流】进行图2所示实验时,在确保规范操作的前提下,该同学所测得的空气中氧气的体积分数
您最近半年使用:0次
10 . 某实验小组为了探究影响过氧化氢分解快慢的因素,进行了下列实验:
(1)欲探究温度在实验中是否有影响,应该比较______ (填实验序号):从实验收集的是数据看,a>b,即实验②收集等量氧气所需时间比实验①少,由此可得出的结论是______ 。
(2)请写出过氧化氢分解的文字表达式:______ 。
(3)除测定收集相同体积的氧气所需的时间外,还可通过测定______ 的方法比较过氧化氢分解的快慢。
(4)若其他条件相同,则催化剂的种类可能会影响到催化效果请设计实验方案进行验证:______ 。
(5)该小组同学还使用了压强传感器测不同质量的二氧化锰对过氧化氢分解反应的影响,他在8mL3%的过氧化氢溶液中分别加0.03g、0.06g、0.08g、0.12g、0.24g的二氧化锰,压强的变化曲线如图所示(说明,曲线的斜率表征催化剂反应的速率)。
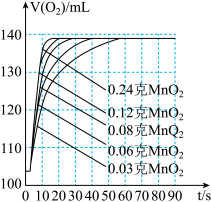
a.根据图示可知:该条件下30s内要完全分解8mL3%的过氧化氢溶液,至少要用______ g的MnO2。
b.请相据图示写出两条规律性的结论:______ ,______ 。
| 实验 序号 | 过氧化氢 溶液浓度 | 过氧化氢溶液 的体积/mL | 温度/℃ | 二氧化锰 的用量/g | 收集氧气的 体积/mL | 收集氧气所需 的时间/s |
| 1 | 5 | 1 | 20 | 0.1 | 4 | a |
| 2 | 15 | 1 | 20 | 0.1 | 4 | b |
| 3 | 30 | 5 | 35 | 0.1 | 4 | c |
| 4 | 30 | 5 | 55 | 0.1 | 4 | d |
(2)请写出过氧化氢分解的文字表达式:
(3)除测定收集相同体积的氧气所需的时间外,还可通过测定
(4)若其他条件相同,则催化剂的种类可能会影响到催化效果请设计实验方案进行验证:
(5)该小组同学还使用了压强传感器测不同质量的二氧化锰对过氧化氢分解反应的影响,他在8mL3%的过氧化氢溶液中分别加0.03g、0.06g、0.08g、0.12g、0.24g的二氧化锰,压强的变化曲线如图所示(说明,曲线的斜率表征催化剂反应的速率)。

a.根据图示可知:该条件下30s内要完全分解8mL3%的过氧化氢溶液,至少要用
b.请相据图示写出两条规律性的结论:
您最近半年使用:0次



