2024·重庆·模拟预测
解题方法
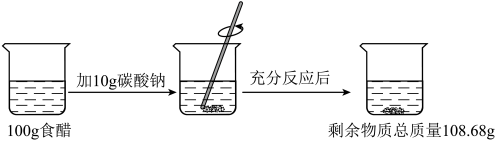
1 . 食醋中醋酸(化学式为CH3COOH)的质量分数,按国家标准应≥3.50%(即每100 g食醋中含有的醋酸不少于3.5 g),某兴趣小组为测定某品牌食醋的醋酸含量,进行如图所示的实验。
(1)醋酸中碳元素和氧元素的质量比为_________ 。
(2)反应后生成CO2的质量为______ g。
(3)求100g该市售食醋中的醋酸质量,并说明该食醋是否符合国家标准。
(1)醋酸中碳元素和氧元素的质量比为
(2)反应后生成CO2的质量为
(3)求100g该市售食醋中的醋酸质量,并说明该食醋是否符合国家标准。
您最近一年使用:0次
2024·重庆·模拟预测
解题方法
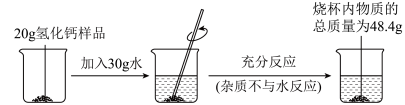
2 . 氢化钙(CaH2) 是有机合成的还原剂。遇水发生化学反应,生成氢氧化钙和氢气。为了测定某样品中氢化钙的含量, 进行了如图所示实验, 根据所提供数据计算:
[反应原理:CaH2 + 2H2O = Ca(OH)2 +2H2↑]_______ 。
(2)生成氢气的质量是______ g。
(3)该样品中氢化钙的质量(要求写出计算过程)。
[反应原理:CaH2 + 2H2O = Ca(OH)2 +2H2↑]
(2)生成氢气的质量是
(3)该样品中氢化钙的质量(要求写出计算过程)。
您最近一年使用:0次
2024·重庆·模拟预测
解题方法
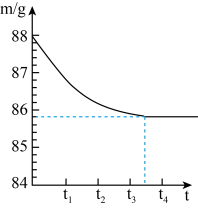
3 . 已知某矿山上的石灰石样品中只含二氧化硅杂质(二氧化硅是一种既不溶于水也不与盐酸反应且耐高温的固体)。某化学兴趣小组想测定该样品中碳酸钙的质量分数,他们选取了一块石灰石样品进行了如下探究:先将样品粉碎,称量8g样品放入烧杯内(烧杯质量为20g),然后加入60g足量的某一定溶质质量分数的稀盐酸,充分反应至不再产生气泡为止。反应所需时间(t)和烧杯及其所盛物质总质量(m)的关系如下图所示。请完成下列问题:___________ 。
(2)从图中可以看出,反应结束后生成CO2的质量为___________ g;
(3)该石灰石样品中碳酸钙的质量分数是多少?(通过化学方程式计算)
(2)从图中可以看出,反应结束后生成CO2的质量为
(3)该石灰石样品中碳酸钙的质量分数是多少?(通过化学方程式计算)
您最近一年使用:0次
名校
解题方法
4 . 过碳酸钠(Na2CO4)是一种常见的漂白杀菌剂,它能和盐酸发生如下反应:2Na2CO4+4HCl=4NaCl+2CO2↑+O2↑+2H2O。现在实验室取30.5g含过碳酸钠80%的过碳酸钠样品(杂质不参加反应且不溶于水)和104.6g稀盐酸恰好完全反应(假设生成的气体全部逸出)。试计算:
(已知相对分子质量:Na2CO4 122 NaCl 58.5)
(1)Na2CO4中碳元素和氧元素的质量比为___________ (填最简整数比)
(2)反应后溶液中溶质的质量分数。
(3)将反应后所得溶液的溶质质量分数变为25%,求需要加入氯化钠固体的质量。
(已知相对分子质量:Na2CO4 122 NaCl 58.5)
(1)Na2CO4中碳元素和氧元素的质量比为
(2)反应后溶液中溶质的质量分数。
(3)将反应后所得溶液的溶质质量分数变为25%,求需要加入氯化钠固体的质量。
您最近一年使用:0次
真题
解题方法
5 .  曾作为照相中的显影剂,可由
曾作为照相中的显影剂,可由 制得。取100g
制得。取100g 溶液,加入5.3g
溶液,加入5.3g 固体,两者恰好完全反应。(不考虑水的挥发)试计算:
固体,两者恰好完全反应。(不考虑水的挥发)试计算:
(可能用到的部分相对分子质量: 104
104  126)
126)
(1) 中钠元素与氧元素的质量比为
中钠元素与氧元素的质量比为___________ 。
(2) 溶液中溶质的质量分数(结果精确到0.1%,下同)。
溶液中溶质的质量分数(结果精确到0.1%,下同)。
(3)所得溶液中溶质的质量分数。
 曾作为照相中的显影剂,可由
曾作为照相中的显影剂,可由 制得。取100g
制得。取100g 溶液,加入5.3g
溶液,加入5.3g 固体,两者恰好完全反应。(不考虑水的挥发)试计算:
固体,两者恰好完全反应。(不考虑水的挥发)试计算:(可能用到的部分相对分子质量:
 104
104  126)
126)(1)
 中钠元素与氧元素的质量比为
中钠元素与氧元素的质量比为(2)
 溶液中溶质的质量分数(结果精确到0.1%,下同)。
溶液中溶质的质量分数(结果精确到0.1%,下同)。(3)所得溶液中溶质的质量分数。
您最近一年使用:0次
真题
解题方法
6 . 某工业生产铜的过程中,可发生反应: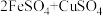

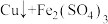 。实验室模拟这一反应时,用FeSO4溶液103.2g和CuSO4溶液100g在该条件下恰好完全反应,得到3.2g固体。试计算:
。实验室模拟这一反应时,用FeSO4溶液103.2g和CuSO4溶液100g在该条件下恰好完全反应,得到3.2g固体。试计算:
[可能用到的部分相对分子质量: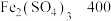 ]
]
(1)CuSO4中质量分数最小的元素是___________ 。
(2)原CuSO4溶液中溶质的质量分数。
(3)反应后所得溶液中溶质的质量分数。
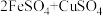

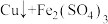 。实验室模拟这一反应时,用FeSO4溶液103.2g和CuSO4溶液100g在该条件下恰好完全反应,得到3.2g固体。试计算:
。实验室模拟这一反应时,用FeSO4溶液103.2g和CuSO4溶液100g在该条件下恰好完全反应,得到3.2g固体。试计算:[可能用到的部分相对分子质量:
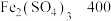 ]
](1)CuSO4中质量分数最小的元素是
(2)原CuSO4溶液中溶质的质量分数。
(3)反应后所得溶液中溶质的质量分数。
您最近一年使用:0次
名校
解题方法
7 . 碱式碳酸镁 是一种高效的新型阻燃剂,一种工业制备原理的化学方程式如下:
是一种高效的新型阻燃剂,一种工业制备原理的化学方程式如下: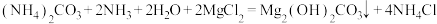 。现向475kg溶质质量分数为20%的
。现向475kg溶质质量分数为20%的 溶液中加入一定质量的
溶液中加入一定质量的 溶液和
溶液和 ,恰好完全反应,得到溶质质量分数为10%的溶液。
,恰好完全反应,得到溶质质量分数为10%的溶液。
相对分子质量: -53.5;
-53.5; -95;
-95; -96;
-96; -142
-142
(1) 中镁元素和氧元素的质量比是
中镁元素和氧元素的质量比是______ (填最简整数比)。
(2)求原 溶液的溶质质量分数(结果精确到0.1%)。
溶液的溶质质量分数(结果精确到0.1%)。
(3)欲将475kg 溶液的溶质质量分数由20%变为24%,需加入
溶液的溶质质量分数由20%变为24%,需加入
______ kg。
 是一种高效的新型阻燃剂,一种工业制备原理的化学方程式如下:
是一种高效的新型阻燃剂,一种工业制备原理的化学方程式如下: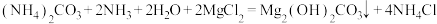 。现向475kg溶质质量分数为20%的
。现向475kg溶质质量分数为20%的 溶液中加入一定质量的
溶液中加入一定质量的 溶液和
溶液和 ,恰好完全反应,得到溶质质量分数为10%的溶液。
,恰好完全反应,得到溶质质量分数为10%的溶液。相对分子质量:
 -53.5;
-53.5; -95;
-95; -96;
-96; -142
-142(1)
 中镁元素和氧元素的质量比是
中镁元素和氧元素的质量比是(2)求原
 溶液的溶质质量分数(结果精确到0.1%)。
溶液的溶质质量分数(结果精确到0.1%)。(3)欲将475kg
 溶液的溶质质量分数由20%变为24%,需加入
溶液的溶质质量分数由20%变为24%,需加入
您最近一年使用:0次
名校
8 . 氯化钠是一种重要的化工原料。电解氯化钠溶液可制得氯气、氢氧化钠和氢气,反应的化学方程式为2NaCl+2H2O Cl2↑+H2↑+2NaOH。现取一定质量的氯化钠溶液进行电解,当氯化钠完全反应时,得到42.7g溶液,生成氢气的质量与时间的关系如图所示。请计算:
Cl2↑+H2↑+2NaOH。现取一定质量的氯化钠溶液进行电解,当氯化钠完全反应时,得到42.7g溶液,生成氢气的质量与时间的关系如图所示。请计算:_______ (填元素符号)。
(2)原氯化钠溶液中溶质的质量分数是多少?(写出计算过程)
(3)若将原氯化钠溶液的质量分数变成40%,可加入氯化钠固体_______ g(结果保留至0.1g)。
 Cl2↑+H2↑+2NaOH。现取一定质量的氯化钠溶液进行电解,当氯化钠完全反应时,得到42.7g溶液,生成氢气的质量与时间的关系如图所示。请计算:
Cl2↑+H2↑+2NaOH。现取一定质量的氯化钠溶液进行电解,当氯化钠完全反应时,得到42.7g溶液,生成氢气的质量与时间的关系如图所示。请计算: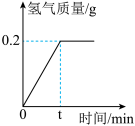
(2)原氯化钠溶液中溶质的质量分数是多少?(写出计算过程)
(3)若将原氯化钠溶液的质量分数变成40%,可加入氯化钠固体
您最近一年使用:0次
2024·重庆·模拟预测
解题方法
9 . 电解法是工业上制锅的主要方法:控制一定条件,电解硫酸铜溶液,析出的铜附着在阴极板上,反应的化学方程式为2CuSO4+2H2O 2Cu↓+O2↑+2H2SO4。现取一定质量的硫酸铜溶液,在实验室中模拟工业条件进行电解,当析出6.4g Cu时,剩余含硫酸铜质量分数为5%的溶液 192 g。回答下列问题(注:本题中不考虑气体溶解)
2Cu↓+O2↑+2H2SO4。现取一定质量的硫酸铜溶液,在实验室中模拟工业条件进行电解,当析出6.4g Cu时,剩余含硫酸铜质量分数为5%的溶液 192 g。回答下列问题(注:本题中不考虑气体溶解)
(1)生成氧气的质量为______ g。
(2)求原硫酸铜溶液中溶质的质量分数。
(3)要得到溶质的质量分数为15%的硫酸铜溶液,需要向100 g 5%的硫酸铜溶液中加入硫酸铜固体的质量为多少(结果保留一位小数)?
 2Cu↓+O2↑+2H2SO4。现取一定质量的硫酸铜溶液,在实验室中模拟工业条件进行电解,当析出6.4g Cu时,剩余含硫酸铜质量分数为5%的溶液 192 g。回答下列问题(注:本题中不考虑气体溶解)
2Cu↓+O2↑+2H2SO4。现取一定质量的硫酸铜溶液,在实验室中模拟工业条件进行电解,当析出6.4g Cu时,剩余含硫酸铜质量分数为5%的溶液 192 g。回答下列问题(注:本题中不考虑气体溶解)(1)生成氧气的质量为
(2)求原硫酸铜溶液中溶质的质量分数。
(3)要得到溶质的质量分数为15%的硫酸铜溶液,需要向100 g 5%的硫酸铜溶液中加入硫酸铜固体的质量为多少(结果保留一位小数)?
您最近一年使用:0次
名校
10 . 白铅矿(主要成分是 )是炼铅的主要原料。为探究其性质,小鲁同学取
)是炼铅的主要原料。为探究其性质,小鲁同学取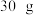 白铅矿(杂质不溶于水且不参与反应)于烧杯中,加入
白铅矿(杂质不溶于水且不参与反应)于烧杯中,加入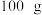 稀硝酸,恰好完全反应,烧杯中残留
稀硝酸,恰好完全反应,烧杯中残留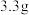 固体。再继续向烧杯中滴加某未知浓度的
固体。再继续向烧杯中滴加某未知浓度的 溶液,烧杯内固体质量随加入
溶液,烧杯内固体质量随加入 溶液的质量变化关系如图所示,A点时消耗了
溶液的质量变化关系如图所示,A点时消耗了 氢氧化钠溶液。
氢氧化钠溶液。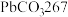 ;
; ;
;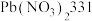 ;
;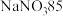 )
)
提示:①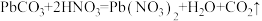 ;②
;②
求:
(1) 中氧元素与碳元素的质量比为
中氧元素与碳元素的质量比为________ 。
(2)所取白铅矿中 的质量为
的质量为________ 。
(3)A点对应的反应后溶液的溶质质量分数是多少?(写出计算过程,结果保留1位小数)
 )是炼铅的主要原料。为探究其性质,小鲁同学取
)是炼铅的主要原料。为探究其性质,小鲁同学取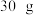 白铅矿(杂质不溶于水且不参与反应)于烧杯中,加入
白铅矿(杂质不溶于水且不参与反应)于烧杯中,加入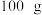 稀硝酸,恰好完全反应,烧杯中残留
稀硝酸,恰好完全反应,烧杯中残留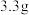 固体。再继续向烧杯中滴加某未知浓度的
固体。再继续向烧杯中滴加某未知浓度的 溶液,烧杯内固体质量随加入
溶液,烧杯内固体质量随加入 溶液的质量变化关系如图所示,A点时消耗了
溶液的质量变化关系如图所示,A点时消耗了 氢氧化钠溶液。
氢氧化钠溶液。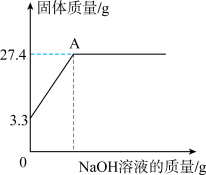
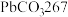 ;
; ;
;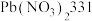 ;
;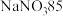 )
)提示:①
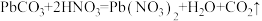 ;②
;②
求:
(1)
 中氧元素与碳元素的质量比为
中氧元素与碳元素的质量比为(2)所取白铅矿中
 的质量为
的质量为(3)A点对应的反应后溶液的溶质质量分数是多少?(写出计算过程,结果保留1位小数)
您最近一年使用:0次



