1 . 镁和纯碱在工业生产中有广泛的用途。某地菱镁矿中主要含有 及少量
及少量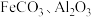 和
和 ,以菱镁矿等为原料制备镁和纯碱的工艺流程如图。
,以菱镁矿等为原料制备镁和纯碱的工艺流程如图。_______ (填“纯净物”或“混合物”)。
(2) 与盐酸反应的化学方程式为
与盐酸反应的化学方程式为_______ 。
(3)向饱和食盐水中通入 气体时,需加压通入的气体是
气体时,需加压通入的气体是_______ 。
(4)氨气还可用于处理酸性废水。工业上用氨气处理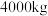 含有
含有 的质量分数为
的质量分数为 的酸性废水,反应原理为
的酸性废水,反应原理为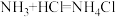 。理论上需要氨气的质量是多少?(写出计算过程)
。理论上需要氨气的质量是多少?(写出计算过程)
(5)反应③是无水 在熔融状态下,通电后反应生成
在熔融状态下,通电后反应生成 和
和 ,反应的化学方程式为
,反应的化学方程式为_______ ;反应②③均属于_______ 反应(填基本反应类型)。
(6)此工艺条件下金属离子开始沉淀和沉淀完全时的 如表。向a溶液中通入足量空气后,溶液中
如表。向a溶液中通入足量空气后,溶液中_______ 元素的化合价发生了改变;向b溶液中加入 调节溶液
调节溶液 ,所调
,所调 范围为
范围为_______ 。
 及少量
及少量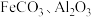 和
和 ,以菱镁矿等为原料制备镁和纯碱的工艺流程如图。
,以菱镁矿等为原料制备镁和纯碱的工艺流程如图。
(2)
 与盐酸反应的化学方程式为
与盐酸反应的化学方程式为(3)向饱和食盐水中通入
 气体时,需加压通入的气体是
气体时,需加压通入的气体是(4)氨气还可用于处理酸性废水。工业上用氨气处理
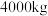 含有
含有 的质量分数为
的质量分数为 的酸性废水,反应原理为
的酸性废水,反应原理为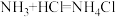 。理论上需要氨气的质量是多少?(写出计算过程)
。理论上需要氨气的质量是多少?(写出计算过程)(5)反应③是无水
 在熔融状态下,通电后反应生成
在熔融状态下,通电后反应生成 和
和 ,反应的化学方程式为
,反应的化学方程式为| 金属离子 |  |  |  |
开始沉淀的 | 8.9 | 3.4 | 1.5 |
沉淀完全的 | 10.9 | 4.7 | 2.8 |
(6)此工艺条件下金属离子开始沉淀和沉淀完全时的
 如表。向a溶液中通入足量空气后,溶液中
如表。向a溶液中通入足量空气后,溶液中 调节溶液
调节溶液 ,所调
,所调 范围为
范围为
您最近一年使用:0次
解题方法
2 . 化学实践小组的同学们在百二河五堰段取河水,设计了一系列实践活动,对水质检测、水的净化、水的组成进行了项目化学习。
任务一:检测水质
【查阅资料】
1.水的检测指标包括色度、浑浊度、气味、硬度、肉眼可见物等。检测方法包括看、闻、尝、品、查,更详细的指标需要通过精密的仪器测定。
2.同学们查阅了相关资料,了解到国家有关水的硬度的标准为:
(1)【初步检测】同学们取少量河水,用便携式水硬度检测仪测得该自来水的硬度为311.2 mg/L,说明该河水属于______ 。
任务二:净化水
河水转化为自来水需要经过一系列步骤,但是自来水送到用户过程中仍可能被污染,因此很多公共场所使用直饮机。______ 操作。
(3)活性炭滤芯具有______ 作用,除去颜色异味的同时也除去重金属离子。
(4)紫外线灯管照射是为了杀菌消毒。直饮机使用方便,只要将其与自来水管对接,截留清除水中的有害物质(如细菌,微生物等)便能得到直饮水,直饮水属于______ (选填“纯净物”或“混合物”)。
任务三:验证水的组成
兴趣小组同学利用下图所示装置进行电解水实验。______ 。
(6)以上实验可以证明水的组成,若要证明水的组成,还可以进行的实验方案是______ 。(含操作和现象)
【成果分享】通过实践小组的合作,同学们学到了水质检测的方法、了解净水机的原理,学习了根据“化学反应中元素种类不变"来探究物质的组成,今后可以通过化学手段对更多的物质进行探索。
任务一:检测水质
【查阅资料】
1.水的检测指标包括色度、浑浊度、气味、硬度、肉眼可见物等。检测方法包括看、闻、尝、品、查,更详细的指标需要通过精密的仪器测定。
2.同学们查阅了相关资料,了解到国家有关水的硬度的标准为:
| 类别 | 极软水 | 软水 | 中硬水 | 硬水 | 高硬水 |
| 以CaCO3浓度计/(mg/L) | 0~75 | 75 ~ 150 | 150 ~300 | 300 ~450 | 450~700 |
(1)【初步检测】同学们取少量河水,用便携式水硬度检测仪测得该自来水的硬度为311.2 mg/L,说明该河水属于
任务二:净化水
河水转化为自来水需要经过一系列步骤,但是自来水送到用户过程中仍可能被污染,因此很多公共场所使用直饮机。

(3)活性炭滤芯具有
(4)紫外线灯管照射是为了杀菌消毒。直饮机使用方便,只要将其与自来水管对接,截留清除水中的有害物质(如细菌,微生物等)便能得到直饮水,直饮水属于
任务三:验证水的组成
兴趣小组同学利用下图所示装置进行电解水实验。

(6)以上实验可以证明水的组成,若要证明水的组成,还可以进行的实验方案是
【成果分享】通过实践小组的合作,同学们学到了水质检测的方法、了解净水机的原理,学习了根据“化学反应中元素种类不变"来探究物质的组成,今后可以通过化学手段对更多的物质进行探索。
您最近一年使用:0次
2024-04-21更新
|
81次组卷
|
2卷引用:湖北省十堰市房县2023-2024学年九年级下学期期中检测化学试题
解题方法
3 . 宋代名作《千里江山图》是中华文化瑰宝之一。______ (填“稳定”或“不稳定”)
(2)矿石颜料之一赭石(主要成分为 )属赤铁矿,赤铁矿
)属赤铁矿,赤铁矿______ (填“是”或“不是”)金属材料,从物质分类来看,赤铁矿是______ (填“纯净物”或“混合物”)。
(3)金属铁的应用范围非常广泛。北宋张潜的《浸铜要略序》中有“山麓有胆泉(硫酸铜溶液),土人汲以浸铁。数日辄类朽木,刮取其屑,锻炼成铜”,即通过将铁浸入硫酸铜溶液的方法冶炼金属铜。若要炼得128kg金属铜,请计算理论上需要的铁的质量。(写出计算过程)

(2)矿石颜料之一赭石(主要成分为
 )属赤铁矿,赤铁矿
)属赤铁矿,赤铁矿(3)金属铁的应用范围非常广泛。北宋张潜的《浸铜要略序》中有“山麓有胆泉(硫酸铜溶液),土人汲以浸铁。数日辄类朽木,刮取其屑,锻炼成铜”,即通过将铁浸入硫酸铜溶液的方法冶炼金属铜。若要炼得128kg金属铜,请计算理论上需要的铁的质量。(写出计算过程)
您最近一年使用:0次
2024-02-18更新
|
114次组卷
|
2卷引用:广东省惠州市惠城区2023-2024学年九年级上学期期末化学试卷
解题方法
4 . 氧气和氧的化合物在工农业生产、生活中有广泛的应用。
(一)工业制O2
(1)工业上制取氧气的过程是______ 。(“物理变化”或“化学变化”)
(2)揭开盛有液态空气的容器盖,将燃着的木条置于瓶口上方,可观察到______(填字母)。
(3)工业制得的液氧属于______ 。(“纯净物”或“混合物”)
(二)生活中的O2
(4)某家庭制氧机上有湿化瓶装置。人吸氧时观察到瓶中有气泡。湿化瓶 装置类似于如图。关于该装置,下列说法不正确的有______(填字母)。

(三)渔业制O2运输活鱼时用过氧化钙(CaO2)可增加水中含氧量。
(5)小明提出下列猜想并用如图装置进行实验:

【 猜 想 】CaO2与H2O反应用于实验室制取O2。
【实验过程】
①______ (填一实验步骤);
②向试管中加入CaO2和H2O后,有极微量细小气泡缓慢放出。将导管伸入集气瓶中,几乎收集不到气体。放置到第二天,集气瓶中只收集到少量气体,震荡试管后仍有极微量细小气泡缓慢放出。
【实验结论】 CaO2与H2O反应______ (填“能”或“不能”)用于实验室制取O2。
【分析与反思】
③小明觉得储存CaO2,注意的问题有______ 。
④同学们对CaO2与H2O反应的生成物猜想如下:Ⅰ、氢氧化钙和O2 Ⅱ、碳酸钙和氧气
你认为猜想______ (填序号)一定是错误的,理由是______ 。
写出CaO2与H2O反应的表达式______ 。
(四)潜水员供O2
(6)潜水员使用的供氧装置是用过氧化钠(Na2O2)和呼出的CO2 反应生成碳酸钠(Na2CO3)和O2。写出该反应的表达式______ 。选择过氧化钠作供氧剂的优点是:①节约能源,②______ 。
(7)过氧化钠还可以与水反应。该小组组装了如图所示的装置,实验中还观察到,伸入烧杯中的导管有气泡冒出,其原因可能是______ 。

(一)工业制O2
(1)工业上制取氧气的过程是
(2)揭开盛有液态空气的容器盖,将燃着的木条置于瓶口上方,可观察到______(填字母)。
| A.木条熄灭 | B.木条燃烧更旺 |
(3)工业制得的液氧属于
(二)生活中的O2
(4)某家庭制氧机上有湿化瓶装置。人吸氧时观察到瓶中有气泡。湿化瓶 装置类似于如图。关于该装置,下列说法不正确的有______(填字母)。

| A.b导管连接制氧机 |
| B.b导管连接人吸O2的塑料管 |
| C.使用该装置可以观测是否有O2输出 |
| D.使用该装置可以观测O2输出的速率 |
(三)渔业制O2运输活鱼时用过氧化钙(CaO2)可增加水中含氧量。
(5)小明提出下列猜想并用如图装置进行实验:

【 猜 想 】CaO2与H2O反应用于实验室制取O2。
【实验过程】
①
②向试管中加入CaO2和H2O后,有极微量细小气泡缓慢放出。将导管伸入集气瓶中,几乎收集不到气体。放置到第二天,集气瓶中只收集到少量气体,震荡试管后仍有极微量细小气泡缓慢放出。
【实验结论】 CaO2与H2O反应
【分析与反思】
③小明觉得储存CaO2,注意的问题有
④同学们对CaO2与H2O反应的生成物猜想如下:Ⅰ、氢氧化钙和O2 Ⅱ、碳酸钙和氧气
你认为猜想
写出CaO2与H2O反应的表达式
(四)潜水员供O2
(6)潜水员使用的供氧装置是用过氧化钠(Na2O2)和呼出的CO2 反应生成碳酸钠(Na2CO3)和O2。写出该反应的表达式
(7)过氧化钠还可以与水反应。该小组组装了如图所示的装置,实验中还观察到,伸入烧杯中的导管有气泡冒出,其原因可能是

您最近一年使用:0次
解题方法
5 . 我国科学家发现了CO2高效转化新过程,首次把二氧化碳加氢“变”成汽油,这一技术有望减轻对传统化石能源的依赖。
(1)化石能源主要包含煤、石油、天然气,化石燃料属于___________ (填“纯净物”、“混合物”),在使用过程中排放出大量的CO2造成的环境问题是___________ 。
(2)植物通过___________ 吸收二氧化碳,生成葡萄糖和氧气,该过程___________ (填“是”、“否”)属于缓慢氧化。
(3)制氢、二氧化碳加氢制备汽油流程如下图
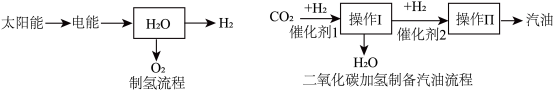
①制氢流程中生成H2和O2的质量比是___________ 。
②若汽油主要成分为C8H18,则二氧化碳加氢制备C8H18的化学式的表达式为___________ 。
(1)化石能源主要包含煤、石油、天然气,化石燃料属于
(2)植物通过
(3)制氢、二氧化碳加氢制备汽油流程如下图

①制氢流程中生成H2和O2的质量比是
②若汽油主要成分为C8H18,则二氧化碳加氢制备C8H18的化学式的表达式为
您最近一年使用:0次
解题方法
6 . 赣县区某地大理石储量丰富。某化学兴趣小组成员为了测定大理石中碳酸钙的质量分数,分别进行了如图的实验(杂质不溶于水也不与酸反应,过滤后滤渣损失忽略不计,氯化钙易溶于水)。

(1)从物质的分类上看,大理石属于______ (填“纯净物”或“混合物”。
(2)大理石中碳酸钙的质量分数是______ 。
(3)化学兴趣小组测定大理石的纯度过程中,生成二氧化碳的质量是多少______ ?(写出计算过程)
(4)实验过程中,小强同学得到的滤液浑浊,原因可能是______ 。

(1)从物质的分类上看,大理石属于
(2)大理石中碳酸钙的质量分数是
(3)化学兴趣小组测定大理石的纯度过程中,生成二氧化碳的质量是多少
(4)实验过程中,小强同学得到的滤液浑浊,原因可能是
您最近一年使用:0次
2024-02-07更新
|
47次组卷
|
2卷引用:江西省赣县区2023-2024学年九年级上学期期末化学试卷
解题方法
7 .  在医药上应用较广泛,它的水溶液俗称双氧水,见光、受热或有杂质等条件都会加速
在医药上应用较广泛,它的水溶液俗称双氧水,见光、受热或有杂质等条件都会加速 的分解。
的分解。
(1)双氧水属于________ (填“纯净物”或“混合物”),医疗上主要用于________ 。
(2)为进一步探究 催化分解的效果,某兴趣小组使用手持技术对质量分数为3%的
催化分解的效果,某兴趣小组使用手持技术对质量分数为3%的 溶液开展家庭实践活动,测得数据如题21图和表1所示。
溶液开展家庭实践活动,测得数据如题21图和表1所示。

表1 不同质量绿豆面催化过氧化氢相关实验数据的比较
ⅰ.由图可知,不同种类催化剂对 分解速率的影响效果是
分解速率的影响效果是________ (按由强到弱顺序回答)。
ⅱ.分析表1中实验数据可知,该实验中选用绿豆面且质量为________ g时的效果最佳。以绿豆而为催化剂,计算制取0.64g氧气所需过氧化氢的质量________ (写出具体过程,结果保留两位小数)。
ⅲ.若27.2mL某双氧水所含过氧化氢的质量与上述计算结果相同,该双氧水的密度为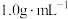 ,则其中过氧化氢的质量分数是
,则其中过氧化氢的质量分数是________ (保留一位小数)。
 在医药上应用较广泛,它的水溶液俗称双氧水,见光、受热或有杂质等条件都会加速
在医药上应用较广泛,它的水溶液俗称双氧水,见光、受热或有杂质等条件都会加速 的分解。
的分解。(1)双氧水属于
(2)为进一步探究
 催化分解的效果,某兴趣小组使用手持技术对质量分数为3%的
催化分解的效果,某兴趣小组使用手持技术对质量分数为3%的 溶液开展家庭实践活动,测得数据如题21图和表1所示。
溶液开展家庭实践活动,测得数据如题21图和表1所示。
表1 不同质量绿豆面催化过氧化氢相关实验数据的比较
 溶液的体积/mL 溶液的体积/mL | 催化剂质量/g | 压强最大值/kPa |
| 10 | 0.6 | 125.2 |
| 10 | 0.8 | 130.2 |
| 10 | 1.0 | 134.8 |
| 10 | 1.2 | 139.0 |
| 10 | 1.4 | 140.5 |
| 10 | 1.6 | 136.5 |
| 10 | 1.8 | 132.7 |
 分解速率的影响效果是
分解速率的影响效果是ⅱ.分析表1中实验数据可知,该实验中选用绿豆面且质量为
ⅲ.若27.2mL某双氧水所含过氧化氢的质量与上述计算结果相同,该双氧水的密度为
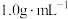 ,则其中过氧化氢的质量分数是
,则其中过氧化氢的质量分数是
您最近一年使用:0次
23-24九年级下·江苏无锡·开学考试
解题方法
8 . CO2对人类生存、生活有着重大影响,CO2的捕集与资源化利用是化学研究的热点。
(1)2021年9月24日,《科学》在线发表了我团科研人员在国际上首次实现了二氧化碳到淀粉的从头合成。请分析“搭积木”式的合成路线图,回答有关问题。
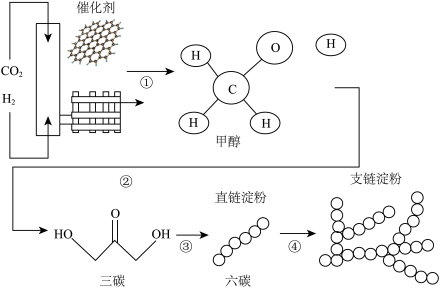
①在自然界中绿色植物将二氧化碳转化为淀粉和氧气的过程称为______ 。
②写出如图中①中反应生成甲醇(CH3OH)和水的化学方程式______ 。
③淀粉(C6H10O5)n中氢和氧元素的质量比为______ 。
④实验分析表明人工合成的淀粉与天然淀粉非常接近,该项研究成果的实际应用价值______ (填序号)。
A.可以降低空气中二氧化碳的含量
B.缓解人类粮食短缺问题
C.可以节约耕地资源
(2)“碳捕获”并封存被认为是目前减缓全球变暖最经济可行的方式。小张同学利用化学知识,为净化空气,设计了一个简易CO2捕捉器,其捕捉CO2的流程如图2所示。
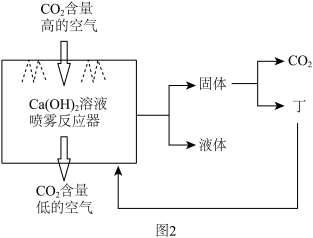
①捕捉CO2的原理______ (用化学方程式表示)。
②从能源角度分析该流程存在的不足是______ 。
(3)超临界CO2是指温度与压强达到一定值时,CO2形成气态与液态交融在一起的流体,超临界CO2流体和水相似,溶解能力强,被誉为“绿色环保溶剂”。超临界CO2流体的说法正确的是______(填序号)。
(1)2021年9月24日,《科学》在线发表了我团科研人员在国际上首次实现了二氧化碳到淀粉的从头合成。请分析“搭积木”式的合成路线图,回答有关问题。

①在自然界中绿色植物将二氧化碳转化为淀粉和氧气的过程称为
②写出如图中①中反应生成甲醇(CH3OH)和水的化学方程式
③淀粉(C6H10O5)n中氢和氧元素的质量比为
④实验分析表明人工合成的淀粉与天然淀粉非常接近,该项研究成果的实际应用价值
A.可以降低空气中二氧化碳的含量
B.缓解人类粮食短缺问题
C.可以节约耕地资源
(2)“碳捕获”并封存被认为是目前减缓全球变暖最经济可行的方式。小张同学利用化学知识,为净化空气,设计了一个简易CO2捕捉器,其捕捉CO2的流程如图2所示。

①捕捉CO2的原理
②从能源角度分析该流程存在的不足是
(3)超临界CO2是指温度与压强达到一定值时,CO2形成气态与液态交融在一起的流体,超临界CO2流体和水相似,溶解能力强,被誉为“绿色环保溶剂”。超临界CO2流体的说法正确的是______(填序号)。
| A.它是混合物 | B.它的化学性质与普通二氧化碳相同 |
| C.它的分子不再运动 | D.它可代替许多有害、有毒、易燃的溶剂 |
您最近一年使用:0次
名校
解题方法
9 . 2023 年 5 月 30 日,神舟十六号载人飞船发射成功,航天员将在中国空间站完成各项任务,因此,保障航天员的氧气需求至关重要。那么,空间站的氧气从哪里来?
Ⅰ.从地球带上去
(1)航天工业以空气为原料制氧,与实验室制氧气相比较,工业上选择空气制氧气的主要原因是_______ 。
(2)工业上采用分离液态空气法获得氧气,其过程可用如图所示实验模拟。
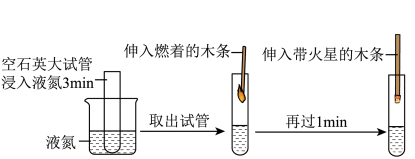
①上述实验利用氮气与氧气的_______ (“密度”、“沸点”)不同实现分离,工业制得的液氧是 _______ (“纯净物”“混合物”)。
②浸入液氮 3min 后,试管内产生约占其容积1/3 的液态空气。取出试管,液态空气沸腾,伸入燃着的木条,木条熄灭;1min 后伸入带火星的木条,观察到木条复燃。导致木条熄灭的原因是________ 。
(3)利用分子筛可将氧分子从空气中“筛”出去,从而获得高浓度的氧气。其原理示意图如图所示:
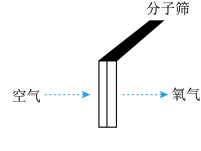
由此可知两种分子的大小:N2_______ (填“>”或“<”)O2。
Ⅱ.在天宫制出来
(4)早期空间站利用过氧化钠(Na2O2)、超氧化钾(KO2)等物质制氧,其原理表示如下: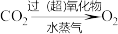 ,空间站内二氧化碳的主要来源是
,空间站内二氧化碳的主要来源是_______ 。
(5)目前空间站已实现电解水制氧,写出反应的化学方程式:_______ ,氧气出现在电极的_______ (“正极”“负极”)上。
(6)空间站是一个相对封闭的场所,解决“气体从哪里来”的问题必然伴生着“气体往哪里去”的问题。为此,科学家设计了生物再生生命保障系统,实现了“水﹣氧﹣碳”的循环转化。如图是空间站内常用水气整合系统的工作原理流程图。
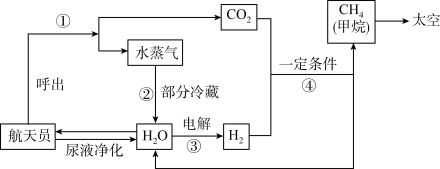
过程①:航天员呼出的 CO2 可用分子筛设备分离出来,其原理类似于实验室中的______ 操作。
过程②:航天员呼出的水蒸气经冷凝、净化后可以作为核心舱中的饮用水,水蒸气冷凝为水的微观实质是_______ 。
过程④:仔细观察图示箭头,二氧化碳和氢气发生反应的化学方程式为_______ 。
(7)由上述流程图可知,空间站通过物质循环获得水的途径共有_______ 条。
(8)下列叙述正确的是_______ (填序号)。
a.“水﹣氧﹣碳”的循环转化,减少了氧气的携带量,减轻了火箭和飞船的载重
b.电解水在产生氧气的同时产生氢气,系统需要对氢气进行转化
c.人体代谢产物中的水既有气态又有液态,设计系统时应考虑水的冷凝与净化
Ⅰ.从地球带上去
(1)航天工业以空气为原料制氧,与实验室制氧气相比较,工业上选择空气制氧气的主要原因是
(2)工业上采用分离液态空气法获得氧气,其过程可用如图所示实验模拟。

①上述实验利用氮气与氧气的
②浸入液氮 3min 后,试管内产生约占其容积1/3 的液态空气。取出试管,液态空气沸腾,伸入燃着的木条,木条熄灭;1min 后伸入带火星的木条,观察到木条复燃。导致木条熄灭的原因是
(3)利用分子筛可将氧分子从空气中“筛”出去,从而获得高浓度的氧气。其原理示意图如图所示:

由此可知两种分子的大小:N2
Ⅱ.在天宫制出来
(4)早期空间站利用过氧化钠(Na2O2)、超氧化钾(KO2)等物质制氧,其原理表示如下:
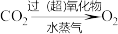 ,空间站内二氧化碳的主要来源是
,空间站内二氧化碳的主要来源是(5)目前空间站已实现电解水制氧,写出反应的化学方程式:
(6)空间站是一个相对封闭的场所,解决“气体从哪里来”的问题必然伴生着“气体往哪里去”的问题。为此,科学家设计了生物再生生命保障系统,实现了“水﹣氧﹣碳”的循环转化。如图是空间站内常用水气整合系统的工作原理流程图。

过程①:航天员呼出的 CO2 可用分子筛设备分离出来,其原理类似于实验室中的
过程②:航天员呼出的水蒸气经冷凝、净化后可以作为核心舱中的饮用水,水蒸气冷凝为水的微观实质是
过程④:仔细观察图示箭头,二氧化碳和氢气发生反应的化学方程式为
(7)由上述流程图可知,空间站通过物质循环获得水的途径共有
(8)下列叙述正确的是
a.“水﹣氧﹣碳”的循环转化,减少了氧气的携带量,减轻了火箭和飞船的载重
b.电解水在产生氧气的同时产生氢气,系统需要对氢气进行转化
c.人体代谢产物中的水既有气态又有液态,设计系统时应考虑水的冷凝与净化
您最近一年使用:0次
解题方法
10 . 化学的基本特征是研究和创造物质。试从科学家认识物质的视角认识 。
。
(1)分类角度
 属于
属于______ (填“纯净物”或“混合物”)。
(2)性质角度
如左下图甲所示,探究二氧化碳的性质。(a、d为浸有紫色石蕊试液的湿润棉花,b、c为用紫色石蕊试液浸过的干燥棉花。)
①可验证二氧化碳的密度比空气大的现象是______ 。
②对比c、d处的实验现象,可得出的结论是______ 。

(3)变化角度
如右上图所示,是某同学整理的物质转化图(“反应物→生成物”箭头的方向表示反应的方向);
①实验室中常用反应______ (填“Ⅰ”或“Ⅱ”或“Ⅲ”)制取 气体。
气体。
②请写出反应“Ⅰ”的文字(或符号)表达式:______ 。
(4)应用角度
①用于灭火,是利用二氧化碳______ 的性质。
②用作粮食、蔬菜、瓜果的保护气,这是因为二氧化碳不能供给______ 。
(5)环保角度
全球参与控制 的排放量是防止温室效应进一步增强的根本对策。下列限制
的排放量是防止温室效应进一步增强的根本对策。下列限制 排放量的做法不合理的是
排放量的做法不合理的是______ (填字母)。
a.制定旨在限制 排放的国际规定
排放的国际规定
b.工厂通过加高烟囱直接排放含 的废气
的废气
c.减少化石能源(含碳元素)的使用,开发太阳能等新能源
 。
。(1)分类角度
 属于
属于(2)性质角度
如左下图甲所示,探究二氧化碳的性质。(a、d为浸有紫色石蕊试液的湿润棉花,b、c为用紫色石蕊试液浸过的干燥棉花。)
①可验证二氧化碳的密度比空气大的现象是
②对比c、d处的实验现象,可得出的结论是

(3)变化角度
如右上图所示,是某同学整理的物质转化图(“反应物→生成物”箭头的方向表示反应的方向);
①实验室中常用反应
 气体。
气体。②请写出反应“Ⅰ”的文字(或符号)表达式:
(4)应用角度
①用于灭火,是利用二氧化碳
②用作粮食、蔬菜、瓜果的保护气,这是因为二氧化碳不能供给
(5)环保角度
全球参与控制
 的排放量是防止温室效应进一步增强的根本对策。下列限制
的排放量是防止温室效应进一步增强的根本对策。下列限制 排放量的做法不合理的是
排放量的做法不合理的是a.制定旨在限制
 排放的国际规定
排放的国际规定b.工厂通过加高烟囱直接排放含
 的废气
的废气c.减少化石能源(含碳元素)的使用,开发太阳能等新能源
您最近一年使用:0次



