1 . 如图是实验室中常见气体制备、净化、干燥、收集和性质实验,某化学小组的同学利用以下装置进行探究实验:
①制取氢气时发生的化学方程式为_______ 。
②所选仪器的连接顺序为_______ (从左至右填写仪器序号字母)。
③反应结束后,发生装置中溶液的质量比加入稀硫酸的质量增加,原因是_______ 。
(2)以过氧化氢为原料(二氧化锰作催化剂),在实验室中制取氧气,并用来测定某固体试样的组成比例,该固体试样由铜粉、碳粉和少量杂质组成。所选仪器按下列顺序连接:A→B→D→C→碱石灰干燥管。试回答下列问题:
①写出实验室中制取氧气的化学方程式_______ 。
②装置C的作用是_______ 。
③反应前大玻璃管中固体试样的质量为wg,通入氧气充分反应后;测得D中大玻璃管中剩余固体的质量为wg,装置C的质量增加了ag。试推算该固体样品中铜粉的质量分数为_______ ×100%(用含w和a的式子表示)。
(3)乙组同学以过氧化氢溶液为原料(MnO2为催化剂)制备氧气,并对某有机物固体样品(CxHy)的组成进行成分探究,所选仪器按“A→B1→D→B2→C→碱石灰干燥管”的顺序连接,(B1,B2为浓硫酸洗气瓶),实验前检验装置气密性,所设计的实验装置中气体流向是从左向右。使该有机物固体样品在纯氧气中充分燃烧,观察现象,收集有关实验数据,试回答下列问题:
①若装置中没有连接仪器B1,利用C的质量变化测算样品中碳元素的质量将_______ (填“偏小”“偏大”“基本一致”之一)。
②反应前大玻璃管中CxHy的质量为ag,有机物样品充分燃烧后,测得仪器B2的质量增加了bg,试推算该有机物(CxHy)中碳元素和氢元素的质量比_______ 。
(4)用一氧化碳气体(含少量水蒸气)测定某铁的氧化物(FexOy)的元素组成比例,并验证气体生成物的性质。所选仪器按混合气体→B1→D→C→B2顺序连接(B1、B2为浓硫酸洗气瓶)。
①反应前大玻璃管中加入铁的粉末状氧化物(FexOy)试样的质量为14.4g,实验结束后,继续通入一氧化碳气体,直至大玻璃管冷却。这时测量到C装置的质量增加了8.8g,试推算该铁的氧化物的化学式中x、y的比值为_______ 。
②上述实验中,除了利用C装置的质量增加来进行推算该铁的氧化物的化学式,还可以利用_______ 的质量变化来推算。
③请你指出该实验的不完善之处_______ 。

①制取氢气时发生的化学方程式为
②所选仪器的连接顺序为
③反应结束后,发生装置中溶液的质量比加入稀硫酸的质量增加,原因是
(2)以过氧化氢为原料(二氧化锰作催化剂),在实验室中制取氧气,并用来测定某固体试样的组成比例,该固体试样由铜粉、碳粉和少量杂质组成。所选仪器按下列顺序连接:A→B→D→C→碱石灰干燥管。试回答下列问题:
①写出实验室中制取氧气的化学方程式
②装置C的作用是
③反应前大玻璃管中固体试样的质量为wg,通入氧气充分反应后;测得D中大玻璃管中剩余固体的质量为wg,装置C的质量增加了ag。试推算该固体样品中铜粉的质量分数为
(3)乙组同学以过氧化氢溶液为原料(MnO2为催化剂)制备氧气,并对某有机物固体样品(CxHy)的组成进行成分探究,所选仪器按“A→B1→D→B2→C→碱石灰干燥管”的顺序连接,(B1,B2为浓硫酸洗气瓶),实验前检验装置气密性,所设计的实验装置中气体流向是从左向右。使该有机物固体样品在纯氧气中充分燃烧,观察现象,收集有关实验数据,试回答下列问题:
①若装置中没有连接仪器B1,利用C的质量变化测算样品中碳元素的质量将
②反应前大玻璃管中CxHy的质量为ag,有机物样品充分燃烧后,测得仪器B2的质量增加了bg,试推算该有机物(CxHy)中碳元素和氢元素的质量比
(4)用一氧化碳气体(含少量水蒸气)测定某铁的氧化物(FexOy)的元素组成比例,并验证气体生成物的性质。所选仪器按混合气体→B1→D→C→B2顺序连接(B1、B2为浓硫酸洗气瓶)。
①反应前大玻璃管中加入铁的粉末状氧化物(FexOy)试样的质量为14.4g,实验结束后,继续通入一氧化碳气体,直至大玻璃管冷却。这时测量到C装置的质量增加了8.8g,试推算该铁的氧化物的化学式中x、y的比值为
②上述实验中,除了利用C装置的质量增加来进行推算该铁的氧化物的化学式,还可以利用
③请你指出该实验的不完善之处
您最近一年使用:0次
2 . 下列图像分别与选项中的操作相对应,其中合理的是
A. 向一定量CuCl2溶液中加入一定量的铁 向一定量CuCl2溶液中加入一定量的铁 |
B. 向足量的锌、铁中分别加入等质量等质量分数的稀盐酸 向足量的锌、铁中分别加入等质量等质量分数的稀盐酸 |
C.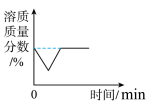 一定温度时,向一定量的不饱和石灰水中加入少量生石灰,再恢复至原温 一定温度时,向一定量的不饱和石灰水中加入少量生石灰,再恢复至原温 |
D.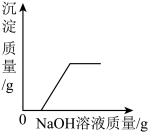 向FeCl3和HCl的混合溶液中加入足量NaOH溶液 向FeCl3和HCl的混合溶液中加入足量NaOH溶液 |
您最近一年使用:0次
名校
解题方法
3 . 氢气的开发利用是氢能研究的热点。
Ⅰ.氢气的发现和制备
(1)1766年,英国科学家卡文迪许用锌与稀硫酸作用,制得了可燃性的氢气。1785年,拉瓦锡将水蒸气通过红热的铁制枪管将水转化为氢气,同时生成四氧化三铁。写出该反应的化学方程式_______ 。1800年,英国化学家尼科尔森通过电解水获得氢气。
(2)目前制氢的方法主要有电解水制氢。电解水制氢中,使用氚进行核能发电,图1能表示氚的原子结构,氚原子与氢原子的区别是_______ 不同。_______ 。
②“分离”的目的是_______ 。
Ⅱ.氢气的贮存和释放
(4)Mg2Cu是镁铜按一定质量比融合而成的合金。Mg2Cu可用于化学储氢,其贮氢与释氢过程如图3所示。_______ 。
②释氢发生反应的化学方程式为_______ 。
Ⅲ.氢气在工业生产中的应用
(5)合成氨工艺需要用到氢气,在铁触媒作用下,用体积比为1:3的氮气和氢气合成氨气。
①N2是合成氨的重要原料。工业上可从空气中获得N2,利用空气中各成分的_______ 不同将空气成分进行分离。
Fe3O4是铁触媒的主要成分。合成氨催化过程中因部分Fe3O4与H2反应使催化剂“失效”。在一定温度下可用O2将其“再生”。图5是Fe3O4在失效和再生过程中的质量与时间变化的关系图。_______ (选填“变大”“变小”或“不变”)。
③T1∼T2℃时,FeO转化为Fe3O4,T3∼T4℃时,Fe3O4转化为Fe2O3。M=_______ 。
④A点固体中m(FeO):m(Fe3O4)=_______ 。
Ⅰ.氢气的发现和制备
(1)1766年,英国科学家卡文迪许用锌与稀硫酸作用,制得了可燃性的氢气。1785年,拉瓦锡将水蒸气通过红热的铁制枪管将水转化为氢气,同时生成四氧化三铁。写出该反应的化学方程式
(2)目前制氢的方法主要有电解水制氢。电解水制氢中,使用氚进行核能发电,图1能表示氚的原子结构,氚原子与氢原子的区别是


②“分离”的目的是
Ⅱ.氢气的贮存和释放
(4)Mg2Cu是镁铜按一定质量比融合而成的合金。Mg2Cu可用于化学储氢,其贮氢与释氢过程如图3所示。

②释氢发生反应的化学方程式为
Ⅲ.氢气在工业生产中的应用
(5)合成氨工艺需要用到氢气,在铁触媒作用下,用体积比为1:3的氮气和氢气合成氨气。
①N2是合成氨的重要原料。工业上可从空气中获得N2,利用空气中各成分的
Fe3O4是铁触媒的主要成分。合成氨催化过程中因部分Fe3O4与H2反应使催化剂“失效”。在一定温度下可用O2将其“再生”。图5是Fe3O4在失效和再生过程中的质量与时间变化的关系图。

③T1∼T2℃时,FeO转化为Fe3O4,T3∼T4℃时,Fe3O4转化为Fe2O3。M=
④A点固体中m(FeO):m(Fe3O4)=
您最近一年使用:0次
解题方法
4 . 向一定质量的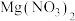 、
、 和
和 的混合溶液中加入一定量的Zn粉,过滤后,向滤渣中再加入一定质量的稀硫酸,反应图象如图所示,下列说法正确的是
的混合溶液中加入一定量的Zn粉,过滤后,向滤渣中再加入一定质量的稀硫酸,反应图象如图所示,下列说法正确的是
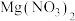 、
、 和
和 的混合溶液中加入一定量的Zn粉,过滤后,向滤渣中再加入一定质量的稀硫酸,反应图象如图所示,下列说法正确的是
的混合溶液中加入一定量的Zn粉,过滤后,向滤渣中再加入一定质量的稀硫酸,反应图象如图所示,下列说法正确的是
| A.M的值为28.0 | B.b点溶液中的溶质有三种 |
C.从b点到c点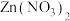 的质量增加 的质量增加 | D.d点含有的固体只有Cu和Ag |
您最近一年使用:0次
2024-06-03更新
|
50次组卷
|
3卷引用:2024年山东省潍坊市昌邑市二模化学试题
名校
解题方法
5 . 下列是相关物质的转化图,(“→”表示反应一步实现,部分物质和反应条件已略去)。下列说法错误的是
Cu Cu(NO3)2
Cu(NO3)2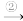 Mg(NO3)2
Mg(NO3)2 MgSO4
MgSO4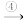 Mg(OH)2
Mg(OH)2
Cu
 Cu(NO3)2
Cu(NO3)2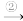 Mg(NO3)2
Mg(NO3)2 MgSO4
MgSO4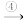 Mg(OH)2
Mg(OH)2| A.反应①可以是置换反应 |
| B.反应②可以证明Mg活动性强于Cu |
| C.反应③不能一步实现 |
| D.反应④可能是MgSO4+Cu(OH)2=Mg(OH)2↓+CuSO4 |
您最近一年使用:0次
名校
6 . 如图所示的四个图像,能正确反映对应变化关系的是
A. 向等质量的碳酸钙和碳酸钠中分别加入过量的等浓度的盐酸,a曲线表示碳酸钠,b曲线表示碳酸钙 向等质量的碳酸钙和碳酸钠中分别加入过量的等浓度的盐酸,a曲线表示碳酸钠,b曲线表示碳酸钙 |
B. 等质量、等质量分数的H2SO4溶液与NaOH溶液混合 等质量、等质量分数的H2SO4溶液与NaOH溶液混合 |
C.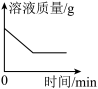 一定量的稀硫酸中插入铁丝 一定量的稀硫酸中插入铁丝 |
D.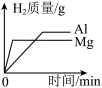 向相同质量和相同质量分数的稀硫酸中,分别加入过量的镁粉和铝粉 向相同质量和相同质量分数的稀硫酸中,分别加入过量的镁粉和铝粉 |
您最近一年使用:0次
解题方法
7 . 在溶质为Cu(NO3)2、AgNO3和Al(NO3)3的混合溶液中加入一定量的锌粉,充分反应后过滤,得到滤渣和蓝色滤液。下列判断正确的是
| A.滤液中一定没有AgNO3 | B.滤液中可能有四种金属离子 |
| C.滤渣中一定有Ag,一定没有Cu、Zn和Al | D.向滤渣中加入稀盐酸可能有气泡产生 |
您最近一年使用:0次
解题方法
8 . 下列实验方案设计不正确的是
| 选项 | 实验目的 | 实验方案 |
| A | 鉴别N2和O2 | 将燃着的木条分别伸入集气瓶中 |
| B | 鉴别K2SO4和(NH4)2SO4 | 取样,分别加入熟石灰,研磨,闻气味 |
| C | 除去NaCl溶液中混有少量的MgCl2 | 加入适量KOH溶液,振荡、静置、过滤 |
| D | 除去FeCl2溶液中的CuCl2 | 加入足量的铁粉,充分反应后过滤 |
| A.A | B.B | C.C | D.D |
您最近一年使用:0次
解题方法
9 . 从古至今,铁及其化合物一直被人类广泛应用。
(一)铁及其化合物的应用
①“其器冶铁锥,其尖使极刚利”,“铁锥”为开挖盐井的工具。所取盐井水“入于釜中煎炼顷刻结盐”,“金”指生铁制作的铁锅。
②“泥固塞其孔,然后使水转釉”是指高温下CO将红砖中的Fe2O3转化为Fe3O4而形成青砖。该转化的化学方程式为_______ 。
(2)铁的化合物在现代更多领域发挥着重要作用。
①碳酸亚铁(FeCO3)不溶于水,可作补血剂,服用后与胃酸反应生成_______ 被人体吸收,促进血红蛋白的生成。
②火星探测器发回的信息表明,火星上存在FeOOH,从而证明火星表面曾经存在过水,其理由为_______ 。
③活性FeOOH可除去石油开采过程中的有害气体H2S,并获得S,原理如下。_______ ,再生时发生反应的化学方程式为_______ 。
(二)FeOOH的制备
用废铁屑(主要成分为Fe,含少量Fe2O3和FeCO3)制备FeOOH主要流程如图。_______ 。
(4)还原发生的反应为Fe2(SO4)3+Fe=3FeSO4。沉淀发生的反应为2FeSO4+H2O2+2H2O=2FeOOH↓+2H2SO4。沉淀时反应温度不宜太高,原因是_______ 。
(5)沉淀时会有部分FeOOH与FeSO4反应生成Fe3O4,反应的化学方程式为_______ 。
(三)FeOOH的含量测定
已知:FeOOH及铁的氧化物加热分解的温度如图。_______ %(精确到0.1%)。
(7)当加热到T4℃时,M点固体的成分是_______ ,对应的质量比为_______ 。
(一)铁及其化合物的应用

①“其器冶铁锥,其尖使极刚利”,“铁锥”为开挖盐井的工具。所取盐井水“入于釜中煎炼顷刻结盐”,“金”指生铁制作的铁锅。
②“泥固塞其孔,然后使水转釉”是指高温下CO将红砖中的Fe2O3转化为Fe3O4而形成青砖。该转化的化学方程式为
(2)铁的化合物在现代更多领域发挥着重要作用。
①碳酸亚铁(FeCO3)不溶于水,可作补血剂,服用后与胃酸反应生成
②火星探测器发回的信息表明,火星上存在FeOOH,从而证明火星表面曾经存在过水,其理由为
③活性FeOOH可除去石油开采过程中的有害气体H2S,并获得S,原理如下。
FeOOH Fe2S3·H2O
Fe2S3·H2O FeOOH+S
FeOOH+S
(二)FeOOH的制备
用废铁屑(主要成分为Fe,含少量Fe2O3和FeCO3)制备FeOOH主要流程如图。

(4)还原发生的反应为Fe2(SO4)3+Fe=3FeSO4。沉淀发生的反应为2FeSO4+H2O2+2H2O=2FeOOH↓+2H2SO4。沉淀时反应温度不宜太高,原因是
(5)沉淀时会有部分FeOOH与FeSO4反应生成Fe3O4,反应的化学方程式为
(三)FeOOH的含量测定
已知:FeOOH及铁的氧化物加热分解的温度如图。
FeOOH Fe2O3
Fe2O3 Fe3O4
Fe3O4 FeO
FeO

(7)当加热到T4℃时,M点固体的成分是
您最近一年使用:0次
10 . 某工厂烟气中含N2、O2、SO2等气体,现利用“脱硫”装置除去烟气中的SO2其原理为2SO2+O2+2H2O 2H2SO4。开始时向装置中加入一定量的FeSO4溶液,并加入适量铁粉。保持其他条件相同,反应过程中吸收液的起始温度对脱硫率和吸收液pH的影响如图所示。下列说法正确的是
2H2SO4。开始时向装置中加入一定量的FeSO4溶液,并加入适量铁粉。保持其他条件相同,反应过程中吸收液的起始温度对脱硫率和吸收液pH的影响如图所示。下列说法正确的是
 2H2SO4。开始时向装置中加入一定量的FeSO4溶液,并加入适量铁粉。保持其他条件相同,反应过程中吸收液的起始温度对脱硫率和吸收液pH的影响如图所示。下列说法正确的是
2H2SO4。开始时向装置中加入一定量的FeSO4溶液,并加入适量铁粉。保持其他条件相同,反应过程中吸收液的起始温度对脱硫率和吸收液pH的影响如图所示。下列说法正确的是
| A.“脱硫”一段时间后,FeSO4溶液的浓度不变 |
| B.每脱除128gSO2,溶液中会增加196g的H2SO4 |
| C.Fe粉使脱硫过程中溶液pH能稳定在5.5左右 |
| D.升温后脱硫反应速率增大导致脱硫率逐渐降低 |
您最近一年使用:0次



