解题方法
1 . 《天工开物》记载“凡钟为金乐之首”,在古代的金属乐器之中,钟是最重要的乐器。铸钟的材料,铜为上等,铁为下等。金属和金属材料在生产和生活中有着广泛的应用。请完成有关金属性质的实验。
Ⅰ.金属的物理性质
(1)铁是应用最广泛的金属.生活中用铁锅做饮具,主要利用铁的______ 性;
Ⅱ.金属的化学性质
(2)将稀盐酸滴加到装有铁、铜的试管中
①一种金属和酸不反应的理由______ ;
②另一种金属与酸反应的现象______ 。
Ⅲ.探究金属的活动性强弱
(3)①有X、Y、Z三种金属,它们具有如下性质:
a.X、Z均不与稀盐酸反应
b.
c.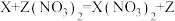
则X、Y、Z三种金属活动性由强到弱的顺序是______ ;
②在氯化铜和氯化亚铁的混合溶液中加入一定量的镁粉,充分反应后过滤,得到滤渣和滤液,向滤渣中滴加稀盐酸,有气泡产生,则滤渣中一定含有的物质是______ (填化学式)。
Ⅳ.某工厂欲从含有 的废液中回收金属铜,并得到工业原料硫酸亚铁,其工业流程如图:
的废液中回收金属铜,并得到工业原料硫酸亚铁,其工业流程如图:______ 。
(5)加入过量A物质的化学式是______ 。
(6)加入适B物质时反应的化学方程式是______ 。
Ⅴ.据有关资料报道,世界上每年因腐蚀而报废的金属设备或材料相当于年产量的20%~40%。
(7)炼铁时焦炭的作用______ ,回收报废金属的意义______ 。
(8)请写出自行车链条防止生锈的方法______ 。
Ⅰ.金属的物理性质
(1)铁是应用最广泛的金属.生活中用铁锅做饮具,主要利用铁的
Ⅱ.金属的化学性质
(2)将稀盐酸滴加到装有铁、铜的试管中
①一种金属和酸不反应的理由
②另一种金属与酸反应的现象
Ⅲ.探究金属的活动性强弱
(3)①有X、Y、Z三种金属,它们具有如下性质:
a.X、Z均不与稀盐酸反应
b.

c.
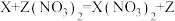
则X、Y、Z三种金属活动性由强到弱的顺序是
②在氯化铜和氯化亚铁的混合溶液中加入一定量的镁粉,充分反应后过滤,得到滤渣和滤液,向滤渣中滴加稀盐酸,有气泡产生,则滤渣中一定含有的物质是
Ⅳ.某工厂欲从含有
 的废液中回收金属铜,并得到工业原料硫酸亚铁,其工业流程如图:
的废液中回收金属铜,并得到工业原料硫酸亚铁,其工业流程如图:
(5)加入过量A物质的化学式是
(6)加入适B物质时反应的化学方程式是
Ⅴ.据有关资料报道,世界上每年因腐蚀而报废的金属设备或材料相当于年产量的20%~40%。
(7)炼铁时焦炭的作用
(8)请写出自行车链条防止生锈的方法
您最近一年使用:0次
2 . 水是一种重要的物质,在日常生活和生产实践中有着不可替代的作用。
(1)水的净化______ 性。
②图2为水的蒸馏装置图,图1与图2的净水原理中,能降低水硬度的净水方法是图_______ (填“1”或“2”)。
③我国人均淡水资源处于紧缺状态,保护水资源是我们每个公民的责任。为了践行“保护水资源”理念,你在生活中的做法为:_______ 。
(2)水的组成_______ (填物质名称),该反应的化学方程式为_______ 。
②电解水的实验中,在玻璃管里加含有酚酞的硫酸钠溶液(硫酸钠溶液呈中性),在实验过程中,观察到管a电极附近的溶液迅速变红,则该处溶液呈______ (填“酸”“碱”或“中”)性。电解后,待溶液混合均匀后测得溶液的pH=7。电解结束后,硫酸钠溶液溶质质量分数与电解前相比_______ (填“增大”、“减小”或“不变”);图4中能表示电解时,管b电极端变化的结果的是_______ (填对应选项的字母)。
(3)水在化学实验中具有重要作用_______ 。打开K,观察到导管内液面下降,导管口有气泡出,该气体是_______ 。(填化学式)
②如图6所示实验中,证明CO2能与水反应的现象是_______ ;因此实验后瓶中澄清石灰水变浑浊,此变化属于______ (填“物理变化”或“化学变化”)。
③如图7所示实验中,一段时间后,缓慢倾斜Y型管,将右侧的稀硫酸部分倒入左侧,依据_______ (填实验现象),可得出金属活动性:Zn>Cu。
(4)空气中的水蒸气的吸收
①生石灰可以用作食品干燥剂,原理是______ 。(写化学反应方程式)
②实验室中常用烧碱和生石灰按照一定比例混合成碱石灰,用做气体干燥剂,碱石灰可以干燥的气体有______ 。(填字母序号)
A.O2 B.H2 C.CO2 D.N2 E.SO2
(1)水的净化
②图2为水的蒸馏装置图,图1与图2的净水原理中,能降低水硬度的净水方法是图
③我国人均淡水资源处于紧缺状态,保护水资源是我们每个公民的责任。为了践行“保护水资源”理念,你在生活中的做法为:
(2)水的组成

②电解水的实验中,在玻璃管里加含有酚酞的硫酸钠溶液(硫酸钠溶液呈中性),在实验过程中,观察到管a电极附近的溶液迅速变红,则该处溶液呈
(3)水在化学实验中具有重要作用

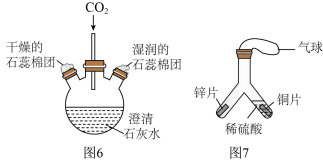
②如图6所示实验中,证明CO2能与水反应的现象是
③如图7所示实验中,一段时间后,缓慢倾斜Y型管,将右侧的稀硫酸部分倒入左侧,依据
(4)空气中的水蒸气的吸收
①生石灰可以用作食品干燥剂,原理是
②实验室中常用烧碱和生石灰按照一定比例混合成碱石灰,用做气体干燥剂,碱石灰可以干燥的气体有
A.O2 B.H2 C.CO2 D.N2 E.SO2
您最近一年使用:0次
解题方法
3 . 金属材料的使用作为一个时代的标志,见证了人类文明发展的过程。
【金属的信息】
如图1、2是钠的相关信息。回答以下问题:_______ 。
(2)图2为钠的某种微粒结构示意图,该微粒的符号为_______ 。
【金属的性质】
(3)填写表格:
【金属发生化学反应的判断】
从“反应物的消耗”和“生成物的检验”两个角度可以对金属是否发生化学反应进行验证。
(4)反应物的消耗:称量0.650g铜粉置于密闭的容器中加热,并用氧气传感器测量密闭容器内氧气的含量从20.99%降低至6.15%,实验结束后将粉末取出,称量其质量_______ (填“大于”“小于”或“等于”)0.650g。
(5)生成物的检验:将(4)反应后得到的黑色粉末放入试管中,加入足量稀硫酸并加热,产生_______ 现象,证明黑色粉末是氧化铜。
【金属含量的测定】
(6)铜锌合金又称“假黄金”。取40g“假黄金”样品,磨成粉末放入烧杯中,向其中加入100g稀硫酸,恰好完全反应,反应后烧杯中物质的总质量为139.6g,请计算该“假黄金”样品中铜的质量分数是_______ 。
【金属的信息】
如图1、2是钠的相关信息。回答以下问题:

(2)图2为钠的某种微粒结构示意图,该微粒的符号为
【金属的性质】
(3)填写表格:
| 调查及实验内容 | 分析及结论 |
| ①由图3可知:合金的熔点 ②图4中 |
| ③图5“真金不怕火来炼”的意思是 ④图6金属铝耐腐蚀的原因是 |
| ⑤图7实验观察到金属A表面覆盖红色固体,则金属A和溶液a分别为 |
【金属发生化学反应的判断】
从“反应物的消耗”和“生成物的检验”两个角度可以对金属是否发生化学反应进行验证。
(4)反应物的消耗:称量0.650g铜粉置于密闭的容器中加热,并用氧气传感器测量密闭容器内氧气的含量从20.99%降低至6.15%,实验结束后将粉末取出,称量其质量
(5)生成物的检验:将(4)反应后得到的黑色粉末放入试管中,加入足量稀硫酸并加热,产生
【金属含量的测定】
(6)铜锌合金又称“假黄金”。取40g“假黄金”样品,磨成粉末放入烧杯中,向其中加入100g稀硫酸,恰好完全反应,反应后烧杯中物质的总质量为139.6g,请计算该“假黄金”样品中铜的质量分数是
您最近一年使用:0次
2024·湖北武汉·模拟预测
解题方法
4 . 某兴趣小组对“一氧化碳还原氧化铁”实验进行拓展研究。
【查阅资料】①加热MgCO3和Zn的混合物,产生三种氧化物。
②氯化亚铜溶液吸收CO产生红色固体:2CuCl+2CO+2H2O═Cu2Cl2(CO)2•2H2O↓,氨水能加速反应。
【设计方案】根据上述资料设计如图实验装置。
(1)①装配好实验装置后,先要检查装置的气密性,再装入药品。
②打开活塞,通入适量氮气的目的是_____________________ 。
③关闭活塞,点燃酒精灯和酒精喷灯。
④观察实验现象,B处现象是_________________ ,D处出现红色固体。
⑤熄灭酒精灯和酒精喷灯。
【实验分析】
(2)写出A处反应的化学方程式______________________ 。
(3)下列关于该实验说法正确的是_____ (选填序号)。
a.B处固体质量减少
b.D处现象证明A、B处发生了反应
c.E处应放置一只燃着的酒精灯
d.实验结束后应继续通氮气至玻璃管冷却
(4)已知A处参加反应的MgCO3质量为3.36g,C处白色沉淀的质量为2g,从环保角度考虑D处CuCl的质量至少需要_______ g。
【查阅资料】①加热MgCO3和Zn的混合物,产生三种氧化物。
②氯化亚铜溶液吸收CO产生红色固体:2CuCl+2CO+2H2O═Cu2Cl2(CO)2•2H2O↓,氨水能加速反应。
【设计方案】根据上述资料设计如图实验装置。

(1)①装配好实验装置后,先要检查装置的气密性,再装入药品。
②打开活塞,通入适量氮气的目的是
③关闭活塞,点燃酒精灯和酒精喷灯。
④观察实验现象,B处现象是
⑤熄灭酒精灯和酒精喷灯。
【实验分析】
(2)写出A处反应的化学方程式
(3)下列关于该实验说法正确的是
a.B处固体质量减少
b.D处现象证明A、B处发生了反应
c.E处应放置一只燃着的酒精灯
d.实验结束后应继续通氮气至玻璃管冷却
(4)已知A处参加反应的MgCO3质量为3.36g,C处白色沉淀的质量为2g,从环保角度考虑D处CuCl的质量至少需要
您最近一年使用:0次
名校
解题方法
5 . 金属和金属材料在生产、生活中应用广泛。
(1)金属文物铭刻着中华文化的脉络,在中华文明的传承中起着重要作用。________ (填“大”或“小”)。三星堆古遗址发现的黄金面具堪称独一无二的旷世神品,金块能够被锻造成薄薄的面具,说明金具有良好的________ 性。
②文物保护:保护铁质的文物需要避免文物与空气中的_______ 接触。
③文物鉴别:不法分子常用假黄金(铜锌合金)仿制纯黄金珍贵文物,从原理上分析,下列鉴别真假黄金文物的方法正确的是_______ (填标号)。
A.滴加稀盐酸 B.用火灼烧 C.观察颜色
(2)探究金属的性质
①为了验证锌、铜、银三种金属的活动性顺序,设计了下列三种方案,其中合理的是_____ (填标号)。_______ (填化学式)。另取一定量该样品放入硝酸铜溶液中,充分反应后过滤,得到滤渣和滤液。将滤渣洗净,滴入稀硫酸,有气泡产生,则滤渣中一定含有的成分是______ (填化学式)。
(1)金属文物铭刻着中华文化的脉络,在中华文明的传承中起着重要作用。

②文物保护:保护铁质的文物需要避免文物与空气中的
③文物鉴别:不法分子常用假黄金(铜锌合金)仿制纯黄金珍贵文物,从原理上分析,下列鉴别真假黄金文物的方法正确的是
A.滴加稀盐酸 B.用火灼烧 C.观察颜色
(2)探究金属的性质
①为了验证锌、铜、银三种金属的活动性顺序,设计了下列三种方案,其中合理的是
A.  B.
B.  C.
C.
您最近一年使用:0次
名校
解题方法
6 . 能源转型逐渐成为全球共识。
2023年3月,我国首次实现“固态氢能”发电并网,“绿电”与“绿氢”转化的示意图如图所示。______ (填字母)原子均属于氢元素。
(2)将光伏、风力发出的电用于电解水制氢。电解水时的能量转化方式是______ 。
(3)贮氢:合金Mg2Cu是一种潜在的贮氢材料,高温时在氩气保护下,由一定质量比的Mg、Cu单质熔炼获得。该合金在一定条件下完全吸氢生成氢化物和另一种合金,其化学方程式为:2Mg2Cu+3H2 3MgH2+MgCu2。
3MgH2+MgCu2。
①熔炼制备Mg2Cu合金时,通入氩气的目的是______ 。
②氢化物MgH2与水反应生成氢氧化镁沉淀,并释放出氢气,发生反应的化学方程式为______ 。
(4)科学家还发现氨气是一种清洁能源,在纯氧中可以完全燃烧,只生成水和氮气,使得液氨有望取代液氢成为新一代绿色能源。如表1为氨气和氢气的部分信息:
表1:
请回答下列问题:______ (填字母)
a.300℃低压 b.500℃高压
②请写出氨气在纯氧中燃烧的化学方程式______ 。
③科学家最新研制了常温、常压下电解法合成氨的方法,原理如图3所示。电源的正极会产生氧气,负极会产生氨气。反应所得氧气与氨气的质量比远大于理论值,可能的原因是______ 、______ 。
2023年3月,我国首次实现“固态氢能”发电并网,“绿电”与“绿氢”转化的示意图如图所示。

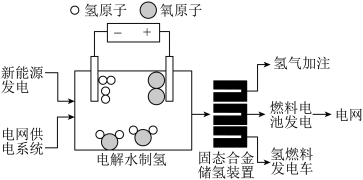

(2)将光伏、风力发出的电用于电解水制氢。电解水时的能量转化方式是
(3)贮氢:合金Mg2Cu是一种潜在的贮氢材料,高温时在氩气保护下,由一定质量比的Mg、Cu单质熔炼获得。该合金在一定条件下完全吸氢生成氢化物和另一种合金,其化学方程式为:2Mg2Cu+3H2
 3MgH2+MgCu2。
3MgH2+MgCu2。①熔炼制备Mg2Cu合金时,通入氩气的目的是
②氢化物MgH2与水反应生成氢氧化镁沉淀,并释放出氢气,发生反应的化学方程式为
(4)科学家还发现氨气是一种清洁能源,在纯氧中可以完全燃烧,只生成水和氮气,使得液氨有望取代液氢成为新一代绿色能源。如表1为氨气和氢气的部分信息:
表1:
| 性质名称 | 颜色、气味 | 25℃水中溶解度/g•L-1 | 标况下密度/g•L-1 |
| 氨气 | 无色、刺激性 | 456 | 0.6942 |
| 氢气 | 无色、无味 | 0.0015 | 0.0899 |


a.300℃低压 b.500℃高压
②请写出氨气在纯氧中燃烧的化学方程式
③科学家最新研制了常温、常压下电解法合成氨的方法,原理如图3所示。电源的正极会产生氧气,负极会产生氨气。反应所得氧气与氨气的质量比远大于理论值,可能的原因是
您最近一年使用:0次
名校
解题方法
7 . 近年来,我国载人航天事业取得了举世瞩目的成就。兴趣小组以“探究空间站水和氧气”为主题开展项目式学习。
【任务一】认识空间站氧气和水的再生
(1)空间站通过收集航天员尿液、汗液和呼出的水汽,深度净化,再生为饮用水。利用太阳能电池板供电,实现氧气和水的再生(如图1)。下列分析不正确的是___________(填字母序号)。
(2)实验室用加热高锰酸钾固体制氧气,该方法不适用于空间站提供氧气,理由是________ 。
【任务二】探究不同电解液和电极对水电解的影响
兴趣小组选择生活中材料做电极,在相同时间内做了一系列的对比实验,实验数据如下
(3)在上述实验条件下,实验数据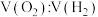 接近1:2的电解液和电极材料最佳组合是
接近1:2的电解液和电极材料最佳组合是________ 。
(4)稀硫酸做电解液时,铁丝不能做电极原因是___________ (用化学方程式解释)。
(5)影响电解水速率除上述因素外,还有___________ (写1点即可)。
【任务三】深度探究【任务二】中电解液稀硫酸和电极材料碳棒得到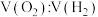 的比值比理论值偏小原因
的比值比理论值偏小原因
(6)兴趣小组在老师指导下,用CO2传感器测得图2烧杯上方CO2浓度随时间的变化曲线如图3。___________ 。
②由图3分析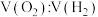 的比值比理论值偏小可能的原因
的比值比理论值偏小可能的原因___________ ;130s电解结束后CO2浓度继续变化的原因___________ 。
【任务一】认识空间站氧气和水的再生
(1)空间站通过收集航天员尿液、汗液和呼出的水汽,深度净化,再生为饮用水。利用太阳能电池板供电,实现氧气和水的再生(如图1)。下列分析不正确的是___________(填字母序号)。
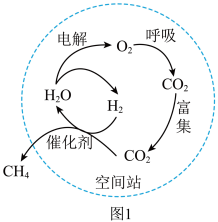
| A.空间站中氧气的主要来源是水电解 |
| B.水循环系统利用催化剂可增加水的质量 |
| C.空间站水循环系统中氢原子利用率没有达到100% |
| D.可用过滤方法除去尿液浓缩后析出的固体 |
(2)实验室用加热高锰酸钾固体制氧气,该方法不适用于空间站提供氧气,理由是
【任务二】探究不同电解液和电极对水电解的影响
兴趣小组选择生活中材料做电极,在相同时间内做了一系列的对比实验,实验数据如下
| 电解液(浓度0.2kg/L) | 不同电极材料产生的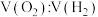 | ||||
| 碳棒 | 铜棒 | 保险丝 | 电阻丝 | 铁丝 | |
| NaOH溶液 | 1.09:6.9 | 3.35:7.7 | 2.95:6.9 | 3.4:7.3 | 3.2:6.51 |
| 稀硫酸 | 1.10:6.9 | 阳极产生的氧气很少 | 1.95:7.6 | 3.45:7.5 | 铁丝溶解 |
(3)在上述实验条件下,实验数据
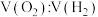 接近1:2的电解液和电极材料最佳组合是
接近1:2的电解液和电极材料最佳组合是(4)稀硫酸做电解液时,铁丝不能做电极原因是
(5)影响电解水速率除上述因素外,还有
【任务三】深度探究【任务二】中电解液稀硫酸和电极材料碳棒得到
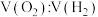 的比值比理论值偏小原因
的比值比理论值偏小原因(6)兴趣小组在老师指导下,用CO2传感器测得图2烧杯上方CO2浓度随时间的变化曲线如图3。

②由图3分析
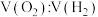 的比值比理论值偏小可能的原因
的比值比理论值偏小可能的原因
您最近一年使用:0次
解题方法
8 . 请回答下列问题。
(1)《梦溪笔谈》中记载“熬胆矾,铁釜久之可化为铜”(胆矾为硫酸铜晶体),用化学方程式表示其反应原理_______ 。
(2)小明用三种药品设计实验证明了铝、铜、银的金属活动性,请你帮他一起完成实验。
(3)将生锈的铁钉(铁锈的主要成分是氧化铁)放入盛有稀盐酸的密闭容器中,用压强传感器测得容器内气体压强和反应时间的变化曲线如图所示。_______ 。
②BC段密闭容器中压强显著增大的原因是_______ 。
(1)《梦溪笔谈》中记载“熬胆矾,铁釜久之可化为铜”(胆矾为硫酸铜晶体),用化学方程式表示其反应原理
(2)小明用三种药品设计实验证明了铝、铜、银的金属活动性,请你帮他一起完成实验。
| 操作 | 现象 | 结论 |
(3)将生锈的铁钉(铁锈的主要成分是氧化铁)放入盛有稀盐酸的密闭容器中,用压强传感器测得容器内气体压强和反应时间的变化曲线如图所示。

②BC段密闭容器中压强显著增大的原因是
您最近一年使用:0次
名校
解题方法
9 . 请回答下列问题。
(1)无论是智能手机、笔记本电脑、电动汽车还是其他电动器具,都离不开电池。关于电池的下列说法,请回答:
①当两种金属活动性不同的金属在潮湿的环境中接触时,因形成原电池,金属活动性强的金属首先被腐蚀。因此,为了保护轮船的钢质外壳,通常在行驶的轮船外壳上连接________ (填“铜板”或“锌板”)。________ 。该反应属于________ (选填“化合反应”“复分解反应”“置换反应”“分解反应”之一)。 ,则X的化学式为
,则X的化学式为________ 。若用100g质量分数为98%的浓硫酸配制所需溶质质量分数为35%电解液时,需要蒸馏水的体积为________ mL(精确到0.1)。
(2)取10g碳酸钠和硫酸钠的固体混合物,加入130.2g水充分搅拌后,全部溶解,向所得溶液中逐滴加入稀硫酸,产生气体的质量与滴入稀硫酸的质量关系如图所示,根据题意回答下列问题;_______ (写离子符号)。
②求所用稀硫酸中溶质的质量分数_______ 。(结果精确到0.1%)
③当加入稀硫酸98g时(即图中A点),求反应后所得溶液中溶质的质量分数_______ (结果精确到0.1%)。
(1)无论是智能手机、笔记本电脑、电动汽车还是其他电动器具,都离不开电池。关于电池的下列说法,请回答:
①当两种金属活动性不同的金属在潮湿的环境中接触时,因形成原电池,金属活动性强的金属首先被腐蚀。因此,为了保护轮船的钢质外壳,通常在行驶的轮船外壳上连接



 ,则X的化学式为
,则X的化学式为(2)取10g碳酸钠和硫酸钠的固体混合物,加入130.2g水充分搅拌后,全部溶解,向所得溶液中逐滴加入稀硫酸,产生气体的质量与滴入稀硫酸的质量关系如图所示,根据题意回答下列问题;

②求所用稀硫酸中溶质的质量分数
③当加入稀硫酸98g时(即图中A点),求反应后所得溶液中溶质的质量分数
您最近一年使用:0次
10 . 材料是人类赖以生存和发展的重要物质,目前铜依然是使用较多的金属材料。
(一)铜材料的有关知识
(1)①人类使用金属先后经历了“青铜”、“铁器”时代,直到近代才开始大量使用铝材料。这也反映出Cu、Fe、Al三种金属的活动性由强到弱的顺序是______ 。
②纯铜又称紫铜,常见铜合金有黄铜、青铜等种类。家用电缆常用紫铜,以聚氯乙烯塑料或TPU橡胶包裹。
(2)以上叙述中不涉及到的材料是______(选填序号)。
(3)我国在西汉时期就有“曾背得铁则化为铜”之说,句中蕴含的化学反应基本类型是______ 。
(4)铜制品长期暴露在空气中在表面形成绿色固体而生锈,请写出铜在空气中生锈的化学方程式______ 。
(二)铜及其化合物的实验
(5)①将CuO粉溶于稀H2SO4,反应的化学方程式是______ 。
②向上述反应后的溶液中滴加NaOH溶液,生成浅绿色沉淀。
【查阅资料】
①NaOH与CuSO4反应会生成碱式硫酸铜【Cu4(OH)6SO4】,其不溶于水,呈浅绿色,能与酸反应:
②Cu(OH)2分解温度为80℃,Cu4(OH)6SO4分解温度为300℃。
(6)写出生成浅绿色沉淀反应的化学方程式______ 。
(7)将浅绿色固体加热至100℃,发现固体变______ 色,说明浅绿色固体中还含有Cu(OH)2。
(8)过滤、洗涤、低温干燥得到浅绿色固体,能证明固体已洗净的方法为______ 。
(三)浅绿色固体的热分解实验
兴趣小组称取此固体3.25g,在科研人员的指导下用下图装置进行热分解实验。
②浓硫酸不能吸收SO2,能吸收SO3。
(9)加热前后及过程中均通入N2,停止加热后继续通N2的目的是______ 。
(10)控制温度在不同的范围对A中样品加热。测得剩余固体质量随温度的变化如下图所示。当加热到超过300℃时,装置C中的现象是______ 。______ 。
(12)浅绿色固体从室温开始加热至图中E点时装置B增重______ g。
(13)兴趣小组在E点时将N2换成CO继续通入到A中反应,一段时间后固体全变红且质量变为2g,此时用装有碱石灰的干燥管在E后面吸收CO2,理论上测得CO2的质量为______ 。
(一)铜材料的有关知识
(1)①人类使用金属先后经历了“青铜”、“铁器”时代,直到近代才开始大量使用铝材料。这也反映出Cu、Fe、Al三种金属的活动性由强到弱的顺序是
②纯铜又称紫铜,常见铜合金有黄铜、青铜等种类。家用电缆常用紫铜,以聚氯乙烯塑料或TPU橡胶包裹。
(2)以上叙述中不涉及到的材料是______(选填序号)。
| A.金属材料 | B.无机非金属材料 | C.合成材料 |
(3)我国在西汉时期就有“曾背得铁则化为铜”之说,句中蕴含的化学反应基本类型是
(4)铜制品长期暴露在空气中在表面形成绿色固体而生锈,请写出铜在空气中生锈的化学方程式
(二)铜及其化合物的实验
(5)①将CuO粉溶于稀H2SO4,反应的化学方程式是
②向上述反应后的溶液中滴加NaOH溶液,生成浅绿色沉淀。
【查阅资料】
①NaOH与CuSO4反应会生成碱式硫酸铜【Cu4(OH)6SO4】,其不溶于水,呈浅绿色,能与酸反应:
②Cu(OH)2分解温度为80℃,Cu4(OH)6SO4分解温度为300℃。
(6)写出生成浅绿色沉淀反应的化学方程式
(7)将浅绿色固体加热至100℃,发现固体变
(8)过滤、洗涤、低温干燥得到浅绿色固体,能证明固体已洗净的方法为
(三)浅绿色固体的热分解实验
兴趣小组称取此固体3.25g,在科研人员的指导下用下图装置进行热分解实验。

②浓硫酸不能吸收SO2,能吸收SO3。
(9)加热前后及过程中均通入N2,停止加热后继续通N2的目的是
(10)控制温度在不同的范围对A中样品加热。测得剩余固体质量随温度的变化如下图所示。当加热到超过300℃时,装置C中的现象是

(12)浅绿色固体从室温开始加热至图中E点时装置B增重
(13)兴趣小组在E点时将N2换成CO继续通入到A中反应,一段时间后固体全变红且质量变为2g,此时用装有碱石灰的干燥管在E后面吸收CO2,理论上测得CO2的质量为
您最近一年使用:0次






