名校
1 . NaClO2是一种高效的氧化剂和优质漂白剂,在水中溶解度较大,遇酸放出ClO2,某探究小组制备NaClO2所需装置如图所示(夹持装置略):

已知:①2ClO2+H2O2+2NaOH = 2NaClO2+O2+2H2O;
②ClO2气体极易溶于水,但不与水反应,可与碱溶液反应;纯ClO2易分解爆炸,一般用稀有气体或空气稀释到10%以下安全。
回答下列问题:
(1)完成该实验需要450 mL 4 mol·L-1的NaOH溶液,配制该溶液需要的玻璃仪器除烧杯、胶头滴管和量筒外,还需要_______ ,所需NaOH固体的质量为_______ 。
(2)仪器A的名称是_______ ,装置连接顺序为_______ (按气流方向,用小写字母表示,每个装置仅使用一次)。
(3)装置④中发生反应的化学方程式为_______ 。
(4)②中NaOH溶液的作用是_______ ;打开K通入足量空气的目的是_______ 。
(5)ClO2作消毒剂后转化为Cl-,则其消毒效率(以单位物质的量得到的电子数表示)是Cl2的_______ 倍。

已知:①2ClO2+H2O2+2NaOH = 2NaClO2+O2+2H2O;
②ClO2气体极易溶于水,但不与水反应,可与碱溶液反应;纯ClO2易分解爆炸,一般用稀有气体或空气稀释到10%以下安全。
回答下列问题:
(1)完成该实验需要450 mL 4 mol·L-1的NaOH溶液,配制该溶液需要的玻璃仪器除烧杯、胶头滴管和量筒外,还需要
(2)仪器A的名称是
(3)装置④中发生反应的化学方程式为
(4)②中NaOH溶液的作用是
(5)ClO2作消毒剂后转化为Cl-,则其消毒效率(以单位物质的量得到的电子数表示)是Cl2的
您最近一年使用:0次
2023-05-16更新
|
408次组卷
|
2卷引用:山东省烟台市2022-2023学年高一上学期期末考试化学试题
2 . 氟化钾是一种重要的无机化合物,应用广泛。其一种制备工艺流程如下:

回答下列问题:
(1)“滤渣”中的主要成分是_______ (填化学式),写出该成分的一种用途:_______ 。
(2)写出制备 的反应的化学方程式:
的反应的化学方程式:_______ ;配制 的浓硫酸,需要用量筒量取密度为
的浓硫酸,需要用量筒量取密度为 的98%的浓硫酸
的98%的浓硫酸_______  。
。
(3)制备 的反应其基本反应类型为
的反应其基本反应类型为_______ 。
(4)写出“转化”时发生反应的化学方程式:_______ 。
(5)“系列操作”包括_______ 、过滤分离和干燥。

回答下列问题:
(1)“滤渣”中的主要成分是
(2)写出制备
 的反应的化学方程式:
的反应的化学方程式: 的浓硫酸,需要用量筒量取密度为
的浓硫酸,需要用量筒量取密度为 的98%的浓硫酸
的98%的浓硫酸 。
。(3)制备
 的反应其基本反应类型为
的反应其基本反应类型为(4)写出“转化”时发生反应的化学方程式:
(5)“系列操作”包括
您最近一年使用:0次
解题方法
3 . 如图是某学校实验室从化学试剂商店买回的浓硫酸试剂在标签上的部分内容,现用该浓硫酸配制500mL1mol/L的稀硫酸。

可供选用的仪器有:①胶头滴管②烧瓶③烧杯④玻璃棒⑤药匙⑥量筒⑦托盘天平
回答下列问题:
(1)在盛放浓硫酸的试瓶的标签上应印有如图警示标志中的___ 。(填字母)
(2)该浓硫酸的物质的量浓度为___ mol/L。
(3)配制稀硫酸时,还缺少的仪器有___ 。(写仪器名称)
(4)配制500mL1mol/L的稀硫酸需量筒量取上述浓硫酸的体积为___ mL。
(5)对所配制的稀硫酸进行测定,发现其浓度小于1mol/L,配制过程中下列各项操作可能引起该误差的原因有___ 。(填字母)
A.将稀释后的硫酸立即转移至容量瓶中
B.定容时,仰视容量瓶刻度线进行定容
C.转移溶液时,不慎将少量溶液撒到容量瓶外面
D.所用容量瓶经蒸馏水洗涤后未干燥,有少量残留蒸馏水
E.定容后,把容量瓶倒置摇匀后发现液面低于刻度线,再滴水至刻度线处

可供选用的仪器有:①胶头滴管②烧瓶③烧杯④玻璃棒⑤药匙⑥量筒⑦托盘天平
回答下列问题:
(1)在盛放浓硫酸的试瓶的标签上应印有如图警示标志中的
A. | B. | C. | D.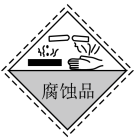 |
(3)配制稀硫酸时,还缺少的仪器有
(4)配制500mL1mol/L的稀硫酸需量筒量取上述浓硫酸的体积为
(5)对所配制的稀硫酸进行测定,发现其浓度小于1mol/L,配制过程中下列各项操作可能引起该误差的原因有
A.将稀释后的硫酸立即转移至容量瓶中
B.定容时,仰视容量瓶刻度线进行定容
C.转移溶液时,不慎将少量溶液撒到容量瓶外面
D.所用容量瓶经蒸馏水洗涤后未干燥,有少量残留蒸馏水
E.定容后,把容量瓶倒置摇匀后发现液面低于刻度线,再滴水至刻度线处
您最近一年使用:0次
2021-10-24更新
|
242次组卷
|
2卷引用:云南省昆明师范专科学校附属中学2021-2022学年高一上学期期末考试化学试题
20-21高一上·全国·期末
解题方法
4 . 下图为实验室某浓盐酸试剂瓶上的标签的有关内容,试根据标签上的有关数据回答下列问题:
(1)该浓盐酸中 的物质的量浓度为
的物质的量浓度为___________  。
。
(2)取用任意体积的该盐酸时,下列物理量中不随所取体积的多少而变化的是___________ (填字母)。
A.溶液中 的物质的量
的物质的量
B.溶液的浓度
C.溶液中 的数目
的数目
D.溶液的密度
(3)某学生欲用上述浓盐酸和蒸馏水配制 物质的量浓度为
物质的量浓度为 的稀盐酸。
的稀盐酸。
①该学生需要量取___________  上述浓盐酸进行配制。
上述浓盐酸进行配制。
②在配制过程中,下列实验操作对所配制的稀盐酸的物质的量浓度有何影响?(在横线上填A表示“偏高”、填B表示“偏低”、填C表示“无影响”)。
Ⅰ.用量筒量取浓盐酸时俯视观察凹液面___________ 。
Ⅱ.定容后经振荡、摇匀、静置,发现液面下降,再加适量的蒸馏水___________ 。
Ⅲ.定容摇匀后,发现液面低于刻度线___________ 。
Ⅳ.定容时,俯视读数,所得溶液的浓度___________ 。
| 盐酸 分子式:  相对分子质量:36.5 密度: 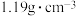  的质量分数:36.5% 的质量分数:36.5% |
 的物质的量浓度为
的物质的量浓度为 。
。(2)取用任意体积的该盐酸时,下列物理量中不随所取体积的多少而变化的是
A.溶液中
 的物质的量
的物质的量B.溶液的浓度
C.溶液中
 的数目
的数目D.溶液的密度
(3)某学生欲用上述浓盐酸和蒸馏水配制
 物质的量浓度为
物质的量浓度为 的稀盐酸。
的稀盐酸。①该学生需要量取
 上述浓盐酸进行配制。
上述浓盐酸进行配制。②在配制过程中,下列实验操作对所配制的稀盐酸的物质的量浓度有何影响?(在横线上填A表示“偏高”、填B表示“偏低”、填C表示“无影响”)。
Ⅰ.用量筒量取浓盐酸时俯视观察凹液面
Ⅱ.定容后经振荡、摇匀、静置,发现液面下降,再加适量的蒸馏水
Ⅲ.定容摇匀后,发现液面低于刻度线
Ⅳ.定容时,俯视读数,所得溶液的浓度
您最近一年使用:0次
2021-03-27更新
|
362次组卷
|
4卷引用:新疆喀什地区英吉沙县2022-2023学年高三上学期11月期中考试化学试题
新疆喀什地区英吉沙县2022-2023学年高三上学期11月期中考试化学试题(已下线)期末模拟卷(一)-2020-2021学年高一化学必修第一册同步单元AB卷(新教材人教版)江苏省苏州市新实中学2019-2020学年高一上学期第一次(10月)月考试题内蒙古自治区通辽市科尔沁左翼中旗实验高级中学2023-2024学年高一上学期1月期末化学试题
名校
解题方法
5 . 日常生活及化学实验中,准确配制一定物质的量浓度的溶液至关重要。
(1)实验室需要用到240mL0.5mol/L硫酸,现实验室只有物质的量浓度为1mol/L的硫酸,该同学需要自己稀释,他需要量取_______ mL1mol/L的硫酸。
(2)实验室某浓盐酸试剂瓶标签如下图所示,试根据标签上的有关数据回答下列问题:

该浓盐酸中HCl的物质的量浓度为_______ 。
(3)某兴趣小组为探究Na2CO3溶液的性质,需要480mL0.2mol/L的Na2CO3溶液。溶液的配制过程如图所示:

a.请把配制过程中两处明显错误请改正过来_______ 、_______ 。
b.请分析下列情况对所配溶液浓度产生的影响:其中引起所配溶液浓度偏高的有_______ (填序号)。
①用“左物右码”的方法称量(使用游码)
②碳酸钠不纯,其中混有氯化钠
③容量瓶未经干燥使用
④称量碳酸钠时所用砝码生锈
⑤移液过程中有少量溶液溅出
(1)实验室需要用到240mL0.5mol/L硫酸,现实验室只有物质的量浓度为1mol/L的硫酸,该同学需要自己稀释,他需要量取
(2)实验室某浓盐酸试剂瓶标签如下图所示,试根据标签上的有关数据回答下列问题:

该浓盐酸中HCl的物质的量浓度为
(3)某兴趣小组为探究Na2CO3溶液的性质,需要480mL0.2mol/L的Na2CO3溶液。溶液的配制过程如图所示:

a.请把配制过程中两处明显错误请改正过来
b.请分析下列情况对所配溶液浓度产生的影响:其中引起所配溶液浓度偏高的有
①用“左物右码”的方法称量(使用游码)
②碳酸钠不纯,其中混有氯化钠
③容量瓶未经干燥使用
④称量碳酸钠时所用砝码生锈
⑤移液过程中有少量溶液溅出
您最近一年使用:0次
2021-03-10更新
|
144次组卷
|
3卷引用:青海省海南藏族自治州高级中学2021-2022学年高一上学期期末考试化学试题
名校
解题方法
6 . 下图为实验室某盐酸试剂瓶的标签,试根据标签上的有关数据回答下列问题:
(1)取用任意体积的该盐酸时,下列物理量中不随所取体积的多少而变化的是____ (填字母)。
A.溶液中HCl的物质的量 B.溶液的物质的量浓度
C.溶液的密度 D.溶液中Cl-的数目
(2)某学生欲用上述浓盐酸和蒸馏水配制500 mL0.50 mol/L的稀盐酸。
①该学生需要量取____ mL上述浓盐酸进行配制。
②本实验用到的基本仪器已有烧杯、量筒、玻璃棒,还缺少的仪器是_______ 。
(3)①假设该同学成功配制了0.50mol/L的盐酸,他又用该盐酸中和含0.4 g溶质的NaOH溶液,则该同学需取____ mL盐酸。
②假设该同学用新配制的盐酸中和含0.4 g溶质的NaOH溶液,发现消耗的盐酸比①中所求体积偏小,则可能的原因是_______ (填字母)。
A.浓盐酸挥发,浓度不足
B.配制溶液时,未洗涤烧杯
C.定容时,俯视容量瓶刻度线
D.定容后经振荡、摇匀、静置,发现液面下降,再加适量的蒸馏水
| 盐酸 分子式:HCl 相对分子质量:36.5 密度:1.19g·cm-3 物质的量浓度:11.9mol·L-1 |
A.溶液中HCl的物质的量 B.溶液的物质的量浓度
C.溶液的密度 D.溶液中Cl-的数目
(2)某学生欲用上述浓盐酸和蒸馏水配制500 mL0.50 mol/L的稀盐酸。
①该学生需要量取
②本实验用到的基本仪器已有烧杯、量筒、玻璃棒,还缺少的仪器是
(3)①假设该同学成功配制了0.50mol/L的盐酸,他又用该盐酸中和含0.4 g溶质的NaOH溶液,则该同学需取
②假设该同学用新配制的盐酸中和含0.4 g溶质的NaOH溶液,发现消耗的盐酸比①中所求体积偏小,则可能的原因是
A.浓盐酸挥发,浓度不足
B.配制溶液时,未洗涤烧杯
C.定容时,俯视容量瓶刻度线
D.定容后经振荡、摇匀、静置,发现液面下降,再加适量的蒸馏水
您最近一年使用:0次
2020-07-30更新
|
289次组卷
|
3卷引用:黑龙江省双鸭山市第一中学2021-2022学年高一上学期期末考试化学试题
名校
解题方法
7 . 如图是硫酸试剂标签上的部分内容。请回答下列问题:

(1)该浓硫酸中溶质、溶剂分子数目之比为___ ,现用该浓H2SO4来配制480mL、0.3mol·L-1的稀H2SO4,需量取该浓H2SO4的体积为___ mL。
(2)配制时,下列仪器中必须使用___ (填代号),还缺少的仪器是___ 、___ 。
①托盘天平(带砝码) ②10mL量筒 ③20mL量筒 ④烧杯 ⑤玻璃棒 ⑥100mL容量瓶 ⑦漏斗 ⑧烧瓶
(3)在配制过程中,下列操作中能使所配溶液的浓度偏高的有___ (填代号)。
①用量筒量取98%的硫酸时俯视
②洗涤量取浓硫酸的量筒,并将洗涤液转移到容量瓶中
③未等稀释后的H2SO4溶液冷却至室温就转移到容量瓶中
④转移前,容量瓶中含有少量蒸馏水
⑤定容时,加蒸馏水超过标线,又用胶头滴管吸出
⑥定容摇匀后,发现液面低于标线,又用胶头滴管加蒸馏水至标线
⑦定容时,仰视刻度线

(1)该浓硫酸中溶质、溶剂分子数目之比为
(2)配制时,下列仪器中必须使用
①托盘天平(带砝码) ②10mL量筒 ③20mL量筒 ④烧杯 ⑤玻璃棒 ⑥100mL容量瓶 ⑦漏斗 ⑧烧瓶
(3)在配制过程中,下列操作中能使所配溶液的浓度偏高的有
①用量筒量取98%的硫酸时俯视
②洗涤量取浓硫酸的量筒,并将洗涤液转移到容量瓶中
③未等稀释后的H2SO4溶液冷却至室温就转移到容量瓶中
④转移前,容量瓶中含有少量蒸馏水
⑤定容时,加蒸馏水超过标线,又用胶头滴管吸出
⑥定容摇匀后,发现液面低于标线,又用胶头滴管加蒸馏水至标线
⑦定容时,仰视刻度线
您最近一年使用:0次
2020-01-05更新
|
135次组卷
|
3卷引用:衔接点20 物质的量浓度-2022年初升高化学无忧衔接?
(已下线)衔接点20 物质的量浓度-2022年初升高化学无忧衔接?【全国百强校】江苏省海安高级中学2018-2019学年高一(创新实验班)下学期期中考试化学试题辽宁省滨海实验中学2019-2020学年高一上学期期末化学试题
名校
8 . 已知某“84消毒液”瓶体部分标签如图所示,该“84消毒液”通常稀释100倍(体积之比)后使用。请回答下列问题:
(1)该“84消毒液”的物质的量浓度约为_____ mol·L-1。
(2)取用任意体积的该盐溶液时,下列物理量中会随所取体积的多少而变化的是________ (填字母)。
A.溶液中NaClO的物质的量 B.溶液的浓度
C.溶液中NaClO的摩尔质量 D.溶液的密度
(3)该同学参阅该“84消毒液”的配方,欲用NaClO固体配制480 mL含NaClO质量分数为25%的消毒液。回答下列问题。
①如图所示的仪器中,有些是不需要,配制上述溶液还需要玻璃仪器_______
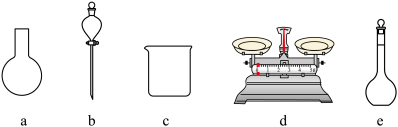
②需要称量NaClO固体的质量为_______ g
(4)“84消毒液”与稀硫酸混合使用可增强消毒能力,某消毒小组人员用98%(密度为1.84 g·cm-3)的浓硫酸配制200 mL 2.3 mol·L-1的稀硫酸用于增强“84消毒液”的消毒能力。
①所配制的稀硫酸中,H+的物质的量浓度为________ mol·L-1。
②需用浓硫酸的体积为________ mL。
③若所配制的稀硫酸浓度偏小,则下列可能的原因分析中正确的是_______ 。
A.配制前,容量瓶中有少量蒸馏水 B.量取浓硫酸时,仰视液体的凹液面
C.未冷却,立即转移至容量瓶定容 D.定容时,仰视溶液的凹液面
| 84消毒液 (有效成分)NaClO (规格)1000mL (质量分数)25% (密度)1.19g·cm-3 |
(2)取用任意体积的该盐溶液时,下列物理量中会随所取体积的多少而变化的是
A.溶液中NaClO的物质的量 B.溶液的浓度
C.溶液中NaClO的摩尔质量 D.溶液的密度
(3)该同学参阅该“84消毒液”的配方,欲用NaClO固体配制480 mL含NaClO质量分数为25%的消毒液。回答下列问题。
①如图所示的仪器中,有些是不需要,配制上述溶液还需要玻璃仪器

②需要称量NaClO固体的质量为
(4)“84消毒液”与稀硫酸混合使用可增强消毒能力,某消毒小组人员用98%(密度为1.84 g·cm-3)的浓硫酸配制200 mL 2.3 mol·L-1的稀硫酸用于增强“84消毒液”的消毒能力。
①所配制的稀硫酸中,H+的物质的量浓度为
②需用浓硫酸的体积为
③若所配制的稀硫酸浓度偏小,则下列可能的原因分析中正确的是
A.配制前,容量瓶中有少量蒸馏水 B.量取浓硫酸时,仰视液体的凹液面
C.未冷却,立即转移至容量瓶定容 D.定容时,仰视溶液的凹液面
您最近一年使用:0次
2019-10-11更新
|
157次组卷
|
3卷引用:新疆哈密市第八中学2021-2022学年高一上学期期末考试化学试题



