解题方法
1 . 如图是某学校实验室从化学试剂商店买回的浓硫酸试剂在标签上的部分内容,现用该浓硫酸配制500mL1mol/L的稀硫酸。

可供选用的仪器有:①胶头滴管②烧瓶③烧杯④玻璃棒⑤药匙⑥量筒⑦托盘天平
回答下列问题:
(1)在盛放浓硫酸的试瓶的标签上应印有如图警示标志中的___ 。(填字母)
(2)该浓硫酸的物质的量浓度为___ mol/L。
(3)配制稀硫酸时,还缺少的仪器有___ 。(写仪器名称)
(4)配制500mL1mol/L的稀硫酸需量筒量取上述浓硫酸的体积为___ mL。
(5)对所配制的稀硫酸进行测定,发现其浓度小于1mol/L,配制过程中下列各项操作可能引起该误差的原因有___ 。(填字母)
A.将稀释后的硫酸立即转移至容量瓶中
B.定容时,仰视容量瓶刻度线进行定容
C.转移溶液时,不慎将少量溶液撒到容量瓶外面
D.所用容量瓶经蒸馏水洗涤后未干燥,有少量残留蒸馏水
E.定容后,把容量瓶倒置摇匀后发现液面低于刻度线,再滴水至刻度线处

可供选用的仪器有:①胶头滴管②烧瓶③烧杯④玻璃棒⑤药匙⑥量筒⑦托盘天平
回答下列问题:
(1)在盛放浓硫酸的试瓶的标签上应印有如图警示标志中的
A. | B. | C. | D.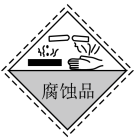 |
(3)配制稀硫酸时,还缺少的仪器有
(4)配制500mL1mol/L的稀硫酸需量筒量取上述浓硫酸的体积为
(5)对所配制的稀硫酸进行测定,发现其浓度小于1mol/L,配制过程中下列各项操作可能引起该误差的原因有
A.将稀释后的硫酸立即转移至容量瓶中
B.定容时,仰视容量瓶刻度线进行定容
C.转移溶液时,不慎将少量溶液撒到容量瓶外面
D.所用容量瓶经蒸馏水洗涤后未干燥,有少量残留蒸馏水
E.定容后,把容量瓶倒置摇匀后发现液面低于刻度线,再滴水至刻度线处
您最近一年使用:0次
2021-10-24更新
|
242次组卷
|
2卷引用:广东省惠州市2020-2021学年高一上学期期末质量检测化学试题
解题方法
2 . 如图为实验室某浓盐酸试剂瓶标签上的有关数据,试根据标签上的有关数据回答下列问题:
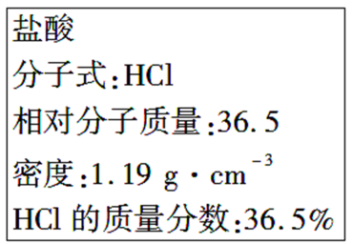
(1)该浓盐酸中HCl的物质的量浓度为_______ mol·L-1
(2)某学生欲用上述浓盐酸和蒸馏水配制480 mL物质的量浓度为0.400 mol·L-1的稀盐酸,该学生需要量取_______ mL上述浓盐酸进行配制。
(3)本实验用到的基本仪器已有烧杯、量筒、玻璃棒、胶头滴管,还缺少的仪器是_______ 。
(4)如图是该同学转移溶液的示意图,图中有两处错误,请写出:①_______ ;②_______ 。
(5)该同学用新配制的盐酸滴定含0.4 gNaOH的NaOH溶液,发现所需盐酸的体积偏小,则可能的原因是_______(填字母)。

(1)该浓盐酸中HCl的物质的量浓度为
(2)某学生欲用上述浓盐酸和蒸馏水配制480 mL物质的量浓度为0.400 mol·L-1的稀盐酸,该学生需要量取
(3)本实验用到的基本仪器已有烧杯、量筒、玻璃棒、胶头滴管,还缺少的仪器是
(4)如图是该同学转移溶液的示意图,图中有两处错误,请写出:①

(5)该同学用新配制的盐酸滴定含0.4 gNaOH的NaOH溶液,发现所需盐酸的体积偏小,则可能的原因是_______(填字母)。
| A.浓盐酸挥发,浓度不足 | B.配制溶液时,未洗涤烧杯 |
| C.配制溶液时,俯视容量瓶刻度线 | D.加水时超过刻度线,用胶头滴管吸出 |
您最近一年使用:0次
名校
解题方法
3 . 日常生活及化学实验中,准确配制一定物质的量浓度的溶液至关重要。
(1)实验室需要用到240mL0.5mol/L硫酸,现实验室只有物质的量浓度为1mol/L的硫酸,该同学需要自己稀释,他需要量取_______ mL1mol/L的硫酸。
(2)实验室某浓盐酸试剂瓶标签如下图所示,试根据标签上的有关数据回答下列问题:

该浓盐酸中HCl的物质的量浓度为_______ 。
(3)某兴趣小组为探究Na2CO3溶液的性质,需要480mL0.2mol/L的Na2CO3溶液。溶液的配制过程如图所示:

a.请把配制过程中两处明显错误请改正过来_______ 、_______ 。
b.请分析下列情况对所配溶液浓度产生的影响:其中引起所配溶液浓度偏高的有_______ (填序号)。
①用“左物右码”的方法称量(使用游码)
②碳酸钠不纯,其中混有氯化钠
③容量瓶未经干燥使用
④称量碳酸钠时所用砝码生锈
⑤移液过程中有少量溶液溅出
(1)实验室需要用到240mL0.5mol/L硫酸,现实验室只有物质的量浓度为1mol/L的硫酸,该同学需要自己稀释,他需要量取
(2)实验室某浓盐酸试剂瓶标签如下图所示,试根据标签上的有关数据回答下列问题:

该浓盐酸中HCl的物质的量浓度为
(3)某兴趣小组为探究Na2CO3溶液的性质,需要480mL0.2mol/L的Na2CO3溶液。溶液的配制过程如图所示:

a.请把配制过程中两处明显错误请改正过来
b.请分析下列情况对所配溶液浓度产生的影响:其中引起所配溶液浓度偏高的有
①用“左物右码”的方法称量(使用游码)
②碳酸钠不纯,其中混有氯化钠
③容量瓶未经干燥使用
④称量碳酸钠时所用砝码生锈
⑤移液过程中有少量溶液溅出
您最近一年使用:0次
2021-03-10更新
|
144次组卷
|
3卷引用:广西来宾市2020-2021学年高一上学期期末教学质量检测化学试题
4 . 根据要求,回答下列问题:
Ⅰ.如图为实验室某浓盐酸试剂瓶标签上的有关数据。

(1)该浓盐酸中, 的物质的量浓度为
的物质的量浓度为___________  。
。
(2)取用任意体积的该浓盐酸时,下列物理量中不随所取体积的多少而变化的是___________ (填标号)。
A.溶液的密度
B.溶质 的物质的量
的物质的量
C.溶质 的物质的量浓度
的物质的量浓度
D.溶液中 的物质的量
的物质的量
(3)用该浓盐酸和蒸馏水配制 物质的量浓度为
物质的量浓度为 的稀盐酸。
的稀盐酸。
①需量取___________  该浓盐酸进行配制(保留1位小数)。
该浓盐酸进行配制(保留1位小数)。
②在配制过程中,下列实验操作对所配制的稀盐酸的物质的量浓度有何影响?(填“偏高”、“偏低”或“无影响”)。用量筒量取浓盐酸时俯视观察凹液面:___________ 。定容后经振荡、摇匀、静置,发现液面略有下降,再加适量的蒸馏水到容量瓶颈部的刻度线___________ 。
Ⅱ.将一定量的镁铝合金投入 一定浓度的盐酸中,充分反应,合金全部溶解。向合金溶解后所得溶液中滴加
一定浓度的盐酸中,充分反应,合金全部溶解。向合金溶解后所得溶液中滴加 溶液,生成沉淀的质量与加入的
溶液,生成沉淀的质量与加入的 溶液的体积关系如图所示。
溶液的体积关系如图所示。

(1)原合金中,镁的质量为___________ g,铝的质量为___________ g。
(2)盐酸溶液中溶质的物质的量浓度为___________  。
。
Ⅰ.如图为实验室某浓盐酸试剂瓶标签上的有关数据。

(1)该浓盐酸中,
 的物质的量浓度为
的物质的量浓度为 。
。(2)取用任意体积的该浓盐酸时,下列物理量中不随所取体积的多少而变化的是
A.溶液的密度
B.溶质
 的物质的量
的物质的量C.溶质
 的物质的量浓度
的物质的量浓度D.溶液中
 的物质的量
的物质的量(3)用该浓盐酸和蒸馏水配制
 物质的量浓度为
物质的量浓度为 的稀盐酸。
的稀盐酸。①需量取
 该浓盐酸进行配制(保留1位小数)。
该浓盐酸进行配制(保留1位小数)。②在配制过程中,下列实验操作对所配制的稀盐酸的物质的量浓度有何影响?(填“偏高”、“偏低”或“无影响”)。用量筒量取浓盐酸时俯视观察凹液面:
Ⅱ.将一定量的镁铝合金投入
 一定浓度的盐酸中,充分反应,合金全部溶解。向合金溶解后所得溶液中滴加
一定浓度的盐酸中,充分反应,合金全部溶解。向合金溶解后所得溶液中滴加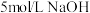 溶液,生成沉淀的质量与加入的
溶液,生成沉淀的质量与加入的 溶液的体积关系如图所示。
溶液的体积关系如图所示。
(1)原合金中,镁的质量为
(2)盐酸溶液中溶质的物质的量浓度为
 。
。
您最近一年使用:0次
解答题-实验探究题
|
较易(0.85)
|
解题方法
5 . 实验室用质量分数为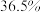 的浓盐酸(密度为
的浓盐酸(密度为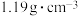 )配制
)配制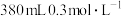 的稀盐酸,试回答下列问题:
的稀盐酸,试回答下列问题:
(1)计算已知浓盐酸的物质的量浓度为_______ 。
(2)配制稀盐酸时,应选用规格为_______  的容量瓶,需要量取浓盐酸的体积为
的容量瓶,需要量取浓盐酸的体积为_______  。
。
(3)配制过程中有下列实验操作步骤,其正确的顺序为_______ 。
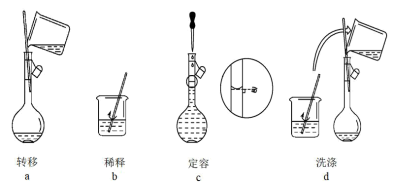
(4)在上述配制过程中,用于稀释盐酸用的烧杯用蒸馏水洗涤后未干燥,则配制的稀盐酸浓度将_______ (填“偏高”、“偏低”或“无影响”,下同);定容时俯视刻度线,配制的稀盐酸浓度将_______ 。
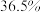 的浓盐酸(密度为
的浓盐酸(密度为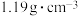 )配制
)配制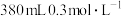 的稀盐酸,试回答下列问题:
的稀盐酸,试回答下列问题:(1)计算已知浓盐酸的物质的量浓度为
(2)配制稀盐酸时,应选用规格为
 的容量瓶,需要量取浓盐酸的体积为
的容量瓶,需要量取浓盐酸的体积为 。
。(3)配制过程中有下列实验操作步骤,其正确的顺序为

(4)在上述配制过程中,用于稀释盐酸用的烧杯用蒸馏水洗涤后未干燥,则配制的稀盐酸浓度将
您最近一年使用:0次
名校
解题方法
6 . 某同学参阅“84消毒液”的配方,欲用 固体配制
固体配制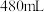 含
含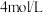 的消毒液。
的消毒液。
(1)可供选用的仪器有:①托盘天平 ②量筒 ③烧杯 ④玻璃棒 ⑤药匙 ⑥胶头滴管。配制溶液时,还缺少的玻璃仪器有_______ (写仪器名称)。
(2)用托盘天平需要称量 固体的质量为
固体的质量为_______ 。
(3)实验中下列情况会导致所配溶液浓度偏低的是_____
A.定容时俯视刻度线
B.未冷至室温就转移定容
C.转移溶液时不慎有少量洒到容量瓶外面
D.转移前,容量瓶内有蒸馏水
(4)“84消毒液”与稀硫酸混合使用可增强消毒能力,某消毒小组人员用 (密度为
(密度为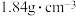 )的浓硫酸配制
)的浓硫酸配制 的稀硫酸用于增强“84消毒液”的消毒能力。
的稀硫酸用于增强“84消毒液”的消毒能力。
①所配制的稀硫酸中, 的物质的量浓度为
的物质的量浓度为_______  。
。
②需用量筒量取浓硫酸的体积为_______  。
。
 固体配制
固体配制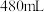 含
含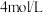 的消毒液。
的消毒液。(1)可供选用的仪器有:①托盘天平 ②量筒 ③烧杯 ④玻璃棒 ⑤药匙 ⑥胶头滴管。配制溶液时,还缺少的玻璃仪器有
(2)用托盘天平需要称量
 固体的质量为
固体的质量为(3)实验中下列情况会导致所配溶液浓度偏低的是
A.定容时俯视刻度线
B.未冷至室温就转移定容
C.转移溶液时不慎有少量洒到容量瓶外面
D.转移前,容量瓶内有蒸馏水
(4)“84消毒液”与稀硫酸混合使用可增强消毒能力,某消毒小组人员用
 (密度为
(密度为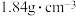 )的浓硫酸配制
)的浓硫酸配制 的稀硫酸用于增强“84消毒液”的消毒能力。
的稀硫酸用于增强“84消毒液”的消毒能力。①所配制的稀硫酸中,
 的物质的量浓度为
的物质的量浓度为 。
。②需用量筒量取浓硫酸的体积为
 。
。
您最近一年使用:0次
2021-02-03更新
|
94次组卷
|
2卷引用:四川省凉山州2020-2021学年高一上学期期末考试化学试题
名校
解题方法
7 . 已知某“84消毒液”瓶体部分标签如表所示,该“84消毒液”通常稀释100倍(体积之比)后使用。请回答下列问题:
(1)该“84消毒液”中 的物质的量浓度约为
的物质的量浓度约为_______  。
。
(2)该同学参阅该“84消毒液”的配方,欲用 固体配制
固体配制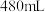 含
含 质量分数为25%的消毒液。下列说法正确的是
质量分数为25%的消毒液。下列说法正确的是_______ (填字母)。

A.如图所示的仪器中,有三种是不需要的,还需要一种玻璃仪器
B.容量瓶用蒸馏水洗净后,应烘干后才能用于溶液配制
C.利用购买的商品 来配制可能导致结果偏低
来配制可能导致结果偏低
D.需要称量 固体的质量为
固体的质量为
(3)“84消毒液”与稀硫酸混合使用可增强消毒能力,某消毒小组人员用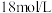 (密度为
(密度为 )的浓硫酸配制
)的浓硫酸配制 物质的量浓度为
物质的量浓度为 的稀硫酸用于增强“84消毒液”的消毒能力。
的稀硫酸用于增强“84消毒液”的消毒能力。
①需要量取_______  上述浓硫酸进行配制。
上述浓硫酸进行配制。
②在配制过程中,下列实验操作可能导致配制的硫酸溶液浓度偏高的是_______ (填序号)
a.定容时俯视观察
b.定容后经振荡、摇匀、静置后,发现液面下降,再加适量的蒸馏水
c.浓硫酸在烧杯中加水稀释后,未冷却就向容量瓶中转移
d.容量瓶未干燥即用来配制溶液
e.往容量瓶转移时,有少量液体溅出;
f.未洗涤稀释浓硫酸的烧杯;
(4)现需要

 溶液,进行现场配制。下图表示的实验步骤A~F正确的实验次序为
溶液,进行现场配制。下图表示的实验步骤A~F正确的实验次序为_______ (填字母)。

用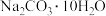 来配制该溶液,托盘天平称取样品,游码需要打在图示
来配制该溶液,托盘天平称取样品,游码需要打在图示_______ (填a或b)位置,若称量前晶体已经有一部分失去了结晶水,则所配制的溶液浓度偏_______ (填“大”或“小”或“无影响”)。

84消毒液 | |
| (有效成分) |  |
| (规格) | 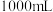 |
| (质量分数) | 25% |
| (密度) | 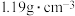 |
 的物质的量浓度约为
的物质的量浓度约为 。
。(2)该同学参阅该“84消毒液”的配方,欲用
 固体配制
固体配制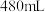 含
含 质量分数为25%的消毒液。下列说法正确的是
质量分数为25%的消毒液。下列说法正确的是
A.如图所示的仪器中,有三种是不需要的,还需要一种玻璃仪器
B.容量瓶用蒸馏水洗净后,应烘干后才能用于溶液配制
C.利用购买的商品
 来配制可能导致结果偏低
来配制可能导致结果偏低D.需要称量
 固体的质量为
固体的质量为
(3)“84消毒液”与稀硫酸混合使用可增强消毒能力,某消毒小组人员用
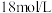 (密度为
(密度为 )的浓硫酸配制
)的浓硫酸配制 物质的量浓度为
物质的量浓度为 的稀硫酸用于增强“84消毒液”的消毒能力。
的稀硫酸用于增强“84消毒液”的消毒能力。①需要量取
 上述浓硫酸进行配制。
上述浓硫酸进行配制。②在配制过程中,下列实验操作可能导致配制的硫酸溶液浓度偏高的是
a.定容时俯视观察
b.定容后经振荡、摇匀、静置后,发现液面下降,再加适量的蒸馏水
c.浓硫酸在烧杯中加水稀释后,未冷却就向容量瓶中转移
d.容量瓶未干燥即用来配制溶液
e.往容量瓶转移时,有少量液体溅出;
f.未洗涤稀释浓硫酸的烧杯;
(4)现需要


 溶液,进行现场配制。下图表示的实验步骤A~F正确的实验次序为
溶液,进行现场配制。下图表示的实验步骤A~F正确的实验次序为
用
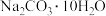 来配制该溶液,托盘天平称取样品,游码需要打在图示
来配制该溶液,托盘天平称取样品,游码需要打在图示
您最近一年使用:0次
2020-12-16更新
|
156次组卷
|
2卷引用:河南省镇平县第一高级中学2020-2021学年高一上学期第二次月考化学试题
名校
解题方法
8 . 环境问题是广大群众关注的热点话题之一,化工厂排放的废水、废渣一般利用化学原理可以进行排放物达标检测与无害化处理。某皮革厂对制革工业污泥中Cr(Ⅲ)的处理工艺流程如下:
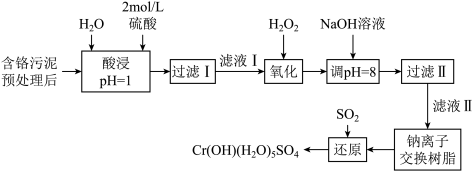
已知:①酸浸后的溶液中的金属离子主要是Cr3+,其次是Fe3+、Al3+、Ca2+和Mg2+。
②常温下,部分阳离子以氢氧化物形式沉淀时溶液的pH如下:
(1)如需配制480 mL酸浸环节所需的硫酸,需要用量筒量取18.4 mol·L-1的浓硫酸___________ mL;配制时所用玻璃仪器除量筒、烧杯和玻璃棒外,还需哪些仪器___________
(2)经氧化环节滤液Ⅰ中的Cr3+转化为Cr2O ,写出此反应的离子方程式:
,写出此反应的离子方程式:___________
(3)调pH=8环节,既可以将溶液中某些杂质离子转化为沉淀,同时又可以将Cr2O 转化为某种含铬元素微粒,溶液颜色由橙色变为黄色,请结合离子反应方程式解释该颜色变化的原因
转化为某种含铬元素微粒,溶液颜色由橙色变为黄色,请结合离子反应方程式解释该颜色变化的原因___________
(4)钠离子交换树脂的反应原理为Mn++nNaR MRn+nNa+,则利用钠离子交换树脂可除去滤液Ⅱ中的金属阳离子有
MRn+nNa+,则利用钠离子交换树脂可除去滤液Ⅱ中的金属阳离子有___________
(5)请写出流程中用SO2进行还原时发生反应的离子方程式:___________

已知:①酸浸后的溶液中的金属离子主要是Cr3+,其次是Fe3+、Al3+、Ca2+和Mg2+。
②常温下,部分阳离子以氢氧化物形式沉淀时溶液的pH如下:
| 阳离子 | Fe3+ | Mg2+ | Al3+ | Cr3+ |
| 沉淀完全时的pH | 3.7 | 11.1 | 5.4 | 9 |
| 沉淀溶解时的pH | — | — | >8溶解 | >9溶解 |
(2)经氧化环节滤液Ⅰ中的Cr3+转化为Cr2O
 ,写出此反应的离子方程式:
,写出此反应的离子方程式:(3)调pH=8环节,既可以将溶液中某些杂质离子转化为沉淀,同时又可以将Cr2O
 转化为某种含铬元素微粒,溶液颜色由橙色变为黄色,请结合离子反应方程式解释该颜色变化的原因
转化为某种含铬元素微粒,溶液颜色由橙色变为黄色,请结合离子反应方程式解释该颜色变化的原因(4)钠离子交换树脂的反应原理为Mn++nNaR
 MRn+nNa+,则利用钠离子交换树脂可除去滤液Ⅱ中的金属阳离子有
MRn+nNa+,则利用钠离子交换树脂可除去滤液Ⅱ中的金属阳离子有(5)请写出流程中用SO2进行还原时发生反应的离子方程式:
您最近一年使用:0次
名校
解题方法
9 . 某学生欲配制2.85mol/L的H2SO4溶液480mL,实验室有两种不同浓度的硫酸:①400mL25%的硫酸(ρ=1.18g/mL);②足量的18mol/L的硫酸。有三种规格的容量瓶:250mL、500mL、1000mL。老师要求把①中的硫酸全部用完,不足的部分由②来补充。请回答下列问题:
(1)实验所用25%的硫酸的物质的量浓度为___ mol/L(保留 1 位小数 )。
(2)配制该硫酸溶液应选用容量瓶为___ mL。
(3)配制时,该同学的操作顺序如下,请将操作步骤B、D补充完整。
A.将①中溶液全部注入烧杯中混合均匀;
B.用量筒准确量取所需的18mol/L的浓硫酸___ mL(保留 1 位小数 ),注入上述混合液中,并用玻璃棒搅拌,使其混合均匀;
C.将混合均匀的硫酸沿玻璃棒注入所选的容量瓶中;
D.用适量的水洗涤烧杯和玻璃棒2~3次,洗涤液均注入容量瓶中;
E.振荡,继续向容量瓶中加水,直到液面接近刻度线1~2cm处;
F.改用___ 加水,使溶液的凹液面恰好与刻度线相切;
G.将容量瓶盖紧,振荡,摇匀。
(4)在配制上述溶液实验中,下列操作引起所配硫酸溶液浓度偏低的有___ 。
A.该学生在量取②的浓硫酸时,俯视刻度线
B.在烧杯中溶解搅拌时,溅出少量溶液
C.没有用蒸馏水洗涤烧杯2~3次,并将洗液移入容量瓶中
D.容量瓶中原来存有少量蒸馏水
(5)下列说法错误的是___ 。
A.通常容量瓶上有温度、规格(体积)、0刻线,这三个标识
B.容量瓶使用前要先检查气密性,然后再清洗、烘干
C.定容时加水超过刻度线,需要重新配制
D.振荡摇匀后发现液面低于刻度线,必须重新配制
(1)实验所用25%的硫酸的物质的量浓度为
(2)配制该硫酸溶液应选用容量瓶为
(3)配制时,该同学的操作顺序如下,请将操作步骤B、D补充完整。
A.将①中溶液全部注入烧杯中混合均匀;
B.用量筒准确量取所需的18mol/L的浓硫酸
C.将混合均匀的硫酸沿玻璃棒注入所选的容量瓶中;
D.用适量的水洗涤烧杯和玻璃棒2~3次,洗涤液均注入容量瓶中;
E.振荡,继续向容量瓶中加水,直到液面接近刻度线1~2cm处;
F.改用
G.将容量瓶盖紧,振荡,摇匀。
(4)在配制上述溶液实验中,下列操作引起所配硫酸溶液浓度偏低的有
A.该学生在量取②的浓硫酸时,俯视刻度线
B.在烧杯中溶解搅拌时,溅出少量溶液
C.没有用蒸馏水洗涤烧杯2~3次,并将洗液移入容量瓶中
D.容量瓶中原来存有少量蒸馏水
(5)下列说法错误的是
A.通常容量瓶上有温度、规格(体积)、0刻线,这三个标识
B.容量瓶使用前要先检查气密性,然后再清洗、烘干
C.定容时加水超过刻度线,需要重新配制
D.振荡摇匀后发现液面低于刻度线,必须重新配制
您最近一年使用:0次
解答题-实验探究题
|
适中(0.65)
|
名校
解题方法
10 . 实验室常用浓盐酸的质量分数为36.5%,密度为1.20 g/cm3。
(1)此盐酸的物质的量浓度为_____ 。
(2)需要230 mL3.0 mol·L-1的盐酸,配制时需以上浓盐酸的体积为_____ mL。
(3)上述实验中所用到的玻璃仪器有烧杯、玻璃棒、量筒以及_____ (两种仪器)。
(4)用浓盐酸配制3.00 mol·L-1稀盐酸,操作步骤的正确顺序是________ (填字母代号)。
a.计算需要浓盐酸的体积
b.用量筒量取浓盐酸
c.将烧杯中的溶液注入所需容积的容量瓶中,瓶用少量蒸馏水洗涤烧杯和玻璃棒2~3次,洗涤液也注入容量瓶
d.把量好体积的浓盐酸倒入烧杯中,加适量蒸馏水稀释,冷却
e.盖好瓶塞,反复上下颠倒,摇匀
f.继续向容量瓶中加蒸馏水至刻度线下1~2 cm处,改用某仪器小心滴加蒸馏水至凹液面与刻度线相平
(5)下列操作使溶液物质的量浓度偏高的是:________ 。
A.量取浓盐酸时仰视刻度线
B.容量瓶洗净后未经干燥处理
C.未冷却至室温就转移定容
D.将洗涤量筒的洗涤液转移到容量瓶中
E.定容时俯视刻度线
F.摇匀后立即观察,发现溶液未达到刻度线,再加几滴蒸馏水至刻度线
(1)此盐酸的物质的量浓度为
(2)需要230 mL3.0 mol·L-1的盐酸,配制时需以上浓盐酸的体积为
(3)上述实验中所用到的玻璃仪器有烧杯、玻璃棒、量筒以及
(4)用浓盐酸配制3.00 mol·L-1稀盐酸,操作步骤的正确顺序是
a.计算需要浓盐酸的体积
b.用量筒量取浓盐酸
c.将烧杯中的溶液注入所需容积的容量瓶中,瓶用少量蒸馏水洗涤烧杯和玻璃棒2~3次,洗涤液也注入容量瓶
d.把量好体积的浓盐酸倒入烧杯中,加适量蒸馏水稀释,冷却
e.盖好瓶塞,反复上下颠倒,摇匀
f.继续向容量瓶中加蒸馏水至刻度线下1~2 cm处,改用某仪器小心滴加蒸馏水至凹液面与刻度线相平
(5)下列操作使溶液物质的量浓度偏高的是:
A.量取浓盐酸时仰视刻度线
B.容量瓶洗净后未经干燥处理
C.未冷却至室温就转移定容
D.将洗涤量筒的洗涤液转移到容量瓶中
E.定容时俯视刻度线
F.摇匀后立即观察,发现溶液未达到刻度线,再加几滴蒸馏水至刻度线
您最近一年使用:0次
2020-10-22更新
|
385次组卷
|
4卷引用:专题03 溶液——备战2021年高考化学纠错笔记
(已下线)专题03 溶液——备战2021年高考化学纠错笔记(已下线)专题02 物质的量在化学实验中的应用(热点讲义)-2022届高考化学一轮复习热点题型归纳与变式训练山东省济南市平阴县第一中学2021-2022学年高一上学期10月阶段检测化学试题山东省枣庄市第三中学2020-2021学年高一上学期10月月考化学试题



