名校
1 . 填空计算,不用写计算过程。
(1)一定量的液态化合物XY2在一定量的氧气(标准状况)中恰好完全燃烧,反应的化学方程式为XY2(l)+3O2(g)=XO2(g)+2YO2(g)。冷却后,在标准状况下测得生成物的体积为672mL,密度为2.56g·L-1,则:反应前O2的体积是_______ mL。化合物XY2的摩尔质量是_______ g/mol。
(2)用98%(密度为1.84g/cm3)的浓硫酸配制1mol/L的稀硫酸200mL需浓硫酸_______ mL。(保留小数点后一位)
(3)用1mol·L-1的Na2SO3溶液60mL恰好将一定物质的量的XO ,还原,已知氧化产物为
,还原,已知氧化产物为 ,而元素X在还原产物中的化合价为+4,则反应的XO
,而元素X在还原产物中的化合价为+4,则反应的XO 的物质的量是
的物质的量是_______ mol。
(1)一定量的液态化合物XY2在一定量的氧气(标准状况)中恰好完全燃烧,反应的化学方程式为XY2(l)+3O2(g)=XO2(g)+2YO2(g)。冷却后,在标准状况下测得生成物的体积为672mL,密度为2.56g·L-1,则:反应前O2的体积是
(2)用98%(密度为1.84g/cm3)的浓硫酸配制1mol/L的稀硫酸200mL需浓硫酸
(3)用1mol·L-1的Na2SO3溶液60mL恰好将一定物质的量的XO
 ,还原,已知氧化产物为
,还原,已知氧化产物为 ,而元素X在还原产物中的化合价为+4,则反应的XO
,而元素X在还原产物中的化合价为+4,则反应的XO 的物质的量是
的物质的量是
您最近一年使用:0次
名校
2 . 回答下列问题
Ⅰ.现有下列10种物质:①NaHSO4固体②Ba(OH)2溶液③Cu ④酒精 ⑤烧碱 ⑥熔融KNO3 ⑦稀硝酸 ⑧硫酸 ⑨液态HCl ⑩氨气,回答下列问题:
(1)上述物质中能导电的是_______________ (填序号,下同);
(2)属于电解质的是________________ ,属于非电解质的是_______________ ;
(3)将②加入①的水溶液中至刚好沉淀完全的的离子方程式:____________________ 。
Ⅱ根据所学知识,完成相关题目:
(4)0.4 mol NH3分子中所含H原子数与______ 个H2O分子中所含H原子数相等。
(5)配制 240mL 0.2 mol·L-1 的碳酸钠溶液,应用托盘天平称取_____ g Na2CO3固体。
(6)某实验小组人员用质量分数为98 %,密度为1.84 g/cm3的浓硫酸配制100 mL 2.3 mol/L的稀硫酸。该浓硫酸的浓度为________ mol/L,需量取浓硫酸的体积为__________ mL。
Ⅰ.现有下列10种物质:①NaHSO4固体②Ba(OH)2溶液③Cu ④酒精 ⑤烧碱 ⑥熔融KNO3 ⑦稀硝酸 ⑧硫酸 ⑨液态HCl ⑩氨气,回答下列问题:
(1)上述物质中能导电的是
(2)属于电解质的是
(3)将②加入①的水溶液中至刚好沉淀完全的的离子方程式:
Ⅱ根据所学知识,完成相关题目:
(4)0.4 mol NH3分子中所含H原子数与
(5)配制 240mL 0.2 mol·L-1 的碳酸钠溶液,应用托盘天平称取
(6)某实验小组人员用质量分数为98 %,密度为1.84 g/cm3的浓硫酸配制100 mL 2.3 mol/L的稀硫酸。该浓硫酸的浓度为
您最近一年使用:0次
3 . 计算题,写出详细计算过程。
(1)配制470mL 0.1mol/L NaOH溶液需要NaOH的质量是多少?___________
(2)标准状况下,11.2L的NH3的分子数为多少?___________
(1)配制470mL 0.1mol/L NaOH溶液需要NaOH的质量是多少?
(2)标准状况下,11.2L的NH3的分子数为多少?
您最近一年使用:0次
21-22高一上·江苏苏州·阶段练习
4 . 回答下列问题:
(1)标准状况下,11.2 LNH3所含氢原子的物质的量为_______ 。
(2)0.87gR2SO4中含0.01molR+,则R2SO4的摩尔质量是_______ 。
(3)已知每100g乳酸中含碳元素40.00g中,含氢元素6.67g,其余都是氧元素,则乳酸分子中N(C):N(H):N(O)_______ (最简整数比)。
(4)年某无土栽培用的营养液,要求KCl、K2SO4和NH4Cl三种固体原料的物质的量之比为1:4:8,若采用(NH4)2SO4和KCl来配制该营养液,则(NH4)2SO4和KCl物质的量之比为_______ 。
(5)实验室使用的浓盐酸的溶质质量分数为36.5%,密度为1.19g·cm-3,则该浓盐酸的物质的量浓度为_______ 。
(6)航天飞机释放出的CO2气体通过含有LiOH滤毒罐而被除去,发生下以反应:CO2+2LiOH= Li2CO3+H2O。若要除去0.448 m3CO2 (标准状况)需要_______ 克LiOH?(写出计算过程)
(1)标准状况下,11.2 LNH3所含氢原子的物质的量为
(2)0.87gR2SO4中含0.01molR+,则R2SO4的摩尔质量是
(3)已知每100g乳酸中含碳元素40.00g中,含氢元素6.67g,其余都是氧元素,则乳酸分子中N(C):N(H):N(O)
(4)年某无土栽培用的营养液,要求KCl、K2SO4和NH4Cl三种固体原料的物质的量之比为1:4:8,若采用(NH4)2SO4和KCl来配制该营养液,则(NH4)2SO4和KCl物质的量之比为
(5)实验室使用的浓盐酸的溶质质量分数为36.5%,密度为1.19g·cm-3,则该浓盐酸的物质的量浓度为
(6)航天飞机释放出的CO2气体通过含有LiOH滤毒罐而被除去,发生下以反应:CO2+2LiOH= Li2CO3+H2O。若要除去0.448 m3CO2 (标准状况)需要
您最近一年使用:0次
名校
5 . “84消毒液”能有效杀灭甲型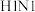 病毒,某同学购买了一瓶“威露士”牌“84消毒液”,并查阅相关资料和消毒液包装说明得到如下信息:“84消毒液”:含25%
病毒,某同学购买了一瓶“威露士”牌“84消毒液”,并查阅相关资料和消毒液包装说明得到如下信息:“84消毒液”:含25% 、
、 、密度
、密度 ,稀释100倍(体积比)后使用。请根据以上信息和相关知识回答下列问题:
,稀释100倍(体积比)后使用。请根据以上信息和相关知识回答下列问题:
(1)该“84消毒液”的物质的量浓度为___________ 。
(2)该同学取100mL“威露士”牌“84消毒液”稀释后用于消毒(假设稀释后溶液密度为 ),稀释后的溶液中
),稀释后的溶液中
___________  。
。
(3)一瓶“威露士”牌“84消毒液”能吸收空气中___________  的
的 (标准状况)而变质。(已知:
(标准状况)而变质。(已知: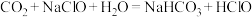 )
)
(4)该同学参阅“威露士”牌“84消毒液”的配方,欲用 固体配制
固体配制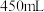 、
、
 的消毒液。
的消毒液。
①利用购买的商品 来配制可能导致结果
来配制可能导致结果___________ (偏高,偏低,无影响)。
②需要用托盘天平称量的 固体质量为
固体质量为___________ 克。
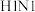 病毒,某同学购买了一瓶“威露士”牌“84消毒液”,并查阅相关资料和消毒液包装说明得到如下信息:“84消毒液”:含25%
病毒,某同学购买了一瓶“威露士”牌“84消毒液”,并查阅相关资料和消毒液包装说明得到如下信息:“84消毒液”:含25% 、
、 、密度
、密度 ,稀释100倍(体积比)后使用。请根据以上信息和相关知识回答下列问题:
,稀释100倍(体积比)后使用。请根据以上信息和相关知识回答下列问题:(1)该“84消毒液”的物质的量浓度为
(2)该同学取100mL“威露士”牌“84消毒液”稀释后用于消毒(假设稀释后溶液密度为
 ),稀释后的溶液中
),稀释后的溶液中
 。
。(3)一瓶“威露士”牌“84消毒液”能吸收空气中
 的
的 (标准状况)而变质。(已知:
(标准状况)而变质。(已知: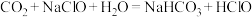 )
)(4)该同学参阅“威露士”牌“84消毒液”的配方,欲用
 固体配制
固体配制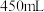 、
、
 的消毒液。
的消毒液。①利用购买的商品
 来配制可能导致结果
来配制可能导致结果②需要用托盘天平称量的
 固体质量为
固体质量为
您最近一年使用:0次
2021-10-15更新
|
294次组卷
|
3卷引用:云南省普洱市第一中学天有实验学校2021-2022学年高一上学期期中考试化学试题
名校
6 . 回答下列问题:
(1)标准状况下,1.7gNH3与___ LH2S气体含有的氢原子数相同。
(2)标准状况,NH3与CH4组成的混合气体的平均密度为0.75g·L-1,该混合气体的平均摩尔质量为___ ,NH3的体积分数为___ 。
(3)常温下,在27.9g水中溶解12.1gCu(NO3)2·3H2O,恰好达到饱和。设该溶液密度为1.20g·cm-3。
求:①溶质的质量分数为___ 。
②该溶液中NO 的物质的量浓度为
的物质的量浓度为___ 。
③取出20.0mL该溶液,配成浓度为1.00mol·L-1的稀溶液,则稀释后溶液的体积是___ mL。
④将一根质量为100g的铁棒插入到该溶液中,一段时间后取出,洗净、干燥后称量,铁棒的质量变为100.2g,此时溶液中Fe(NO3)2的物质的量浓度是___ (忽略溶液体积的变化)。
(1)标准状况下,1.7gNH3与
(2)标准状况,NH3与CH4组成的混合气体的平均密度为0.75g·L-1,该混合气体的平均摩尔质量为
(3)常温下,在27.9g水中溶解12.1gCu(NO3)2·3H2O,恰好达到饱和。设该溶液密度为1.20g·cm-3。
求:①溶质的质量分数为
②该溶液中NO
 的物质的量浓度为
的物质的量浓度为③取出20.0mL该溶液,配成浓度为1.00mol·L-1的稀溶液,则稀释后溶液的体积是
④将一根质量为100g的铁棒插入到该溶液中,一段时间后取出,洗净、干燥后称量,铁棒的质量变为100.2g,此时溶液中Fe(NO3)2的物质的量浓度是
您最近一年使用:0次
2021高一·全国·专题练习
7 . 一位同学欲配制6 mol·L-1的H2SO4溶液。他找来了三种不同浓度的硫酸:①240 mL 1 mol·L-1的硫酸;②150 mL 25%的硫酸(ρ=1.18 g·mL-1);③足量的18 mol·L-1的浓硫酸。另外,他找来了三种规格的容量瓶:250 mL容量瓶;500 mL容量瓶;1 000 mL容量瓶。这位同学希望将①②两种硫酸全部用完,不足部分再由③补充。请通过计算,帮助这位同学确定选用哪种规格的容量瓶______ ,以及需要浓硫酸的体积是______ 。
您最近一年使用:0次
名校
8 . 图为实验室某浓盐酸试剂瓶标签上的有关数据,试根据标签上的有关数据回答下列问题(须写出解题过程)

(1)该浓盐酸中HCl的物质的量浓度为多少?_____
(2)某学生欲用上述浓盐酸和蒸馏水配制500 mL、物质的量浓度为0.5 mol·L-1的稀盐酸。该学生需要用量筒量取上述浓盐酸多少毫升?_______ (答案保留一位小数)

(1)该浓盐酸中HCl的物质的量浓度为多少?
(2)某学生欲用上述浓盐酸和蒸馏水配制500 mL、物质的量浓度为0.5 mol·L-1的稀盐酸。该学生需要用量筒量取上述浓盐酸多少毫升?
您最近一年使用:0次
名校
9 . (1)有标准状况下的四种气体:①6.72 L CH4,②3.01×1023个H2分子,③3.4 g H2S,④0.2 mol NH3,则其体积按从大到小的顺序为:_______ (填序号)。
(2)标准状况下,测得1.92克某气体的体积为672 mL,则此气体的相对分子质量为_______ 。
(3)实验室用Na2CO3•10H2O晶体配制0.5mol/L的Na2CO3溶液970mL,应称取Na2CO3•10H2O的质量是_______ 。
(4)某学生欲用12mol•L-1浓盐酸和蒸馏水配制500 mL 0.3 mol•L-1的稀盐酸。
①该学生需要量取_______ mL上述浓盐酸进行配制。
②下列实验操作会导致所配制的稀盐酸的物质的量浓度偏小的是_______ (填序号)。
a.用量筒量取浓盐酸时俯视观察凹液面
b.将量取浓盐酸的量筒进行洗涤,并将洗涤液转移到容量瓶中
c.稀释浓盐酸时,未冷却到室温即转移到容量瓶中
d.定容后经振荡、摇匀、静置,发现液面下降,再加适量的蒸馏水
e.容量瓶洗涤干净后未干燥
(2)标准状况下,测得1.92克某气体的体积为672 mL,则此气体的相对分子质量为
(3)实验室用Na2CO3•10H2O晶体配制0.5mol/L的Na2CO3溶液970mL,应称取Na2CO3•10H2O的质量是
(4)某学生欲用12mol•L-1浓盐酸和蒸馏水配制500 mL 0.3 mol•L-1的稀盐酸。
①该学生需要量取
②下列实验操作会导致所配制的稀盐酸的物质的量浓度偏小的是
a.用量筒量取浓盐酸时俯视观察凹液面
b.将量取浓盐酸的量筒进行洗涤,并将洗涤液转移到容量瓶中
c.稀释浓盐酸时,未冷却到室温即转移到容量瓶中
d.定容后经振荡、摇匀、静置,发现液面下降,再加适量的蒸馏水
e.容量瓶洗涤干净后未干燥
您最近一年使用:0次
10 . 分类法在化学中起着非常重要的作用,现有下列物质:①Cl2、②NaOH溶液、③Cu、④冰水混合物、⑤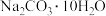 、⑥稀硫酸、⑦CO2、⑧镁铝合金。请回答下列问题:
、⑥稀硫酸、⑦CO2、⑧镁铝合金。请回答下列问题:
(1)属于纯净物的有_______ ,属于氧化物的有_______ 。
(2)能导电的物质有_______ ,属于电解质的有_______ 。
(3)实验室中制取少量氢氧化铁胶体的离子方程式为_______ 。
(4)已知Cl2与NaOH反应的化学方程式是 ,该反应中氧化剂与还原剂的物质的量之比为
,该反应中氧化剂与还原剂的物质的量之比为_______ 。
(5)已知实验需要240mL0.5mol/L硫酸,但实验室中只有物质的量浓度为lmol/L的硫酸,该同学需要自己稀释,需要量取_______ mL1mol/L的硫酸。
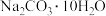 、⑥稀硫酸、⑦CO2、⑧镁铝合金。请回答下列问题:
、⑥稀硫酸、⑦CO2、⑧镁铝合金。请回答下列问题:(1)属于纯净物的有
(2)能导电的物质有
(3)实验室中制取少量氢氧化铁胶体的离子方程式为
(4)已知Cl2与NaOH反应的化学方程式是
 ,该反应中氧化剂与还原剂的物质的量之比为
,该反应中氧化剂与还原剂的物质的量之比为(5)已知实验需要240mL0.5mol/L硫酸,但实验室中只有物质的量浓度为lmol/L的硫酸,该同学需要自己稀释,需要量取
您最近一年使用:0次
2021-02-07更新
|
198次组卷
|
2卷引用:广西河池市2020-2021学年高一上学期期末教学质量检测化学试题



