1 . 硫代硫酸钠(Na2S2O3)是常用的分析试剂,也可用作纸浆漂白时的脱氯剂,可由Na2S、Na2SO3为原料制得。实验小组将制取Na2S2O3所用的Na2S进行提纯,然后制取Na2S2O3并对其含量进行了测定。
(1)工业生产Na2S的方法之一是将炭在高温下与Na2SO4反应,所得Na2S固体中含有炭、Na2SO4、Na2SO3、Na2CO3等杂质。实验室所用Na2S可由工业产品净化得到。
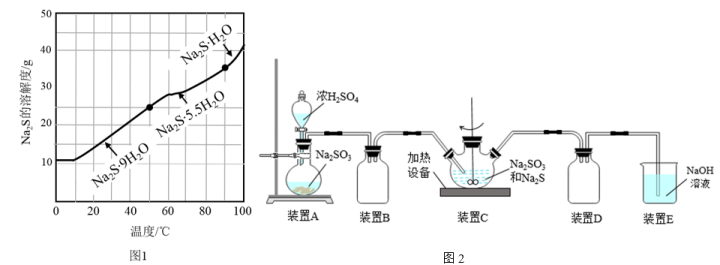
①请设计提纯工业Na2S,制取Na2S·9H2O晶体的实验方案:___________ 。(实验中需使用的试剂有BaS溶液,Na2S的溶解度随温度变化曲线、不同温度区间内析出晶体的类型如图1所示)
②设计检验工业Na2S产品是否存在Na2SO3的实验方案:___________ 。
(2)实验小组用如图2所示的装置制取Na2S2O3溶液:
①装置C中的反应分为两步,第二步反应为S+Na2SO3=Na2S2O3,则第一反应的化学方程式为___________ 。
②判断装置C中反应已经完全的方法是___________ 。
(3)将装置C反应后的溶液进行结晶,得到Na2S2O3·5H2O晶体样品。用K2Cr2O7标准溶液测定样品的纯度,步骤如下:称取1.5000 g样品,用蒸馏水溶解,配成100 mL溶液。取0.0100 mol·L-1的K2Cr2O7标准溶液20.00 mL,用硫酸酸化后加入过量KI,然后用样品溶液滴定至淡黄绿色,加入淀粉溶液作指示剂,继续滴定,恰好完全反应时消耗样品溶液的体积为20.00 mL。
实验过程中发生的反应为:Cr2O +6I-+14H+=2Cr3++3I2+7H2O I2+2S2O
+6I-+14H+=2Cr3++3I2+7H2O I2+2S2O =S4O
=S4O +2I-
+2I-
①计算样品的纯度。(写出计算过程)___________
②若样品杂质中含有Na2SO3,则所测样品的纯度___________ (填“偏高”、“偏低”或“无影响”)。
(1)工业生产Na2S的方法之一是将炭在高温下与Na2SO4反应,所得Na2S固体中含有炭、Na2SO4、Na2SO3、Na2CO3等杂质。实验室所用Na2S可由工业产品净化得到。
①请设计提纯工业Na2S,制取Na2S·9H2O晶体的实验方案:

②设计检验工业Na2S产品是否存在Na2SO3的实验方案:
(2)实验小组用如图2所示的装置制取Na2S2O3溶液:
①装置C中的反应分为两步,第二步反应为S+Na2SO3=Na2S2O3,则第一反应的化学方程式为
②判断装置C中反应已经完全的方法是
(3)将装置C反应后的溶液进行结晶,得到Na2S2O3·5H2O晶体样品。用K2Cr2O7标准溶液测定样品的纯度,步骤如下:称取1.5000 g样品,用蒸馏水溶解,配成100 mL溶液。取0.0100 mol·L-1的K2Cr2O7标准溶液20.00 mL,用硫酸酸化后加入过量KI,然后用样品溶液滴定至淡黄绿色,加入淀粉溶液作指示剂,继续滴定,恰好完全反应时消耗样品溶液的体积为20.00 mL。
实验过程中发生的反应为:Cr2O
 +6I-+14H+=2Cr3++3I2+7H2O I2+2S2O
+6I-+14H+=2Cr3++3I2+7H2O I2+2S2O =S4O
=S4O +2I-
+2I-①计算样品的纯度。(写出计算过程)
②若样品杂质中含有Na2SO3,则所测样品的纯度
您最近半年使用:0次



