解题方法
1 .  在生产和生活中用途广泛。
在生产和生活中用途广泛。
Ⅰ. 溶液的配制及浓度的标定
溶液的配制及浓度的标定
(1) 溶液的配制
溶液的配制
①配制100mL一定浓度的 溶液需用到的仪器有
溶液需用到的仪器有___________ (填字母)。 溶液时,需要将
溶液时,需要将 固体溶解在浓盐酸中,原因为
固体溶解在浓盐酸中,原因为___________ 。
(2) 溶液浓度的标定
溶液浓度的标定
量取10.00mL 溶液于碘量瓶中,加入过量KI溶液,充分反应后加入少量淀粉溶液、再用
溶液于碘量瓶中,加入过量KI溶液,充分反应后加入少量淀粉溶液、再用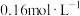
 标准溶液滴定至蓝色恰好消失,重复操作三次,平均消耗
标准溶液滴定至蓝色恰好消失,重复操作三次,平均消耗 标准溶液的体积为20.00mL,已知:
标准溶液的体积为20.00mL,已知: ,则该
,则该 溶液的浓度为
溶液的浓度为___________  。
。
Ⅱ. 与
与 反应的探究
反应的探究
(3)预测现象1:向 溶液中加入
溶液中加入 溶液,溶液由黄色变为浅绿色。作出该预测的原因为
溶液,溶液由黄色变为浅绿色。作出该预测的原因为___________ (用离子方程式表示)。
预测现象2:向 溶液中加入
溶液中加入 溶液,生成红褐色沉淀。
溶液,生成红褐色沉淀。
(4)实验验证:小组同学设计以下实验探究溶液中 浓度相同时
浓度相同时 的加入量对反应的影响,其中
的加入量对反应的影响,其中 溶液为Ⅰ中所配溶液,
溶液为Ⅰ中所配溶液, 溶液浓度为
溶液浓度为 。静置6小时观察现象,测定反应后溶液的pH,并记录数据:
。静置6小时观察现象,测定反应后溶液的pH,并记录数据:
①请补充表格中的数据:a=___________ 。
②实验ⅱ~ⅳ中,反应后溶液的pH基本不变,其原因可能是___________ 。
③实验ⅵ和ⅶ的实验现象说明溶液中 的水解与
的水解与 的水解相互促进(即发生了双水解反应),请写出反应的化学方程式:
的水解相互促进(即发生了双水解反应),请写出反应的化学方程式:___________ 。
④甲同学认为实验ⅵ和ⅶ中, 与
与 除发生双水解反应外,还发生了氧化还原反应。请设计实验证明猜想:分别取实验ⅵ和ⅶ中上层清液于两支试管中,
除发生双水解反应外,还发生了氧化还原反应。请设计实验证明猜想:分别取实验ⅵ和ⅶ中上层清液于两支试管中,___________ (填实验操作与现象),则说明猜想成立。
(5)请举出一种水解反应在生产或生活中的应用:___________ 。
 在生产和生活中用途广泛。
在生产和生活中用途广泛。Ⅰ.
 溶液的配制及浓度的标定
溶液的配制及浓度的标定(1)
 溶液的配制
溶液的配制①配制100mL一定浓度的
 溶液需用到的仪器有
溶液需用到的仪器有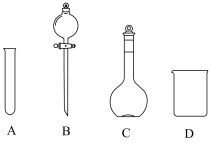
 溶液时,需要将
溶液时,需要将 固体溶解在浓盐酸中,原因为
固体溶解在浓盐酸中,原因为(2)
 溶液浓度的标定
溶液浓度的标定量取10.00mL
 溶液于碘量瓶中,加入过量KI溶液,充分反应后加入少量淀粉溶液、再用
溶液于碘量瓶中,加入过量KI溶液,充分反应后加入少量淀粉溶液、再用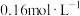
 标准溶液滴定至蓝色恰好消失,重复操作三次,平均消耗
标准溶液滴定至蓝色恰好消失,重复操作三次,平均消耗 标准溶液的体积为20.00mL,已知:
标准溶液的体积为20.00mL,已知: ,则该
,则该 溶液的浓度为
溶液的浓度为 。
。Ⅱ.
 与
与 反应的探究
反应的探究(3)预测现象1:向
 溶液中加入
溶液中加入 溶液,溶液由黄色变为浅绿色。作出该预测的原因为
溶液,溶液由黄色变为浅绿色。作出该预测的原因为预测现象2:向
 溶液中加入
溶液中加入 溶液,生成红褐色沉淀。
溶液,生成红褐色沉淀。(4)实验验证:小组同学设计以下实验探究溶液中
 浓度相同时
浓度相同时 的加入量对反应的影响,其中
的加入量对反应的影响,其中 溶液为Ⅰ中所配溶液,
溶液为Ⅰ中所配溶液, 溶液浓度为
溶液浓度为 。静置6小时观察现象,测定反应后溶液的pH,并记录数据:
。静置6小时观察现象,测定反应后溶液的pH,并记录数据:| 序号 | ⅰ | ⅱ | ⅲ | ⅳ | ⅴ | ⅵ | ⅶ |
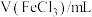 | 2.0 | 2.0 | 2.0 | 2.0 | 2.0 | 2.0 | 2.0 |
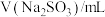 | 0 | 1.0 | 2.0 | 5.0 | a | 20.0 | 26.0 |
 | 38.0 | 37.0 | 36.0 | 33.0 | 23.0 | 18.0 | 12.0 |
| 现象 | 溶液接近无色透明 | 出现褐色沉淀 | |||||
| pH | 1.7 | 1.7 | 1.7 | 1.8 | 2.8 | 5.4 | 6.2 |
②实验ⅱ~ⅳ中,反应后溶液的pH基本不变,其原因可能是
③实验ⅵ和ⅶ的实验现象说明溶液中
 的水解与
的水解与 的水解相互促进(即发生了双水解反应),请写出反应的化学方程式:
的水解相互促进(即发生了双水解反应),请写出反应的化学方程式:④甲同学认为实验ⅵ和ⅶ中,
 与
与 除发生双水解反应外,还发生了氧化还原反应。请设计实验证明猜想:分别取实验ⅵ和ⅶ中上层清液于两支试管中,
除发生双水解反应外,还发生了氧化还原反应。请设计实验证明猜想:分别取实验ⅵ和ⅶ中上层清液于两支试管中,(5)请举出一种水解反应在生产或生活中的应用:
您最近半年使用:0次
2 . 某小组探究不同阴离子与 的结合倾向并分析相关转化。
的结合倾向并分析相关转化。
资料:ⅰ. 和
和 均为白色,难溶于水。
均为白色,难溶于水。
ⅱ. 与
与 、
、 能生成
能生成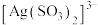 、
、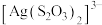 。
。
ⅲ.与 结合倾向
结合倾向 。
。
(1)探究 、
、 与
与 的结合倾向
的结合倾向
①由实验Ⅰ推测:与 结合倾向
结合倾向
______  (填“>”或“<”)。
(填“>”或“<”)。
②取两等份 浊液,分别滴加等浓度、等体积的
浊液,分别滴加等浓度、等体积的 和
和 溶液,前者无明显现象,后者浊液变澄清,澄清溶液中
溶液,前者无明显现象,后者浊液变澄清,澄清溶液中 价银的主要存在形式
价银的主要存在形式_______ (填化学式)。推测:与 结合倾向
结合倾向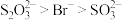 。查阅资料证实了上述推测。
。查阅资料证实了上述推测。
(2) 的转化
的转化
①写出实验Ⅲ中白色沉淀消失的离子方程式___________ 。
②查阅资料:实验Ⅳ中黑色沉淀是 ,
, 中S元素的化合价分别为
中S元素的化合价分别为 和
和 。写出实验Ⅳ中白色沉淀变为黑色的化学方程式:
。写出实验Ⅳ中白色沉淀变为黑色的化学方程式:___________ 。
③ 溶液可用作定影液。向
溶液可用作定影液。向 溶液溶解
溶液溶解 之后的废定影液中,加入
之后的废定影液中,加入___________ (填试剂和操作),可重新得到 。
。
(3) 的转化
的转化

分析试管1出现银镜的原因___________ 。
(4)资料显示: 与
与 结构相似,
结构相似, 可看作
可看作 外围的一个O被S替换的结果。但与
外围的一个O被S替换的结果。但与 的配位倾向:
的配位倾向: ,试从结构角度解释原因
,试从结构角度解释原因___________ 。
 的结合倾向并分析相关转化。
的结合倾向并分析相关转化。资料:ⅰ.
 和
和 均为白色,难溶于水。
均为白色,难溶于水。ⅱ.
 与
与 、
、 能生成
能生成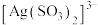 、
、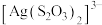 。
。ⅲ.与
 结合倾向
结合倾向 。
。(1)探究
 、
、 与
与 的结合倾向
的结合倾向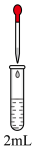 | 实验 | 滴管 | 试管 | 现象 |
| Ⅰ | 10滴 溶液 溶液 | 等浓度的 和 和 溶液 溶液 | 黄色沉淀 | |
| Ⅱ | 等浓度的 和 和 溶液 溶液 | 黄色沉淀 |
 结合倾向
结合倾向
 (填“>”或“<”)。
(填“>”或“<”)。②取两等份
 浊液,分别滴加等浓度、等体积的
浊液,分别滴加等浓度、等体积的 和
和 溶液,前者无明显现象,后者浊液变澄清,澄清溶液中
溶液,前者无明显现象,后者浊液变澄清,澄清溶液中 价银的主要存在形式
价银的主要存在形式 结合倾向
结合倾向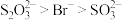 。查阅资料证实了上述推测。
。查阅资料证实了上述推测。(2)
 的转化
的转化 | 实验 | 滴管 | 试管 | 现象 |
| Ⅲ | 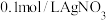 溶液 溶液 | 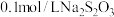 溶液 溶液 | 白色沉淀,振荡后消失 | |
| Ⅳ | 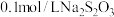 溶液 溶液 | 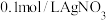 溶液 溶液 | 白色沉淀,逐渐变为灰色,最终为黑色沉淀 |
②查阅资料:实验Ⅳ中黑色沉淀是
 ,
, 中S元素的化合价分别为
中S元素的化合价分别为 和
和 。写出实验Ⅳ中白色沉淀变为黑色的化学方程式:
。写出实验Ⅳ中白色沉淀变为黑色的化学方程式:③
 溶液可用作定影液。向
溶液可用作定影液。向 溶液溶解
溶液溶解 之后的废定影液中,加入
之后的废定影液中,加入 。
。(3)
 的转化
的转化
分析试管1出现银镜的原因
(4)资料显示:
 与
与 结构相似,
结构相似, 可看作
可看作 外围的一个O被S替换的结果。但与
外围的一个O被S替换的结果。但与 的配位倾向:
的配位倾向: ,试从结构角度解释原因
,试从结构角度解释原因
您最近半年使用:0次
名校
解题方法
3 . 设计实验探究NO的氧化性。
实验Ⅰ:用排水法收集一瓶NO,将其倒扣在盛有碱性 溶液的水槽中,振荡,观察到集气瓶中液面上升。
溶液的水槽中,振荡,观察到集气瓶中液面上升。
资料:ⅰ.NO与碱性 溶液会发生氧化还原反应,
溶液会发生氧化还原反应, 被还原为
被还原为 。
。
ⅱ. 与
与 反应生成黄色沉淀。
反应生成黄色沉淀。
某同学认为,需通过进一步实验验证NO的氧化性,补充以下实验:
实验Ⅱ:取饱和 溶液,加入少量冰醋酸,再滴加5滴
溶液,加入少量冰醋酸,再滴加5滴 的
的 溶液,无明显变化。
溶液,无明显变化。
实验Ⅲ:
(1)取少量实验Ⅰ反应后集气瓶中的溶液,加入少量冰醋酸,再滴加5滴 的
的 溶液,
溶液,___________ (填实验现象)。
上述实验证明NO有氧化性。
(2)实验Ⅱ的目的是___________
(3)写出NO与碱性 溶液反应的离子方程式
溶液反应的离子方程式___________
(4)一个氧化还原反应可以看成“氧化”和“还原”两个半反应,试用此角度分析NO与碱性 溶液的反应。若还原反应为:
溶液的反应。若还原反应为: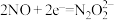 ,则氧化反应为:
,则氧化反应为:___________ 。
(5)某同学结合所学知识设计处理工业废气中 和NO的实验方案,达到消除污染,保护环境的目的。
和NO的实验方案,达到消除污染,保护环境的目的。
①先用饱和纯碱溶液吸收废气中的 ,生成
,生成 ,写出该反应的离子方程式
,写出该反应的离子方程式___________
②再向生成的溶液中加入一定量___________ ,以此溶液来吸收NO气体。
实验Ⅰ:用排水法收集一瓶NO,将其倒扣在盛有碱性
 溶液的水槽中,振荡,观察到集气瓶中液面上升。
溶液的水槽中,振荡,观察到集气瓶中液面上升。资料:ⅰ.NO与碱性
 溶液会发生氧化还原反应,
溶液会发生氧化还原反应, 被还原为
被还原为 。
。ⅱ.
 与
与 反应生成黄色沉淀。
反应生成黄色沉淀。某同学认为,需通过进一步实验验证NO的氧化性,补充以下实验:
实验Ⅱ:取饱和
 溶液,加入少量冰醋酸,再滴加5滴
溶液,加入少量冰醋酸,再滴加5滴 的
的 溶液,无明显变化。
溶液,无明显变化。实验Ⅲ:
(1)取少量实验Ⅰ反应后集气瓶中的溶液,加入少量冰醋酸,再滴加5滴
 的
的 溶液,
溶液,上述实验证明NO有氧化性。
(2)实验Ⅱ的目的是
(3)写出NO与碱性
 溶液反应的离子方程式
溶液反应的离子方程式(4)一个氧化还原反应可以看成“氧化”和“还原”两个半反应,试用此角度分析NO与碱性
 溶液的反应。若还原反应为:
溶液的反应。若还原反应为: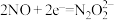 ,则氧化反应为:
,则氧化反应为:(5)某同学结合所学知识设计处理工业废气中
 和NO的实验方案,达到消除污染,保护环境的目的。
和NO的实验方案,达到消除污染,保护环境的目的。①先用饱和纯碱溶液吸收废气中的
 ,生成
,生成 ,写出该反应的离子方程式
,写出该反应的离子方程式②再向生成的溶液中加入一定量
您最近半年使用:0次
名校
4 . 回答下列问题:
(1)写出下列实验事实与所给酸对应的性质(填序号)
A.酸性 B.挥发性 C.吸水性 D.脱水性 E.不稳定性 F.氧化性
①浓硝酸使紫色石蕊试液先变红后褪色___________
②浓硫酸可作氯气的干燥剂___________
③浓硫酸加到蔗糖中,蔗糖变黑___________
(2)“绿色化学”的主要内容之一是指从技术、经济上设计可行的化学反应,使原子充分利用,不产生污染物。下列化学反应符合“绿色化学”理念的是___________
①制 :
: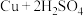 (浓)
(浓)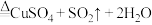
②制 ;
;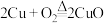 ;
; (稀)
(稀)
③制 :
: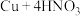 (浓)
(浓)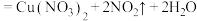
④制 :
: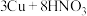 (稀)
(稀)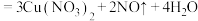
(3)某同学向 溶液中通入
溶液中通入 ,未观察到白色沉淀生成,由此可知酸性强弱:
,未观察到白色沉淀生成,由此可知酸性强弱:
___________ HCl(填“>”或“<”)。取上述所得溶液进行下列操作,能观察到白色沉淀生成的___________ (填字母)。
A.通入 B.滴加
B.滴加 溶液 C.滴加稀盐酸 D.滴加NaOH溶液
溶液 C.滴加稀盐酸 D.滴加NaOH溶液
(4) 中有+4价的硫,它既有氧化性又有还原性,现有试剂:溴水、
中有+4价的硫,它既有氧化性又有还原性,现有试剂:溴水、 溶液、
溶液、 、NaOH溶液、氨水。
、NaOH溶液、氨水。
①要证明 具有还原性,应选用的试剂是
具有还原性,应选用的试剂是___________ ,看到的现象是___________ 。
②选用 与
与 反应,反应的现象是
反应,反应的现象是___________ ,反应的离子方程式为___________ 。
(1)写出下列实验事实与所给酸对应的性质(填序号)
A.酸性 B.挥发性 C.吸水性 D.脱水性 E.不稳定性 F.氧化性
①浓硝酸使紫色石蕊试液先变红后褪色
②浓硫酸可作氯气的干燥剂
③浓硫酸加到蔗糖中,蔗糖变黑
(2)“绿色化学”的主要内容之一是指从技术、经济上设计可行的化学反应,使原子充分利用,不产生污染物。下列化学反应符合“绿色化学”理念的是
①制
 :
: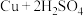 (浓)
(浓)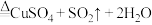
②制
 ;
;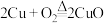 ;
; (稀)
(稀)
③制
 :
: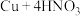 (浓)
(浓)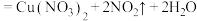
④制
 :
: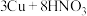 (稀)
(稀)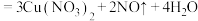
(3)某同学向
 溶液中通入
溶液中通入 ,未观察到白色沉淀生成,由此可知酸性强弱:
,未观察到白色沉淀生成,由此可知酸性强弱:
A.通入
 B.滴加
B.滴加 溶液 C.滴加稀盐酸 D.滴加NaOH溶液
溶液 C.滴加稀盐酸 D.滴加NaOH溶液(4)
 中有+4价的硫,它既有氧化性又有还原性,现有试剂:溴水、
中有+4价的硫,它既有氧化性又有还原性,现有试剂:溴水、 溶液、
溶液、 、NaOH溶液、氨水。
、NaOH溶液、氨水。①要证明
 具有还原性,应选用的试剂是
具有还原性,应选用的试剂是②选用
 与
与 反应,反应的现象是
反应,反应的现象是
您最近半年使用:0次
名校
解题方法
5 . 某固体混合物可能由SiO2、Fe2O3、Fe、Na2SO3、Na2CO3、BaCl2中的若干种物质组成,设计部分实验方案探究该固体混合物的成分,所加试剂均过量,下列说法正确的是
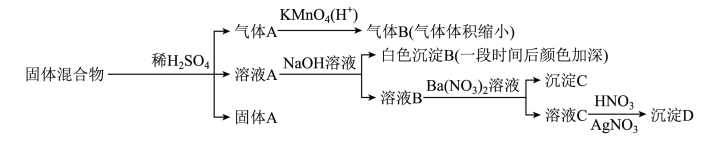

| A.气体A中一定含有H2 |
| B.该固体混合物中Fe2O3和Fe至少有其中一种 |
| C.固体A中可能含有BaSO4 |
| D.该固体混合物一定含有Na2CO3、Na2SO3、BaCl2 |
您最近半年使用:0次
2023-01-10更新
|
868次组卷
|
7卷引用:山东省济南市2022-2023学年高三上学期期中考试化学试题
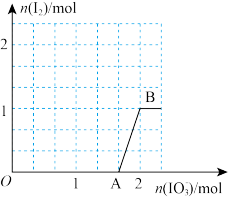
6 . 在含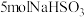 的溶液中逐滴加入
的溶液中逐滴加入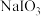 溶液,加入
溶液,加入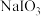 的物质的量和析出
的物质的量和析出 的物质的量的关系曲线如图所示,下列说法错误的是
的物质的量的关系曲线如图所示,下列说法错误的是
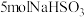 的溶液中逐滴加入
的溶液中逐滴加入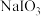 溶液,加入
溶液,加入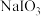 的物质的量和析出
的物质的量和析出 的物质的量的关系曲线如图所示,下列说法错误的是
的物质的量的关系曲线如图所示,下列说法错误的是
A.由图示可知还原性: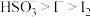 |
B.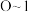 间发生反应: 间发生反应: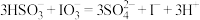 |
C.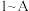 间共生成 间共生成 的物质的量为 的物质的量为 |
D.溶液中 与 与 的物质的量之比为5:3时,加入的 的物质的量之比为5:3时,加入的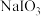 为 为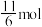 |
您最近半年使用:0次
7 . 实验室用浓硫酸与铜丝加热生成的 制备少量
制备少量 并检验性质。
并检验性质。 并检验性质
并检验性质
操作及现象:点燃酒精灯,试管ⅰ中有白雾生成,铜丝表面产生气泡;试管ⅱ中溶液红色褪去,试管ⅲ中溶液变红,一段时间后,将铜丝抽离硫酸并停止加热。
(1)ⅰ中发生反应的化学方程式为_______ 。
(2)ⅱ中现象说明 具有
具有_______ 作用。
(3)若将试管ⅲ与试管ⅱ位置互换,石蕊溶液变为红色能否作为 是酸性氧化物的证据?说明理由:
是酸性氧化物的证据?说明理由:_______ 。
Ⅱ.制备 并检验性质
并检验性质
(4)ⅳ中反应的离子方程式为_______ 。
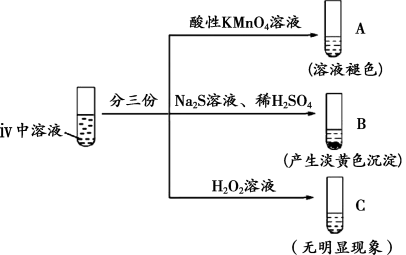
(5)进行实验: 具有
具有_______ 性。
②B中产生淡黄色沉淀的离子方程式为_______ 。
③C中无明显现象,甲同学通过检测 的生成证明
的生成证明 和
和 发生反应:取1
发生反应:取1 C中溶液于试管中,
C中溶液于试管中,_______ (填试剂和操作),产生白色沉淀。
乙同学认为甲同学的实验没有排除 的影响,设计对比实验:
的影响,设计对比实验:_______ 。
综合甲、乙同学的实验可知, 能将
能将 氧化。
氧化。
 制备少量
制备少量 并检验性质。
并检验性质。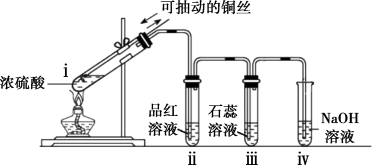
 并检验性质
并检验性质操作及现象:点燃酒精灯,试管ⅰ中有白雾生成,铜丝表面产生气泡;试管ⅱ中溶液红色褪去,试管ⅲ中溶液变红,一段时间后,将铜丝抽离硫酸并停止加热。
(1)ⅰ中发生反应的化学方程式为
(2)ⅱ中现象说明
 具有
具有(3)若将试管ⅲ与试管ⅱ位置互换,石蕊溶液变为红色能否作为
 是酸性氧化物的证据?说明理由:
是酸性氧化物的证据?说明理由:Ⅱ.制备
 并检验性质
并检验性质(4)ⅳ中反应的离子方程式为
(5)进行实验:
 具有
具有②B中产生淡黄色沉淀的离子方程式为
③C中无明显现象,甲同学通过检测
 的生成证明
的生成证明 和
和 发生反应:取1
发生反应:取1 C中溶液于试管中,
C中溶液于试管中,乙同学认为甲同学的实验没有排除
 的影响,设计对比实验:
的影响,设计对比实验:综合甲、乙同学的实验可知,
 能将
能将 氧化。
氧化。
您最近半年使用:0次
2022-07-10更新
|
691次组卷
|
3卷引用:北京朝阳区2021-2022学年高一下学期期末考试化学试题
8 . 铂钌催化剂是甲醇燃料电池的阳极催化剂。一种以钌矿石[主要含Ru(CO3)2,还含少量的FeO、MgO、RuO4、CaO、SiO2]为原料制备钌(Ru)的流程如图。回答下列问题:
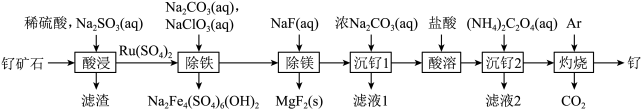
(1)Na2Fe4(SO4)6(OH)2中Fe的化合价为____ 。
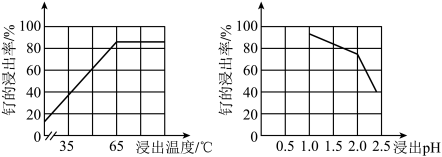
(2)“酸浸”时,Na2SO3的作用____ 。“滤渣”的主要成分有SiO2和____ (填化学式)。“酸浸”中钌的浸出率与浸出温度、pH的关系如图所示,“酸浸”的最佳条件是____ 。
(3)“除铁”的离子方程式为____ 。(提示:1molNaClO3参与反应,转移6mol电子)
(4)从“滤液2”中可提取一种化肥,其电子式为____ 。
(5)“灼烧”时Ar的作用是____ 。
(6)某工厂用10t钌矿石[含8.84tRu(CO3)2、165kgRuO4],最终制得3636kgRu,则Ru的产率为____ 。(保留三位有效数字)

(1)Na2Fe4(SO4)6(OH)2中Fe的化合价为
(2)“酸浸”时,Na2SO3的作用

(3)“除铁”的离子方程式为
(4)从“滤液2”中可提取一种化肥,其电子式为
(5)“灼烧”时Ar的作用是
(6)某工厂用10t钌矿石[含8.84tRu(CO3)2、165kgRuO4],最终制得3636kgRu,则Ru的产率为
您最近半年使用:0次
2022-05-10更新
|
1834次组卷
|
15卷引用:河南省新乡市2022届高三第三次模拟理科综合化学试题
河南省新乡市2022届高三第三次模拟理科综合化学试题河北省保定市2022届高三第二次模拟考试化学试题河南省名校联盟2022届高三下学期5月大联考理科综合化学试题(已下线)专题15工艺流程题-2022年高考真题+模拟题汇编(全国卷)(已下线)专题16工艺流程题-三年(2020~2022)高考真题汇编(全国卷)(已下线)专题16工艺流程题-五年(2018~2022)高考真题汇编(全国卷)(已下线)专题15 工艺流程题-2022年高考真题模拟题分项汇编广东省广州市海珠外国语实验中学2022-2023学年高三上学期第二次阶段性考试化学试题福建省福州第一中学2022-2023学年高三上学期检考前适应性考试化学试题湖南省株洲市北附高级中学2022-2023学年高三上学期第五次月考化学试题(已下线)专题29 无机化工流程综合分析-2023年高考化学毕业班二轮热点题型归纳与变式演练(新高考专用)(已下线)考前特训 [综合大题分类规范练](已下线)专题01 工艺流程专题-【大题精做】冲刺2023年高考化学大题突破+限时集训(新高考专用)山东新高考2022-2023学年高一上学期质量测评模拟演练化学试题 四川省泸州市泸县第一中学2023-2024学年高一上学期1月期末化学试题
解题方法
9 . CuCl为白色固体,难溶于水和乙醇,潮湿时易被氧化,常用于媒染剂。以废铜渣(主要成分为Cu,含少量Ni、Al2O3等)为原料制备CuCl的工艺流程如下:
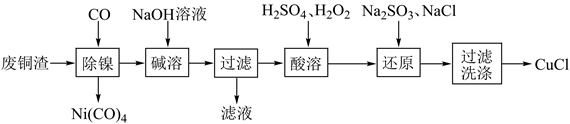
下列说法错误的是

下列说法错误的是
| A.“碱溶”时发生了Al2O3和NaOH的反应 |
| B.“洗涤”时使用乙醇防止CuCl被氧化 |
C.“还原”反应所得的溶液中大量存在Cu2+、H+、 、 、 |
D.酸溶的离子反应方程式为: |
您最近半年使用:0次
名校
解题方法
10 . 某小组同学对 与
与 在不同的
在不同的 下反应进行探究。
下反应进行探究。
(1)测得 溶液
溶液 为10,
为10, 溶液
溶液 为5,用离子方程式表示
为5,用离子方程式表示 溶液显碱性的原因
溶液显碱性的原因___________ 。
(2)调节 与
与 混合后的初始
混合后的初始 ,实验记录如下:
,实验记录如下:
资料:ⅰ. :白色,不溶于水,可溶于过量
:白色,不溶于水,可溶于过量 溶液。
溶液。
ⅱ. :棕黑色,不溶于水,能和酸反应。
:棕黑色,不溶于水,能和酸反应。
针对实验 中白色沉淀提出两种推测:
中白色沉淀提出两种推测:
推测1:白色沉淀为 。
。
推测2:白色沉淀为 。
。
①推测1产生该沉淀的反应用离子方程式表示___________ 。
②推测2的理论依据是___________ 。
③取 、
、 中白色沉淀,分别置于过量
中白色沉淀,分别置于过量 溶液中,沉淀均溶解经实验证明白色沉淀不是
溶液中,沉淀均溶解经实验证明白色沉淀不是 ,实验过程:另取
,实验过程:另取 固体置于
固体置于___________ 溶液中,未溶解。
(3)为确认 组成,将
组成,将 中
中 过滤、洗涤,继续实验:
过滤、洗涤,继续实验:
Ⅰ.向 中滴加稀盐酸,无明显变化;
中滴加稀盐酸,无明显变化;
Ⅱ.向 中加入过量浓
中加入过量浓 ,产生红棕色气体;
,产生红棕色气体;
Ⅲ.用 、
、 检验Ⅱ中反应后的溶液,前者无变化,后者产生白色沉淀。
检验Ⅱ中反应后的溶液,前者无变化,后者产生白色沉淀。
①Ⅰ的目的是___________ 。
②根据Ⅲ的现象,可判断 的元素组成
的元素组成___________ 。
③Ⅱ中反应的化学方程式是___________ 。
(4)综合以上实验,分析 产生的可能原因:
产生的可能原因:
①甲同学认为随着溶液酸性增强, 中的
中的 氧化性增强。
氧化性增强。
②乙同学认为___________ 。
 与
与 在不同的
在不同的 下反应进行探究。
下反应进行探究。(1)测得
 溶液
溶液 为10,
为10, 溶液
溶液 为5,用离子方程式表示
为5,用离子方程式表示 溶液显碱性的原因
溶液显碱性的原因(2)调节
 与
与 混合后的初始
混合后的初始 ,实验记录如下:
,实验记录如下:| 实验 |  | 现象 |
 | 10 | 产生白色沉淀,稍后沉淀溶解 |
 | 6 | 产生白色沉淀,一段时间后,沉淀未溶解 |
 | 2 | 产生大量白色沉淀,一段时间后,产生海绵状棕黑色物质 |
 :白色,不溶于水,可溶于过量
:白色,不溶于水,可溶于过量 溶液。
溶液。ⅱ.
 :棕黑色,不溶于水,能和酸反应。
:棕黑色,不溶于水,能和酸反应。针对实验
 中白色沉淀提出两种推测:
中白色沉淀提出两种推测:推测1:白色沉淀为
 。
。推测2:白色沉淀为
 。
。①推测1产生该沉淀的反应用离子方程式表示
②推测2的理论依据是
③取
 、
、 中白色沉淀,分别置于过量
中白色沉淀,分别置于过量 溶液中,沉淀均溶解经实验证明白色沉淀不是
溶液中,沉淀均溶解经实验证明白色沉淀不是 ,实验过程:另取
,实验过程:另取 固体置于
固体置于(3)为确认
 组成,将
组成,将 中
中 过滤、洗涤,继续实验:
过滤、洗涤,继续实验:Ⅰ.向
 中滴加稀盐酸,无明显变化;
中滴加稀盐酸,无明显变化;Ⅱ.向
 中加入过量浓
中加入过量浓 ,产生红棕色气体;
,产生红棕色气体;Ⅲ.用
 、
、 检验Ⅱ中反应后的溶液,前者无变化,后者产生白色沉淀。
检验Ⅱ中反应后的溶液,前者无变化,后者产生白色沉淀。①Ⅰ的目的是
②根据Ⅲ的现象,可判断
 的元素组成
的元素组成③Ⅱ中反应的化学方程式是
(4)综合以上实验,分析
 产生的可能原因:
产生的可能原因:①甲同学认为随着溶液酸性增强,
 中的
中的 氧化性增强。
氧化性增强。②乙同学认为
您最近半年使用:0次
2021-10-19更新
|
683次组卷
|
2卷引用:北京市北京中国人民大学附属中学2022届高三10月检测化学试卷



