名校
解题方法
1 . 根据下列实验操作和现象所得到的结论正确的是
| 选项 | 实验操作和现象 | 结论 |
| A | 将一块用砂纸打磨过的铝条放入试管,再加入98%浓硫酸3mL,铝条表面无明显现象 | 铝与浓硫酸常温下不反应 |
| B | 向试管中加入3mL稀KMnO4酸性溶液,再通入SO2气体,紫红色褪去 | SO2具有漂白性 |
| C | 室温下,向FeCl3溶液中滴加少量KI溶液,再滴加几滴淀粉溶液,溶液变蓝色 | Fe3+的氧化性比I2的强 |
| D | 将溶液X与稀盐酸反应产生的气体通入品红溶液中,品红溶液褪色 | 溶液X中一定含有SO |
| A.A | B.B | C.C | D.D |
您最近半年使用:0次
2021-03-16更新
|
1375次组卷
|
6卷引用:河北省保定市2020-2021学年高一上学期期末考试化学试题
2 . 硫代硫酸钠(Na2S2O3)是常用的分析试剂,也可用作纸浆漂白时的脱氯剂,可由Na2S、Na2SO3为原料制得。实验小组将制取Na2S2O3所用的Na2S进行提纯,然后制取Na2S2O3并对其含量进行了测定。
(1)工业生产Na2S的方法之一是将炭在高温下与Na2SO4反应,所得Na2S固体中含有炭、Na2SO4、Na2SO3、Na2CO3等杂质。实验室所用Na2S可由工业产品净化得到。
①请设计提纯工业Na2S,制取Na2S·9H2O晶体的实验方案:___________ 。(实验中需使用的试剂有BaS溶液,Na2S的溶解度随温度变化曲线、不同温度区间内析出晶体的类型如图1所示)
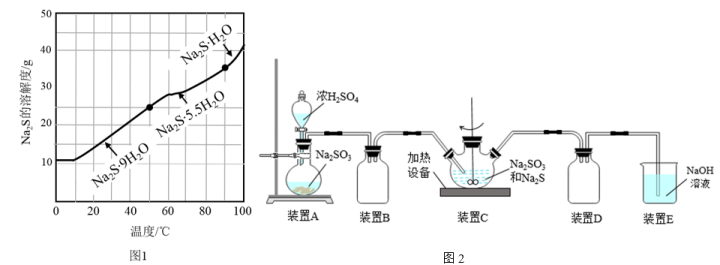
②设计检验工业Na2S产品是否存在Na2SO3的实验方案:___________ 。
(2)实验小组用如图2所示的装置制取Na2S2O3溶液:
①装置C中的反应分为两步,第二步反应为S+Na2SO3=Na2S2O3,则第一反应的化学方程式为___________ 。
②判断装置C中反应已经完全的方法是___________ 。
(3)将装置C反应后的溶液进行结晶,得到Na2S2O3·5H2O晶体样品。用K2Cr2O7标准溶液测定样品的纯度,步骤如下:称取1.5000 g样品,用蒸馏水溶解,配成100 mL溶液。取0.0100 mol·L-1的K2Cr2O7标准溶液20.00 mL,用硫酸酸化后加入过量KI,然后用样品溶液滴定至淡黄绿色,加入淀粉溶液作指示剂,继续滴定,恰好完全反应时消耗样品溶液的体积为20.00 mL。
实验过程中发生的反应为:Cr2O +6I-+14H+=2Cr3++3I2+7H2O I2+2S2O
+6I-+14H+=2Cr3++3I2+7H2O I2+2S2O =S4O
=S4O +2I-
+2I-
①计算样品的纯度。(写出计算过程)___________
②若样品杂质中含有Na2SO3,则所测样品的纯度___________ (填“偏高”、“偏低”或“无影响”)。
(1)工业生产Na2S的方法之一是将炭在高温下与Na2SO4反应,所得Na2S固体中含有炭、Na2SO4、Na2SO3、Na2CO3等杂质。实验室所用Na2S可由工业产品净化得到。
①请设计提纯工业Na2S,制取Na2S·9H2O晶体的实验方案:

②设计检验工业Na2S产品是否存在Na2SO3的实验方案:
(2)实验小组用如图2所示的装置制取Na2S2O3溶液:
①装置C中的反应分为两步,第二步反应为S+Na2SO3=Na2S2O3,则第一反应的化学方程式为
②判断装置C中反应已经完全的方法是
(3)将装置C反应后的溶液进行结晶,得到Na2S2O3·5H2O晶体样品。用K2Cr2O7标准溶液测定样品的纯度,步骤如下:称取1.5000 g样品,用蒸馏水溶解,配成100 mL溶液。取0.0100 mol·L-1的K2Cr2O7标准溶液20.00 mL,用硫酸酸化后加入过量KI,然后用样品溶液滴定至淡黄绿色,加入淀粉溶液作指示剂,继续滴定,恰好完全反应时消耗样品溶液的体积为20.00 mL。
实验过程中发生的反应为:Cr2O
 +6I-+14H+=2Cr3++3I2+7H2O I2+2S2O
+6I-+14H+=2Cr3++3I2+7H2O I2+2S2O =S4O
=S4O +2I-
+2I-①计算样品的纯度。(写出计算过程)
②若样品杂质中含有Na2SO3,则所测样品的纯度
您最近半年使用:0次
名校
解题方法
3 . 下列实验操作和现象、结论或目的均正确的是
| 选项 | 操作和现象 | 结论或目的 |
| A | 向某溶液中滴加盐酸,再加Ba(NO3)2溶液,有白色沉淀生成 | 原溶液中一定含有SO |
| B | CO还原Fe2O3得到的黑色固体加入盐酸溶解后再加入KSCN溶液,溶液不显红色 | 黑色固体中可能含有Fe3O4 |
| C | 用托盘天平称取1.0g NaOH固体,在烧杯中加少量蒸馏水溶解,转移至250mL容量瓶中定容 | 配制250mL 0.1nol/L的NaOH溶液 |
| D | 用 pH 试纸分别测定等浓度的 NaClO 和NaHCO3溶液的 pH,pH:NaClO> NaHCO3 | 碱性:NaClO> NaHCO3 |
| A.A | B.B | C.C | D.D |
您最近半年使用:0次
解题方法
4 . CuCl是重要的化工原料,研究人员提出用有机硅生产中产生的废触煤(生产中未反应的硅粉和催化剂混合物,主要成分为粉末状的硅、铜、锌和碳)来生产CuCl,并设计出如下图所示流程图。
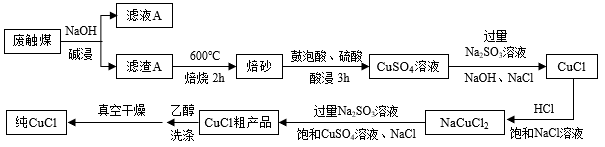
已知:氯化亚铜微溶于水,不溶于乙醇,溶于浓盐酸和氨水生成络合物。
(1)已知锌与铝性质相似,既能与强酸反应又能与强碱反应。写出碱浸时锌与NaOH反应的离子方程式___________ 。
(2)实验室模拟焙烧的过程,除三脚架外,还需要用到的实验仪器是___________ 。(从下列仪器中选出所需的仪器,填字母)
A.蒸发皿 B.坩埚 C.表面皿 D.泥三角 E酒精灯 F.干燥器 G.坩埚钳
(3)焙砂的主要成分是___________ ,写出提高焙砂浸取率和速率的两种方法___________ ,___________ 。
(4)写出由NaCuCl2生成CuCl的离子方程式___________ ,NaCl的作用是___________ ,用乙醇洗涤CuCl晶体的优点是___________ 。
(5)准确称取氯化亚铜产品10.00 g,将其置于过量的FeCl3溶液中,待样品完全溶解后加入适量稀硫酸和水配成1000 mL溶液,取50 mL用0.0500 mol·L-1的K2Cr2O7溶液滴定到终点,消耗K2Cr2O7溶液16.67 mL,反应中 被还原为Cr3+,产品中CuCl的质量分数为
被还原为Cr3+,产品中CuCl的质量分数为___________ 。

已知:氯化亚铜微溶于水,不溶于乙醇,溶于浓盐酸和氨水生成络合物。
(1)已知锌与铝性质相似,既能与强酸反应又能与强碱反应。写出碱浸时锌与NaOH反应的离子方程式
(2)实验室模拟焙烧的过程,除三脚架外,还需要用到的实验仪器是
A.蒸发皿 B.坩埚 C.表面皿 D.泥三角 E酒精灯 F.干燥器 G.坩埚钳
(3)焙砂的主要成分是
(4)写出由NaCuCl2生成CuCl的离子方程式
(5)准确称取氯化亚铜产品10.00 g,将其置于过量的FeCl3溶液中,待样品完全溶解后加入适量稀硫酸和水配成1000 mL溶液,取50 mL用0.0500 mol·L-1的K2Cr2O7溶液滴定到终点,消耗K2Cr2O7溶液16.67 mL,反应中
 被还原为Cr3+,产品中CuCl的质量分数为
被还原为Cr3+,产品中CuCl的质量分数为
您最近半年使用:0次
名校
解题方法
5 . 有一包白色固体(为一种二元酸的正盐),下表为进行相关实验的部分实验报告。
(1)请根据实验现象,将你作出的判断填在表格内的相应位置。
(2)若想确认此白色固体的成分,应在步骤________ (填步骤序号)中加入试剂A,试剂A为_________ 。
(3)若在步骤②的操作中,加入试剂A后仍有白色沉淀,写出据此确认的溶液X与氢氧化钡溶液加热反应的离子方程式___________________________
(1)请根据实验现象,将你作出的判断填在表格内的相应位置。
| 步骤序号 | 操作 | 实验现象 | 判断 |
| ① | 取固体溶于水,得溶液X | 得到无色溶液 | |
| ② | 取少量溶液X,加入氯化钡溶液 | 生成白色沉淀 | 可能含有 |
| ③ | 取少量溶液X,加入浓氢氧化钠溶液,加热,并在试管口用湿润的红色石蕊试纸检验 | 试纸变蓝 | 含有 |
| 结论:此白色固体可能是 | |||
(3)若在步骤②的操作中,加入试剂A后仍有白色沉淀,写出据此确认的溶液X与氢氧化钡溶液加热反应的离子方程式
您最近半年使用:0次
2020-10-28更新
|
80次组卷
|
2卷引用:安徽省六安市城南中学2021届高三上学期第一次月考化学试题
名校
解题方法
6 . 焦亚硫酸钠(Na2S2O5)是常用的食品抗氧化剂之一。某研究小组进行如下实验:
实验一 焦亚硫酸钠的制取
采用如图装置(实验前已除尽装置内的空气)制取Na2S2O5,装置Ⅲ中有Na2S2O5黄色晶体析出,发生的反应为:Na2SO3+SO2=Na2S2O5。

(1)装置Ⅰ中盛放浓硫酸的仪器名称为_____ ;装置Ⅰ中产生气体的化学方程式为______ 。
(2)装置Ⅱ的作用之一是观察SO2的生成速率,盛装的试剂为_____ 。
(3)要从装置Ⅲ中获得已析出的晶体,可采取的分离方法是_____ 。
实验二 焦亚硫酸钠的性质:Na2S2O5溶于水即生成NaHSO3
(4)证明NaHSO3溶液中 的电离程度大于水解程度,可采用的实验方法是
的电离程度大于水解程度,可采用的实验方法是_____ (填序号)。
a.测定溶液的pH b.加入Ba(OH)2溶液 c.加入盐酸 d.加入品红溶液 e.用蓝色石蕊试纸检测
(5)检验Na2S2O5晶体在空气中已被氧化的实验方案是_______ 。
实验三 葡萄酒中抗氧化剂残留量的测定
(6)葡萄酒常用Na2S2O5作抗氧化剂。测定某葡萄酒中抗氧化剂的残留量(以游离SO2计算)的方案如下:

(已知:滴定时化学方程式为:SO2+I2+2H2O=H2SO4+2HI)
①按上述方案实验,消耗标准I2溶液25.00 mL,该次实验测得样品中抗氧化剂的残留量(以游离SO2计算)为_______ g·L-1。
②在上述实验过程中,若有部分HI被空气氧化,则测得结果______ (填“偏高”“偏低”或“不变”)。
实验一 焦亚硫酸钠的制取
采用如图装置(实验前已除尽装置内的空气)制取Na2S2O5,装置Ⅲ中有Na2S2O5黄色晶体析出,发生的反应为:Na2SO3+SO2=Na2S2O5。

(1)装置Ⅰ中盛放浓硫酸的仪器名称为
(2)装置Ⅱ的作用之一是观察SO2的生成速率,盛装的试剂为
(3)要从装置Ⅲ中获得已析出的晶体,可采取的分离方法是
实验二 焦亚硫酸钠的性质:Na2S2O5溶于水即生成NaHSO3
(4)证明NaHSO3溶液中
 的电离程度大于水解程度,可采用的实验方法是
的电离程度大于水解程度,可采用的实验方法是a.测定溶液的pH b.加入Ba(OH)2溶液 c.加入盐酸 d.加入品红溶液 e.用蓝色石蕊试纸检测
(5)检验Na2S2O5晶体在空气中已被氧化的实验方案是
实验三 葡萄酒中抗氧化剂残留量的测定
(6)葡萄酒常用Na2S2O5作抗氧化剂。测定某葡萄酒中抗氧化剂的残留量(以游离SO2计算)的方案如下:

(已知:滴定时化学方程式为:SO2+I2+2H2O=H2SO4+2HI)
①按上述方案实验,消耗标准I2溶液25.00 mL,该次实验测得样品中抗氧化剂的残留量(以游离SO2计算)为
②在上述实验过程中,若有部分HI被空气氧化,则测得结果
您最近半年使用:0次
2020-09-21更新
|
457次组卷
|
2卷引用:广东省广州大学附属中学等三校2021届高三上学期返校联考化学试题
7 . 铜及其化合物在生产生活中有广泛应用
(1)工业上以黄铜矿(CuFeS2) 为原料,采用火法熔炼工艺生产铜的中间过程会发生反应:2Cu2O+Cu2S 6Cu+SO2↑ 该反应的氧化剂是
6Cu+SO2↑ 该反应的氧化剂是________________ ,验证SO2的方法是________________ 。
(2)将少量铜丝放入适量的稀硫酸中,温度控制在50℃,加入H2O2,反应一段时间后,升温到60℃,再反应一段时间后可制得硫酸铜。温度控制在50℃~60℃的原因有:①加快反应速率;②___________ 。在CuSO4溶液中加入一定量的Na2SO3和NaCl溶液加热,可生成CuC1沉淀,写出生成CuCl的离子方程式______________ 。
(3)碱式碳酸铜在有机催化剂、烟火制造和颜料、农药生产中有广泛的应用。某工厂以辉铜矿(主要成分为Cu2S,含少量Fe2O3、SiO2等杂质)为原料制备碱式碳酸铜的流程如下:
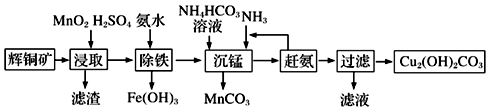
①辉铜矿在浸取前要富集与粉碎,粉碎的好处是___________ 。
②浸取过程中可得到一种黄色单质,写出浸取时主要反应的化学方程式___________ 。
③“除铁”这一步反应在25℃进行,加入氨水调节溶液pH为4后,溶液中铜离子最大浓度不超过_________ mol/L。(已知Ksp[Cu(OH)2]=2.2×10-20)
(1)工业上以黄铜矿(CuFeS2) 为原料,采用火法熔炼工艺生产铜的中间过程会发生反应:2Cu2O+Cu2S
 6Cu+SO2↑ 该反应的氧化剂是
6Cu+SO2↑ 该反应的氧化剂是(2)将少量铜丝放入适量的稀硫酸中,温度控制在50℃,加入H2O2,反应一段时间后,升温到60℃,再反应一段时间后可制得硫酸铜。温度控制在50℃~60℃的原因有:①加快反应速率;②
(3)碱式碳酸铜在有机催化剂、烟火制造和颜料、农药生产中有广泛的应用。某工厂以辉铜矿(主要成分为Cu2S,含少量Fe2O3、SiO2等杂质)为原料制备碱式碳酸铜的流程如下:

①辉铜矿在浸取前要富集与粉碎,粉碎的好处是
②浸取过程中可得到一种黄色单质,写出浸取时主要反应的化学方程式
③“除铁”这一步反应在25℃进行,加入氨水调节溶液pH为4后,溶液中铜离子最大浓度不超过
您最近半年使用:0次
2018-08-30更新
|
297次组卷
|
2卷引用:【全国省级联考】广东省2017-2018学年高二第二学期期末检测理科综合化学试题



