1 . 实验室以浓硫酸、铜与NaOH溶液为原料制取少量NaHSO3并探究其性质,已知CuCl为白色难溶于水的化合物。
I.制备NaHSO3(装置如图所示)。

(1)仪器a的名称是____ 。
(2)装置丙的作用是____ 。
II.探究:NaHSO3与Cu2+的反应,设计实验:向2mL1mol·L-1NaHSO3溶液中加入2mL1mol·L-1CuSO4溶液,得到绿色溶液,3min内无明显变化。将所得混合液分为两等份。
①第一份加入适量Na2SO4固体,瞬间无明显变化,30s时也无明显变化。
②另一份加入适量NaCl固体,瞬间无明显变化,30s时有无色气体和白色沉淀生成,上层溶液颜色变浅。
(3)推测实验②产生的无色气体为SO2,用新制的氯水检验该无色气体,可观察到淡黄绿色消失,滴加BaCl2溶液有白色沉淀生成。写出SO2与氯气反应的离子方程式:____ 。
(4)对实验II产生SO2的原因进行分析,提出两种假设:
假设1:Cu2+水解使溶液中c(H+)增大。
假设2:Cl-存在时,Cu2+与HSO 反应生成CuCl白色沉淀,溶液中c(H+)增大。
反应生成CuCl白色沉淀,溶液中c(H+)增大。
①假设1不合理,实验证据是____ 。
②实验证实假设2合理,实验II中发生反应的离子方程式有____ 和H++HSO =SO2↑+H2O。
=SO2↑+H2O。
III.与碘酸盐的反应:向用H2SO4酸化的KIO3溶液中滴加NaHSO3溶液(以及少量淀粉溶液)。实验现象为“无色→蓝色→无色→蓝色→……”的周期性变化,此反应过程分为三步:①IO +3HSO
+3HSO =3SO
=3SO +3H++I-(慢);②IO
+3H++I-(慢);②IO +5I-+6H+=3I2+3H2O(慢);③I2+HSO
+5I-+6H+=3I2+3H2O(慢);③I2+HSO +H2O=2I-+SO
+H2O=2I-+SO +3H+(快)。
+3H+(快)。
(5)请解释出现该实验现象可能的原因:____ 。
IV.NaHSO3固体的纯度测定:称取wgNaHSO3固体溶于水配成100mL溶液,取25.00mL已配好的溶液置于锥形瓶中,用0.1000mol·L-1的酸性KMnO4溶液进行滴定,消耗KMnO4溶液VmL。(已知:2MnO +5HSO
+5HSO +H+=2Mn2++5SO
+H+=2Mn2++5SO +3H2O)
+3H2O)
(6)滴定终点的颜色变化为____ ,NaHSO3固体的纯度为____ (用含V和w的代数式表示)。
I.制备NaHSO3(装置如图所示)。

(1)仪器a的名称是
(2)装置丙的作用是
II.探究:NaHSO3与Cu2+的反应,设计实验:向2mL1mol·L-1NaHSO3溶液中加入2mL1mol·L-1CuSO4溶液,得到绿色溶液,3min内无明显变化。将所得混合液分为两等份。
①第一份加入适量Na2SO4固体,瞬间无明显变化,30s时也无明显变化。
②另一份加入适量NaCl固体,瞬间无明显变化,30s时有无色气体和白色沉淀生成,上层溶液颜色变浅。
(3)推测实验②产生的无色气体为SO2,用新制的氯水检验该无色气体,可观察到淡黄绿色消失,滴加BaCl2溶液有白色沉淀生成。写出SO2与氯气反应的离子方程式:
(4)对实验II产生SO2的原因进行分析,提出两种假设:
假设1:Cu2+水解使溶液中c(H+)增大。
假设2:Cl-存在时,Cu2+与HSO
 反应生成CuCl白色沉淀,溶液中c(H+)增大。
反应生成CuCl白色沉淀,溶液中c(H+)增大。①假设1不合理,实验证据是
②实验证实假设2合理,实验II中发生反应的离子方程式有
 =SO2↑+H2O。
=SO2↑+H2O。III.与碘酸盐的反应:向用H2SO4酸化的KIO3溶液中滴加NaHSO3溶液(以及少量淀粉溶液)。实验现象为“无色→蓝色→无色→蓝色→……”的周期性变化,此反应过程分为三步:①IO
 +3HSO
+3HSO =3SO
=3SO +3H++I-(慢);②IO
+3H++I-(慢);②IO +5I-+6H+=3I2+3H2O(慢);③I2+HSO
+5I-+6H+=3I2+3H2O(慢);③I2+HSO +H2O=2I-+SO
+H2O=2I-+SO +3H+(快)。
+3H+(快)。(5)请解释出现该实验现象可能的原因:
IV.NaHSO3固体的纯度测定:称取wgNaHSO3固体溶于水配成100mL溶液,取25.00mL已配好的溶液置于锥形瓶中,用0.1000mol·L-1的酸性KMnO4溶液进行滴定,消耗KMnO4溶液VmL。(已知:2MnO
 +5HSO
+5HSO +H+=2Mn2++5SO
+H+=2Mn2++5SO +3H2O)
+3H2O)(6)滴定终点的颜色变化为
您最近一年使用:0次
名校
2 . 某研究小组同学为探究锌与硫酸反应生成 SO2、H2的临界浓度(浓硫酸能与锌反应生成 SO2的最低浓度)设计了如图实验 (加热和夹持装置已省略)。
已知:锌与浓硫酸开始时反应缓慢,可以适当加热以加速其反应,当有大量气泡生成时,该反应速率会明显加快并伴有大量的热放出。
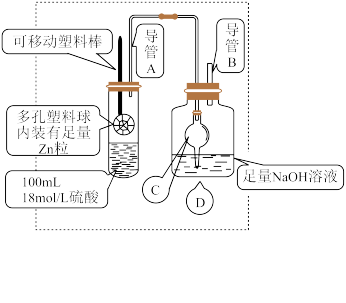
(1)请写出锌与硫酸反应产生 SO2的化学方程式_______ 。
(2)在组装仪器之后,加入试剂之前必须进行的操作是_______ 。
(3)装置中干燥管C的作用是_______ 。
(4)移动塑料棒,使锌浸没到硫酸中充分反应,反应结束后向D 装置中加入足量的 H2O2溶液,再加入足量的BaCl2溶液,充分反应后将所得沉淀过滤、洗涤、干燥、称量得到固体质量为a克。
①加入 H2O2溶液发生反应的离子方程式是_______ 。
②浓硫酸与锌反应的临界浓度为:_______ mol/L。(用含a的计算式表示,忽略溶液体积变化)
(5)导管A竖直部分较长,其作用是_______ 。
(6)另甲同学提出测定方案:将D中的溶液酸化后,利用标准酸性KMnO4溶液测定原溶液中的SO ,从而计算临界浓度。乙同学认为相对于(4)中的测定方法,此方案会使测定结果偏高,你认为乙同学的理由是
,从而计算临界浓度。乙同学认为相对于(4)中的测定方法,此方案会使测定结果偏高,你认为乙同学的理由是_______ 。
已知:锌与浓硫酸开始时反应缓慢,可以适当加热以加速其反应,当有大量气泡生成时,该反应速率会明显加快并伴有大量的热放出。

(1)请写出锌与硫酸反应产生 SO2的化学方程式
(2)在组装仪器之后,加入试剂之前必须进行的操作是
(3)装置中干燥管C的作用是
(4)移动塑料棒,使锌浸没到硫酸中充分反应,反应结束后向D 装置中加入足量的 H2O2溶液,再加入足量的BaCl2溶液,充分反应后将所得沉淀过滤、洗涤、干燥、称量得到固体质量为a克。
①加入 H2O2溶液发生反应的离子方程式是
②浓硫酸与锌反应的临界浓度为:
(5)导管A竖直部分较长,其作用是
(6)另甲同学提出测定方案:将D中的溶液酸化后,利用标准酸性KMnO4溶液测定原溶液中的SO
 ,从而计算临界浓度。乙同学认为相对于(4)中的测定方法,此方案会使测定结果偏高,你认为乙同学的理由是
,从而计算临界浓度。乙同学认为相对于(4)中的测定方法,此方案会使测定结果偏高,你认为乙同学的理由是
您最近一年使用:0次
3 . 为了测定实验室长期存放的Na2SO3固体的纯度,准确称取W g固体样品,配成250 mL溶液。设计了以下两种实验方案:
方案Ⅰ:取25.00 mL上述溶液,加入足量的用过量盐酸酸化的BaCl2溶液,过滤、洗涤和干燥沉淀,称得沉淀的质量为m1 g。
方案Ⅱ:取25.00 mL上述溶液,加入过量的盐酸酸化的Ba(NO3)2溶液,过滤、洗涤和干燥沉淀,称重,其质量为m2 g。
(1)配制250 mL Na2SO3溶液时,必须用到的实验仪器有:烧杯、玻璃棒、胶头滴管、药匙、________________ 、________ 。
(2)写出Na2SO3固体氧化变质的化学方程式_____________ 。
(3)方案Ⅰ加入过量的盐酸酸化的BaCl2溶液,目的是__________________________ ,
在过滤前,需要检验是否沉淀完全,其操作是______________ 。
(4)方案Ⅰ中,若滤液浑浊,将导致测定结果________ (填“偏高”或“偏低”)。
(5)若操作正确,则m1________ m2(填“>”、“<”或“=”),原因是_______________ 。
(6)取25.00 mL上述溶液,用酸性KMnO4溶液滴定的方法测定Na2SO3的纯度。已知酸性条件下,KMnO4通常被还原为Mn2+,则Na2SO3固体的纯度可表示为_____________ (注明表达式中所用的有关符号的含义和单位)。
方案Ⅰ:取25.00 mL上述溶液,加入足量的用过量盐酸酸化的BaCl2溶液,过滤、洗涤和干燥沉淀,称得沉淀的质量为m1 g。
方案Ⅱ:取25.00 mL上述溶液,加入过量的盐酸酸化的Ba(NO3)2溶液,过滤、洗涤和干燥沉淀,称重,其质量为m2 g。
(1)配制250 mL Na2SO3溶液时,必须用到的实验仪器有:烧杯、玻璃棒、胶头滴管、药匙、
(2)写出Na2SO3固体氧化变质的化学方程式
(3)方案Ⅰ加入过量的盐酸酸化的BaCl2溶液,目的是
在过滤前,需要检验是否沉淀完全,其操作是
(4)方案Ⅰ中,若滤液浑浊,将导致测定结果
(5)若操作正确,则m1
(6)取25.00 mL上述溶液,用酸性KMnO4溶液滴定的方法测定Na2SO3的纯度。已知酸性条件下,KMnO4通常被还原为Mn2+,则Na2SO3固体的纯度可表示为
您最近一年使用:0次
2017-06-26更新
|
263次组卷
|
3卷引用:苏教版2017届高三单元精练检测一化学试题
名校
解题方法
4 . 下列实验中,对应的现象以及结论都正确且两者具有因果关系的是
| 选项 | 实验 | 现象 | 结论 |
| A | 将过量铁粉加入稀硝酸中,充分反应后滴加KSCN溶液 | 有气体生成,溶液呈血红色 | 稀硝酸将Fe氧化为Fe3+ |
| B | 将铜粉加入1.0mol/LFe2(SO4)3溶液中 | 溶液由黄色变为蓝绿(青)色 | 金属铁比铜活泼 |
| C | 向久置的FeCl2溶液中加入酸性KMnO4溶液 | KMnO4溶液紫色褪去 | FeCl2溶液没有完全被氧化 |
| D | 将少量Na2SO3样品溶于足量稀盐酸中,静置,取上层溶液于试管中,滴加BaCl2溶液 | 产生白色沉淀 | 该Na2SO3样品已经变质 |
| A.A | B.B | C.C | D.D |
您最近一年使用:0次
2021-06-19更新
|
361次组卷
|
4卷引用:考点15 铁及其化合物-备战2022年高考化学一轮复习考点帮(全国通用)
(已下线)考点15 铁及其化合物-备战2022年高考化学一轮复习考点帮(全国通用)(已下线)考点15 铁及其化合物-备战2022年高考化学一轮复习考点帮(浙江专用)黑龙江省哈尔滨市第九中学2020-2021学年高二下学期6月月考化学试题湖南省衡阳师范学院祁东附属中学2021-2022学年高三上学期12月月考化学试题



