解题方法
1 . 铁及其化合物在生产、生活中有着重要作用。按要求回答下列问题。
(1)基态Fe原子的价层电子排布式为___________ ;铁元素在元素周期表中的位置是___________ ,属于___________ 区。
(2)铁及其化合物A~E的分类分布及其转化关系如下图所示:
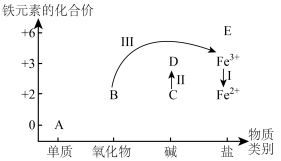
①从图中(A~E)选择反应物,实现Ⅰ的转化,写出反应Ⅰ的离子方程式:___________ 。
②预测物质E中铁元素具有___________ (填“氧化性”或“还原性”)。
③写出反应Ⅱ的化学方程式:___________ 。
④实现反应Ⅲ的转化,可选择含N元素的试剂为___________ 。
(3)探究铁盐X的组成与性质(忽略过程中氧气的参与)
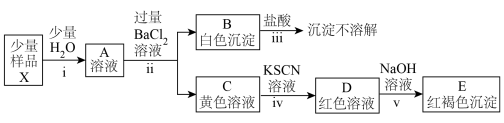
①由步骤ⅰ及其现象可推知铁盐X的物理性质:___________ 。
②由步骤ⅱ、ⅲ及其现象可推知该铁盐X中含有的阴离子为___________ 。
③C溶液呈黄色,不可能是因其体系中含有的___________ 、___________ 、___________ 、___________ (填离子符号)所致;
而可能是因其体系中含有的___________ 、___________ (填粒子的化学式)等所致。
④由步骤iv、v及其现象,体系中与 结合能力最强的离子是
结合能力最强的离子是___________ 。
(1)基态Fe原子的价层电子排布式为
(2)铁及其化合物A~E的分类分布及其转化关系如下图所示:

①从图中(A~E)选择反应物,实现Ⅰ的转化,写出反应Ⅰ的离子方程式:
②预测物质E中铁元素具有
③写出反应Ⅱ的化学方程式:
④实现反应Ⅲ的转化,可选择含N元素的试剂为
(3)探究铁盐X的组成与性质(忽略过程中氧气的参与)

①由步骤ⅰ及其现象可推知铁盐X的物理性质:
②由步骤ⅱ、ⅲ及其现象可推知该铁盐X中含有的阴离子为
③C溶液呈黄色,不可能是因其体系中含有的
而可能是因其体系中含有的
④由步骤iv、v及其现象,体系中与
 结合能力最强的离子是
结合能力最强的离子是
您最近一年使用:0次
名校
2 . (1)短周期元素W、X、Y、Z、M原子序数依次增大,元素W的一种核素的中子数为0,X的原子最外层电子数是次外层的2倍,Z与M同主族,Z2-电子层结构与氖原子相同。
①M在元素周期表中的位置是__________________________ 。
②化合物p由W、X、Y、M四种元素组成。已知向p溶液中加入FeCl3溶液,溶液变血红色;向p溶液中加入NaOH溶液并加热可放出使湿润的红色石蕊试纸变蓝的气体。p的化学式为_____________ 。
③(XY)2的性质与Cl2相似,(XY)2与NaOH溶液常温下反应的离子方程式为_____________ 。
(2)A、B、C、W均为中学常见的纯净物,它们之间有如下转化关系(其它产物及反应条件已略去,反应可以在水溶液中进行):
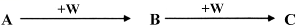
Ⅰ. 若A为有刺激性气味的气体,水溶液呈碱性;C为红棕色气体,与水反应生成一元强酸D,D具有强氧化性。
①在催化剂作用下,A与C反应可生成两种无污染物质,该反应化学方程式为________________
②工业上常用Na2CO3溶液吸收C,生成等物质的量的两种钠盐,该反应的离子方程式为_______________
Ⅱ. A、B、C三种物质的溶液均显碱性,焰色反应均为黄色;C常作面包和糕点的发泡剂,受热分解可生成B。
①实验室需配制0.1mol·L-1 A溶液450mL。根据计算用托盘天平称取A的质量为__________ g,在实验中其它操作均正确,若定容时仰视刻度线,则所得溶液浓度________________ 0.1mol·L-1 (填“大于”“等于”或“小于”)。
②将标准状况下2.24L 的W通入150mL 1mol·L-1的A溶液中,充分反应。总反应的离子方程式为_______________
①M在元素周期表中的位置是
②化合物p由W、X、Y、M四种元素组成。已知向p溶液中加入FeCl3溶液,溶液变血红色;向p溶液中加入NaOH溶液并加热可放出使湿润的红色石蕊试纸变蓝的气体。p的化学式为
③(XY)2的性质与Cl2相似,(XY)2与NaOH溶液常温下反应的离子方程式为
(2)A、B、C、W均为中学常见的纯净物,它们之间有如下转化关系(其它产物及反应条件已略去,反应可以在水溶液中进行):
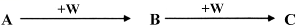
Ⅰ. 若A为有刺激性气味的气体,水溶液呈碱性;C为红棕色气体,与水反应生成一元强酸D,D具有强氧化性。
①在催化剂作用下,A与C反应可生成两种无污染物质,该反应化学方程式为
②工业上常用Na2CO3溶液吸收C,生成等物质的量的两种钠盐,该反应的离子方程式为
Ⅱ. A、B、C三种物质的溶液均显碱性,焰色反应均为黄色;C常作面包和糕点的发泡剂,受热分解可生成B。
①实验室需配制0.1mol·L-1 A溶液450mL。根据计算用托盘天平称取A的质量为
②将标准状况下2.24L 的W通入150mL 1mol·L-1的A溶液中,充分反应。总反应的离子方程式为
您最近一年使用:0次
3 . I.元素X、Y、Z、M、N均为短周期主族元素,且原子序数依次增大。已知Y原子最外层电子数与核外电子总数之比为3:4,M原子的最外层电子数与次外层电子数之比为3 :4,且M原子的质子数是Y原子的2倍;N-、Z+、X+离子半径逐渐减小;化合物XN常温下为气体,请回答下列问题:
(1)写出Y、Z、N按原子个数之比1 :1:1形成的化合物的电子式_______________ 。
(2)写出由X、Y、Z、M、N中某些原子形成的18电子分子和18电子离子发生氧化还原反应的离子方程式:_________________ 。
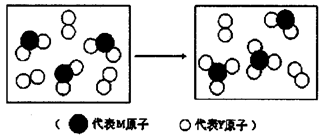
(3)上图表示由上述两种元素组成的气体分子在一定条件下的密闭容器中充分反应前后的转化关系,请写出该转化过程的化学方程式:________________ 。
Ⅱ.A、B、C、D是原子序数均小于20的四种元素。A与B同主族,且能形成BA2、BA3的型分子。B、C、D所形成的简单离子电子层结构相同,且B、C、D离子半径依次减小。请回答下列问题:
(4)D元素在元素周期表中的位置是_____ 。B与D所形成的化合物的化学键类型为______ 。
(5)将C单质的水溶液滴加到B与D所形成化合物的水溶液中,其反应的离子方程式为_________ 。
(1)写出Y、Z、N按原子个数之比1 :1:1形成的化合物的电子式
(2)写出由X、Y、Z、M、N中某些原子形成的18电子分子和18电子离子发生氧化还原反应的离子方程式:

(3)上图表示由上述两种元素组成的气体分子在一定条件下的密闭容器中充分反应前后的转化关系,请写出该转化过程的化学方程式:
Ⅱ.A、B、C、D是原子序数均小于20的四种元素。A与B同主族,且能形成BA2、BA3的型分子。B、C、D所形成的简单离子电子层结构相同,且B、C、D离子半径依次减小。请回答下列问题:
(4)D元素在元素周期表中的位置是
(5)将C单质的水溶液滴加到B与D所形成化合物的水溶液中,其反应的离子方程式为
您最近一年使用:0次
名校
4 . A、B、C、D、E、X均为短周期元素形成的无机物,存在下图所示转化关系(部分生成物和反应条件略去);已知A由短周期非金属元素组成,B具有漂白性且光照易分解。请回答以下问题:
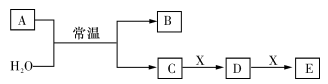
(1)若A 为单质,且C 为一元强酸。
①组成单质A的元素在元素周期表中的位置为__________ 。
②写出一种工业制备单质A方法的离子方程式:__________ 。
③X 可能为________ (填字母代号)。
a.NaOH b. AlCl3 c.Na2CO3 d.NaAlO2
(2)若A 为两种元素形成的化合物,且E 与水反应生成的G的浓溶液遇C 有白烟产生。
①A的电子式为__________ 。
②A 与H2O反应的化学方程式为__________ 。
③G的浓溶液遇C产生白烟的化学方程式为__________ 。

(1)若A 为单质,且C 为一元强酸。
①组成单质A的元素在元素周期表中的位置为
②写出一种工业制备单质A方法的离子方程式:
③X 可能为
a.NaOH b. AlCl3 c.Na2CO3 d.NaAlO2
(2)若A 为两种元素形成的化合物,且E 与水反应生成的G的浓溶液遇C 有白烟产生。
①A的电子式为
②A 与H2O反应的化学方程式为
③G的浓溶液遇C产生白烟的化学方程式为
您最近一年使用:0次
名校
5 . B、D、C、A、E 五种元素的原子序数顺序依次增大,其中只有E为金属元素,D、C 元素在元素周期表中位置相邻,在一定条件下,B 的单质可以分别和A、C、D 的单质化合生成甲、乙、丙化合物,C 的单质和D 的单质化合可得丁,戊、己、庚均为化合物。已知乙、丙每个分子中均含有10 个电子,下图为相互转化关系:
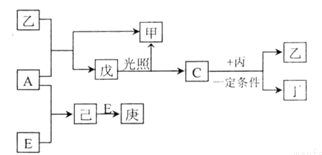
请回答下列问题:
(1)写出E 的原子结构示意图_____________ 。
(2)写出C、D 氢化物的稳定性由强到弱的顺序_________ (用化学式表示)。
(3)A、B、D 三种元素形成的化合物中其中一种可用作化肥,写该化合物的电子式__________ 。
(4)写出C与丙反应的化学反应方程式________________ 。
(5)写出工业上从海水中制取A 的离子反应方程式_______________ 。
(6)工业上通过如下转化可制得含A 元素的钾盐KAO3 晶体:
NaA溶液 NaAO3
NaAO3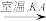 KAO3晶体
KAO3晶体
Ⅰ Ⅱ
①完成Ⅰ中反应的总化学方程式:___________________ 。
NaA+□H2O □NaAO3+□
□NaAO3+□
②Ⅱ中反应过程能析出KClO3晶体而无其他晶体析出的原因是_____________ 。

请回答下列问题:
(1)写出E 的原子结构示意图
(2)写出C、D 氢化物的稳定性由强到弱的顺序
(3)A、B、D 三种元素形成的化合物中其中一种可用作化肥,写该化合物的电子式
(4)写出C与丙反应的化学反应方程式
(5)写出工业上从海水中制取A 的离子反应方程式
(6)工业上通过如下转化可制得含A 元素的钾盐KAO3 晶体:
NaA溶液
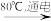 NaAO3
NaAO3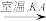 KAO3晶体
KAO3晶体Ⅰ Ⅱ
①完成Ⅰ中反应的总化学方程式:
NaA+□H2O
 □NaAO3+□
□NaAO3+□ ②Ⅱ中反应过程能析出KClO3晶体而无其他晶体析出的原因是
您最近一年使用:0次
2010·北京西城·二模
6 . 化合物A是制玻璃的主要原料之一。常温下,化合物B、H、I为气体,B不溶于水,H、I易溶于水,H的水溶液呈碱性,I的水溶液呈酸性。D元素是地壳中含量仅次于氧的非金属元素。化合物J是一种可用于制造发动机的新型无机非金属材料,其相对分子质量为140,其中D元素的质量分数为60%。上述物质间的转化关系如下图所示。
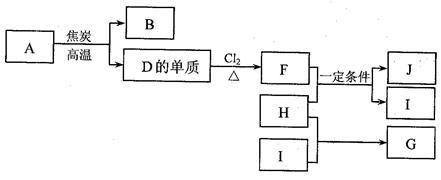
(1)除A外,制玻璃的主要原料还有物质(填化学式)_______ 、_______ 。
盛放NaOH溶液的试剂瓶不能用玻璃塞,原因是(用化学方程式表示)_______ 。
(2)D元素在元素周期表中的位置是___________ 。
(3)H的电子式是_________ 。
(4)F和H反应生成J和I反应的化学方程式是___________ 。
(5)下列说法正确的是(填选项序号)______ 。
a.上述由A生成D的单质的反应属于置换反应
b. D元素在自然界中主要以单质形式存在
c. G是含有极性共价键的离子化合物
d. I是强电解质,G是弱电解质,二者的水溶液都显酸性

(1)除A外,制玻璃的主要原料还有物质(填化学式)
盛放NaOH溶液的试剂瓶不能用玻璃塞,原因是(用化学方程式表示)
(2)D元素在元素周期表中的位置是
(3)H的电子式是
(4)F和H反应生成J和I反应的化学方程式是
(5)下列说法正确的是(填选项序号)
a.上述由A生成D的单质的反应属于置换反应
b. D元素在自然界中主要以单质形式存在
c. G是含有极性共价键的离子化合物
d. I是强电解质,G是弱电解质,二者的水溶液都显酸性
您最近一年使用:0次
7 . 甲、乙、丙三种物质均由短周期元素组成,一定条件下,存在下列转化关系:甲+乙→丙+H20
(1)若丙为Na2C03,反应的化学方程式为______ (任写一个)。
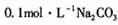 溶液中,所含的离子按物质的量浓度由大到小的顺序排列为
溶液中,所含的离子按物质的量浓度由大到小的顺序排列为______ 。
(2)若甲是石油裂解气的主要成分之一,乙为O2,且甲分子和乙分子具有相同的电子数。25℃、101 kPa时,1g甲完全燃烧生成CO2气体与液态水,放出50.5 kJ的热量,该反应的热化学方程式为_________ ;利用该反应设计的燃料电池中,通入甲的电极为电池的_____ (填“正极”或“负极”)。
(3)若甲、乙是同主族元素的化合物,丙为单质。
①丙所含元素在元素周期表中的位置为_______ ;
②甲与水相比,热稳定性较强的是________ (填化学式)。
(1)若丙为Na2C03,反应的化学方程式为
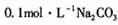 溶液中,所含的离子按物质的量浓度由大到小的顺序排列为
溶液中,所含的离子按物质的量浓度由大到小的顺序排列为(2)若甲是石油裂解气的主要成分之一,乙为O2,且甲分子和乙分子具有相同的电子数。25℃、101 kPa时,1g甲完全燃烧生成CO2气体与液态水,放出50.5 kJ的热量,该反应的热化学方程式为
(3)若甲、乙是同主族元素的化合物,丙为单质。
①丙所含元素在元素周期表中的位置为
②甲与水相比,热稳定性较强的是
您最近一年使用:0次
2016-12-09更新
|
304次组卷
|
3卷引用:2015届福建省普通高中高三4月质量检查理综化学试卷
8 . A~I都是由短周期元素组成的常见物质,它们之间的转化关系如下图所示。已知:A为气体,其水溶液呈碱性;D、F均能与人体血液中的血红蛋白结合而使人中毒;E可作为半导体材料。

(1)化合物A的电子式为__________ 。
氧化物I中化学键类型:___________ 。
组成E单质的元素在元素周期表中的位置是________________ 。
图中物质所含元素原子的半径由大到小依次是(写元素符号)_____________ 。
(2)反应④的化学方程式为_________________________ 。
(3)将F与B按体积比2:1混合生成气体M,常温下测定M相对分子质量时,得到的实验值总是比理论值偏大,其原因是(用化学方程式表示)____________ 。
(4)某容积为V L的试管中充满F气体(标准状况下),若将该气体完全被水吸收,需通入B的物质的量为(写含V的表达式)_________ mol,此时所得溶液中再通入气体A,恰好完全反应后所得溶液中各离子浓度由大到小依次为:______________ 。

(1)化合物A的电子式为
氧化物I中化学键类型:
组成E单质的元素在元素周期表中的位置是
图中物质所含元素原子的半径由大到小依次是(写元素符号)
(2)反应④的化学方程式为
(3)将F与B按体积比2:1混合生成气体M,常温下测定M相对分子质量时,得到的实验值总是比理论值偏大,其原因是(用化学方程式表示)
(4)某容积为V L的试管中充满F气体(标准状况下),若将该气体完全被水吸收,需通入B的物质的量为(写含V的表达式)
您最近一年使用:0次
9 . Ⅰ.A、B、C、D、E、X是中学常见的无机物,存在下图所示转化关系(部分生成物和反应条件略去);已知A由短周期非金属元素组成,B具有漂白性且光照易分解。

(1)若A为单质,且常温下0.1 mol·L-1C溶液的pH为1,请回答以下问题:
①组成单质A的元素在元素周期表中的位置为______ ;
②A与H2O反应的离子反应方程式为__________ .
③X可能为______ (填代号).
a.NaOH b.AlCl3 c.Na2CO3 d.NaAlO2
(2)若A为两种元素形成的化合物,且E与水反应生成G的浓溶液遇C有白烟产生则:
①A的电子式为_________ .
②A与H2O反应的化学反应方程式为___________ .
Ⅱ.某化合物A是一种易溶于水的不含结晶水盐,溶于水后可完全电离出三种中学化学常见离子,其中有两种是10电子的阳离子。用A进行如下实验:取2.370gA溶于蒸馏水配成溶液;向该溶液中逐滴加入一定量的氢氧化钠溶液,过程中先观察到产生白色沉淀B,后产生能使湿润红色石蕊试纸变蓝的气体C,气体不再产生时沉淀开始溶解,当沉淀恰好完全溶解时共用去氢氧化钠的物质的量为0.050mol。回答下列问题:
(1)请画出沉淀B中金属元素的原子结构示意图_________ 。
(2)化合物A的化学式为________ ;
请设计实验方案验证A中阴离子_______ ;
(3)请写出沉淀B溶解在氢氧化钠溶液中的离子方程式_________ .
(4)请写出气体C与氯气发生氧化还原反应的化学方程式_________ .

(1)若A为单质,且常温下0.1 mol·L-1C溶液的pH为1,请回答以下问题:
①组成单质A的元素在元素周期表中的位置为
②A与H2O反应的离子反应方程式为
③X可能为
a.NaOH b.AlCl3 c.Na2CO3 d.NaAlO2
(2)若A为两种元素形成的化合物,且E与水反应生成G的浓溶液遇C有白烟产生则:
①A的电子式为
②A与H2O反应的化学反应方程式为
Ⅱ.某化合物A是一种易溶于水的不含结晶水盐,溶于水后可完全电离出三种中学化学常见离子,其中有两种是10电子的阳离子。用A进行如下实验:取2.370gA溶于蒸馏水配成溶液;向该溶液中逐滴加入一定量的氢氧化钠溶液,过程中先观察到产生白色沉淀B,后产生能使湿润红色石蕊试纸变蓝的气体C,气体不再产生时沉淀开始溶解,当沉淀恰好完全溶解时共用去氢氧化钠的物质的量为0.050mol。回答下列问题:
(1)请画出沉淀B中金属元素的原子结构示意图
(2)化合物A的化学式为
请设计实验方案验证A中阴离子
(3)请写出沉淀B溶解在氢氧化钠溶液中的离子方程式
(4)请写出气体C与氯气发生氧化还原反应的化学方程式
您最近一年使用:0次
10 . X、Y、Z、Q、R是五种短周期元素,原子序数依次增大。X、Y两元素最高正价与最低负价之和均为0;Q与X同主族;Z、R分别是地壳中含量最高的非金属元素和金属元素。请回答下列问题:
(1)Y在元素周期表中的位置为________________。
(2)五种元素原子半径由大到小的顺序是(写元素符号)_________________________。
(3)QX的电子式为___________;QX与水反应放出气体的化学方程式为____________。
(4)X、Z两元素能形成两种化合物的电子式分别为 和 。
(5)由以上某些元素组成的化合物A、B、C、D有如下转化关系:

其中C是溶于水显酸性的气体;D是淡黄色固体。
①写出C的结构式__________________;
②如果A、B均由三种元素组成,B为两性不溶物,由A转化为B的离子方程式_______。
(1)Y在元素周期表中的位置为________________。
(2)五种元素原子半径由大到小的顺序是(写元素符号)_________________________。
(3)QX的电子式为___________;QX与水反应放出气体的化学方程式为____________。
(4)X、Z两元素能形成两种化合物的电子式分别为 和 。
(5)由以上某些元素组成的化合物A、B、C、D有如下转化关系:

其中C是溶于水显酸性的气体;D是淡黄色固体。
①写出C的结构式__________________;
②如果A、B均由三种元素组成,B为两性不溶物,由A转化为B的离子方程式_______。
您最近一年使用:0次



