解题方法
1 . 如图是某化肥厂在一公共场所的围墙上的广告:

请仔细观察、分析,并回答下列问题。
(1)碳酸氢铵(化学式为NH4HCO3)是由___________ 种元素组成的。
(2)碳酸氢铵的氮含量是指氮元素的质量分数。根据所学化学知识,你认为此广告是___________ (填“真实”或“虚假”)广告,判断的依据是___________ 。
(3)碳酸氢铵受潮时在常温下就能分解,温度越高分解越快,因此保存时应注意___________ 。

请仔细观察、分析,并回答下列问题。
(1)碳酸氢铵(化学式为NH4HCO3)是由
(2)碳酸氢铵的氮含量是指氮元素的质量分数。根据所学化学知识,你认为此广告是
(3)碳酸氢铵受潮时在常温下就能分解,温度越高分解越快,因此保存时应注意
您最近一年使用:0次
22-23高二下·全国·课时练习
解题方法
2 . 三聚氰胺最早被李比希于1834年合成,它有毒,不可用于食品加工或食品添加剂。经李比希法分析得知,三聚氰胺分子中,氮元素的含量高达66.67%,氢元素的质量分数为4.76%,其余为碳元素。它的相对分子质量大于100,但小于150。试回答下列问题:
(1)分子中原子个数比N(C)∶N(H)∶N(N)=_______ 。
(2)三聚氰胺的分子式为_______ 。
(3)若核磁共振氢谱显示只有1个吸收峰,红外光谱表征有1个由碳、氮两种元素组成的六元杂环。则三聚氰胺的结构简式为_______ 。
(1)分子中原子个数比N(C)∶N(H)∶N(N)=
(2)三聚氰胺的分子式为
(3)若核磁共振氢谱显示只有1个吸收峰,红外光谱表征有1个由碳、氮两种元素组成的六元杂环。则三聚氰胺的结构简式为
您最近一年使用:0次
名校
解题方法
3 . 黑木耳中含有丰富的人体所必需的铁元素。某研究小组测定黑木耳中铁元素含量,实验方案如下。回答下列问题:
(1)配制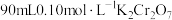 溶液
溶液
①选择仪器:所必需的玻璃仪器除烧杯、胶头滴管外,还有___________ 、___________ 。
②计算,称量:需用天平称量___________ 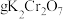 固体(
固体(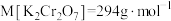 )。
)。
③溶解,恢复到室温、转移、洗涤、定容。
定容的操作是:将蒸馏水注入容量瓶,先___________ ,再改用胶头滴管加水至溶液凹液面最低处与刻度线相切。
④下列操作使结果偏低的是___________ 。
A.定容时,加水超过刻度线,用胶头滴管吸取多余的液体
B.容量瓶未干燥即用来配制溶液
C.定容时,俯视刻度线 D.未用蒸馏水洗涤烧杯和玻璃棒
(2)测定黑木耳中铁元素含量(已知黑木耳提取液中铁元素以Fe2+和Fe3+的形式存在)
①“步骤一”中加入过量铜粉的目的是___________ 。
②请配平步骤②中发生反应的离子反应方程式:___________
6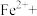 1
1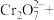 □
□ =□
=□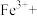 □
□ □
□ 。
。
③实验测得黑木耳中铁元素的质量分数为___________ 。
(1)配制
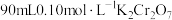 溶液
溶液①选择仪器:所必需的玻璃仪器除烧杯、胶头滴管外,还有
②计算,称量:需用天平称量
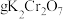 固体(
固体(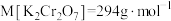 )。
)。③溶解,恢复到室温、转移、洗涤、定容。
定容的操作是:将蒸馏水注入容量瓶,先
④下列操作使结果偏低的是
A.定容时,加水超过刻度线,用胶头滴管吸取多余的液体
B.容量瓶未干燥即用来配制溶液
C.定容时,俯视刻度线 D.未用蒸馏水洗涤烧杯和玻璃棒
(2)测定黑木耳中铁元素含量(已知黑木耳提取液中铁元素以Fe2+和Fe3+的形式存在)
| 步骤一 | 取112g黑木耳,经灼烧、酸浸制得提取液,加入过量的铜粉 |
| 步骤二 | 过滤,向滤液中加入0.10mol/L酸性 溶液10mL时,恰好完全反应 溶液10mL时,恰好完全反应 |
②请配平步骤②中发生反应的离子反应方程式:
6
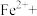 1
1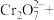 □
□ =□
=□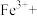 □
□ □
□ 。
。③实验测得黑木耳中铁元素的质量分数为
您最近一年使用:0次
2022-01-19更新
|
462次组卷
|
5卷引用:研究与实践2 检验食品中的铁元素
名校
4 . 液氯储罐中常混有NCl3,当液氯中NCl3的质量分数达到4%以上就有爆炸危险。为测定氯气中的NCl3含量,将一定量样品先通过足量盐酸吸收NCl3(反应为: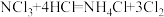 )。再用400mL6.1mol/L的NaOH溶液(
)。再用400mL6.1mol/L的NaOH溶液(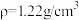 )吸收所有的Cl2,测得吸收后NaOH溶液增重56.8g(不考虑盐酸挥发)。经测定NCl3吸收管内
)吸收所有的Cl2,测得吸收后NaOH溶液增重56.8g(不考虑盐酸挥发)。经测定NCl3吸收管内 质量为0.270g。
质量为0.270g。
(1)计算上述NaOH溶液的质量分数______ 。
(2)计算该样品中NCl3的质量分数,并判断该样品是否安全______ ?
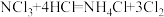 )。再用400mL6.1mol/L的NaOH溶液(
)。再用400mL6.1mol/L的NaOH溶液(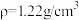 )吸收所有的Cl2,测得吸收后NaOH溶液增重56.8g(不考虑盐酸挥发)。经测定NCl3吸收管内
)吸收所有的Cl2,测得吸收后NaOH溶液增重56.8g(不考虑盐酸挥发)。经测定NCl3吸收管内 质量为0.270g。
质量为0.270g。(1)计算上述NaOH溶液的质量分数
(2)计算该样品中NCl3的质量分数,并判断该样品是否安全
您最近一年使用:0次
2021-11-18更新
|
128次组卷
|
2卷引用:作业(八) 物质的量在化学反应中的应用
名校
5 . Na2O2具有强氧化性,H2具有还原性,某同学根据氧化还原反应的知识推测Na2O2与H2能发生反应。为了验证此推测结果,该同学设计并进行了如图所示实验。
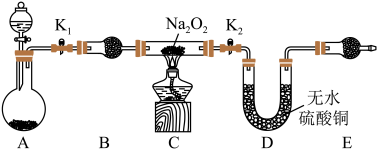
Ⅰ.实验探究
(1)装置A中用粗锌和稀盐酸制取氢气,B装置的作用是______ ,里面所盛放的试剂是______ (①浓硫酸②碱石灰③无水硫酸铜)。
(2)下面是实验过程中的重要操作,正确的顺序是________ (填序号)
A.加热至Na2O2逐渐熔化,反应一段时间 B.用小试管收集气体并检验其纯度
C.打开K1、K2,通入氢气 D.停止加热,充分冷却,关闭K1、K2
(3)实验过程中观察到淡黄色粉末慢慢变成白色固体,无水硫酸铜未变蓝色。由此可推测出Na2O2与H2反应生成的产物为_____ 。
Ⅱ.数据处理
(4)实验结束后,该同学欲测定C装置内白色固体中未反应完的Na2O2含量。其操作流程如图:
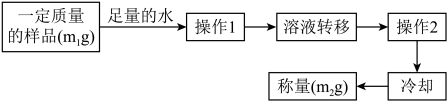
①测定过程中需要的仪器除固定、夹持仪器外,还有天平、烧杯、酒精灯、蒸发皿和____ ,操作2的名称是____ 。
②白色固体中Na2O2的质量分数为_____________ (用含m1和m2的式子表示)。
③在转移溶液时,若溶液转移不完全,则测得的Na2O2质量分数________ (填“偏大”“偏小”或“不变”)。

Ⅰ.实验探究
(1)装置A中用粗锌和稀盐酸制取氢气,B装置的作用是
(2)下面是实验过程中的重要操作,正确的顺序是
A.加热至Na2O2逐渐熔化,反应一段时间 B.用小试管收集气体并检验其纯度
C.打开K1、K2,通入氢气 D.停止加热,充分冷却,关闭K1、K2
(3)实验过程中观察到淡黄色粉末慢慢变成白色固体,无水硫酸铜未变蓝色。由此可推测出Na2O2与H2反应生成的产物为
Ⅱ.数据处理
(4)实验结束后,该同学欲测定C装置内白色固体中未反应完的Na2O2含量。其操作流程如图:

①测定过程中需要的仪器除固定、夹持仪器外,还有天平、烧杯、酒精灯、蒸发皿和
②白色固体中Na2O2的质量分数为
③在转移溶液时,若溶液转移不完全,则测得的Na2O2质量分数
您最近一年使用:0次
2020-11-11更新
|
346次组卷
|
3卷引用:作业(八) 氧化钠和过氧化钠
6 . 由A、B两种烃组成的混合物,当混合物总质量一定时,无论A、B以何种比例混合,完全燃烧消耗氧气的质量为一恒量。对A、B两种烃有下面几种说法:①互为同系物;②互为同分异构体;③具有相同的最简式;④两种烃中碳的质量分数相同。正确的结论是
| A.①②③④ | B.①③④ | C.③④ | D.①②③ |
您最近一年使用:0次
7 . I.在一定条件下,向VL密闭容器中充入amolSO2和bmolO2,发生反应:2SO2(g)+O2(g) 2SO3(g)。
2SO3(g)。
(1)当反应进行到v正与v逆___________ 时,此时可逆反应达到最大限度,若保持外界条件不变时,混合物中各组分的物质的量、浓度、质量分数、体积分数及总压强都___________ 。
II.NO2与SO2混合可发生放热反应:NO2+SO2⇌SO3+NO。在100℃下将1molNO2与1molSO2的混合气体置于绝热(不与外界进行热交换)恒容密闭容器中发生上述反应。
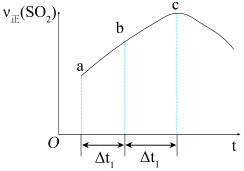
(2)SO2的正反应速率随时间变化的趋势如图所示,则下列说法正确的是_________(填字母,下同)。
(3)判断此反应达到平衡状态的标志是___________ 。
A.体系的压强不再发生变化
B.混合气体的密度不变
C.混合气体的平均相对分子质量不变
D.各组分的物质的量浓度不再改变
E.体系的温度不再发生变化
F.v正(NO2)=v逆(NO)
 2SO3(g)。
2SO3(g)。(1)当反应进行到v正与v逆
II.NO2与SO2混合可发生放热反应:NO2+SO2⇌SO3+NO。在100℃下将1molNO2与1molSO2的混合气体置于绝热(不与外界进行热交换)恒容密闭容器中发生上述反应。
(2)SO2的正反应速率随时间变化的趋势如图所示,则下列说法正确的是_________(填字母,下同)。

| A.反应在c点达到平衡状态 |
| B.反应物浓度:a点小于b点 |
| C.当Δt1=Δt2时,SO2的平均反应速率:ab段小于bc段 |
| D.当Δt1=Δt2时,SO2的消耗量:ab段大于bc段 |
(3)判断此反应达到平衡状态的标志是
A.体系的压强不再发生变化
B.混合气体的密度不变
C.混合气体的平均相对分子质量不变
D.各组分的物质的量浓度不再改变
E.体系的温度不再发生变化
F.v正(NO2)=v逆(NO)
您最近一年使用:0次
解题方法
8 . 实验室需要0.5 mol·L-1硫酸溶液480 mL。回答下列问题:
(1)选取________ mL容量瓶,实验中需要质量分数为98%、密度为1.84 g·cm-3的浓硫酸________ mL,在量取时宜选用规格为________ (填序号)的量筒。
A.10 mL B.20 mL
C.50 mL D.100 mL
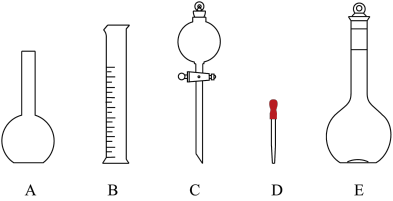
(2)如图所示的仪器中配制溶液肯定不需要的是________ (填序号),配制上述溶液还需用到的玻璃仪器是________ 、________ (填仪器名称)。
(3)在量取浓硫酸后,进行了下列操作:
①等稀释的浓硫酸的温度与室温一致后,将其沿玻璃棒注入容量瓶中。
②往容量瓶中小心加蒸馏水且边加边振荡摇匀,加蒸馏水至液面距容量瓶刻度线1~2 cm时,改用胶头滴管加蒸馏水,使溶液的凹液面与瓶颈的刻度线相切。
③在盛有一定体积的蒸馏水的烧杯中沿杯壁注入浓硫酸,并用玻璃棒搅拌,使其混合均匀。
④用蒸馏水洗涤烧杯和玻璃棒2至3次,并将洗涤液全部注入容量瓶。
上述操作中,正确的顺序是________ (填序号)。
(4)若实验过程中遇到下列情况,对硫酸物质的量浓度有何影响(填“偏高”“偏低”或“无影响”)。
①未经冷却将溶液注入容量瓶中:________ ;
②定容时俯视液面:________ 。
(1)选取
A.10 mL B.20 mL
C.50 mL D.100 mL
(2)如图所示的仪器中配制溶液肯定不需要的是

(3)在量取浓硫酸后,进行了下列操作:
①等稀释的浓硫酸的温度与室温一致后,将其沿玻璃棒注入容量瓶中。
②往容量瓶中小心加蒸馏水且边加边振荡摇匀,加蒸馏水至液面距容量瓶刻度线1~2 cm时,改用胶头滴管加蒸馏水,使溶液的凹液面与瓶颈的刻度线相切。
③在盛有一定体积的蒸馏水的烧杯中沿杯壁注入浓硫酸,并用玻璃棒搅拌,使其混合均匀。
④用蒸馏水洗涤烧杯和玻璃棒2至3次,并将洗涤液全部注入容量瓶。
上述操作中,正确的顺序是
(4)若实验过程中遇到下列情况,对硫酸物质的量浓度有何影响(填“偏高”“偏低”或“无影响”)。
①未经冷却将溶液注入容量瓶中:
②定容时俯视液面:
您最近一年使用:0次
2023-08-26更新
|
603次组卷
|
3卷引用:作业(七) 配制一定物质的量浓度的溶液
名校
9 . 若NA表示阿伏加德罗常数的值,下列说法正确的是
| A.1 mol OH-含有的电子数为9NA |
| B.含0.01 mol FeCl3的饱和溶液滴入沸腾的蒸馏水中,制得的氢氧化铁胶体粒子数为0.01NA |
| C.常温常压下,0.2 mol Na2O2与足量H2O反应,转移电子的数目为0.2NA |
| D.100 g质量分数为98%的浓硫酸中所含氧原子数为4NA |
您最近一年使用:0次
名校
10 . 下列有关碳酸钠和碳酸氢钠的说法错误的是
| A.两者均可溶于水,但碳酸钠的溶解性大于碳酸氢钠 |
B.两者均和稀盐酸反应产生 ,相同条件下,碳酸氢钠和盐酸反应更剧烈 ,相同条件下,碳酸氢钠和盐酸反应更剧烈 |
C.取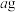  和 和 的混合物充分加热,质量减少 的混合物充分加热,质量减少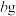 ,可由 ,可由 、 、 求得混合物中 求得混合物中 的质量分数 的质量分数 |
| D.两者均可与澄清石灰水发生反应,但碳酸氢钠与澄清石灰水反应时无明显现象 |
您最近一年使用:0次



