1 . 请回答下列问题:
(1)向煮沸的蒸馏水中逐滴加入饱和氯化铁溶液,制备Fe(OH)3胶体的化学反应方程式:_______ 。
(2)向所得的Fe(OH)3胶体中逐滴加入硫酸溶液至过量,出现的现象:_______ ,原因:_______ 。
(3)欲除去Fe(OH)3胶体中混有的NaCl,操作名称是_______ 。
(4)当光束通过下列物质时,不能观察到丁达尔现象的是
(5)下列实际应用与胶体知识有关的是
(1)向煮沸的蒸馏水中逐滴加入饱和氯化铁溶液,制备Fe(OH)3胶体的化学反应方程式:
(2)向所得的Fe(OH)3胶体中逐滴加入硫酸溶液至过量,出现的现象:
(3)欲除去Fe(OH)3胶体中混有的NaCl,操作名称是
(4)当光束通过下列物质时,不能观察到丁达尔现象的是
| A.淀粉溶液 | B.蔗糖溶液 | C.一定条件下形成的云、雾、烟 | D.Fe(OH)3胶体 |
| A.高压静电除尘 | B.血液透析 | C.明矾净水 | D.用盐卤制豆腐 |
您最近一年使用:0次
名校
2 . 某化学兴趣小组在实验室中以烧杯为容器,用饱和FeCl3溶液制备Fe(OH)3胶体,并对其性质做了如下探究:
【实验制备】
(1)将FeCl3溶液加到沸水中,加热至整个体系呈______________ 色为止,即制得Fe(OH)3胶体。
(2)制备过程中,发生化学反应的方程式为______________ 。
(3)小甲同学在制备时,加热时间过久,结果未能得到胶体。小甲得到的是______________ ,该物质属于______________ (请选择)
A.酸 B.碱 C.盐
【性质探究】
(4)小乙同学想证明Fe(OH)3胶体已经制备成功,他可以利用______________ (最简单的方法)进行鉴别。
(5)小丙同学利用______________ (下图)方法对Fe(OH)3胶体提纯。

(6)小丁同学将提纯后的Fe(OH)3胶体置于U型管中(下图),通入直流电一段时间后,观察到与电源______________ 极附近的颜色变深,说明_____________ 。

【实验制备】
(1)将FeCl3溶液加到沸水中,加热至整个体系呈
(2)制备过程中,发生化学反应的方程式为
(3)小甲同学在制备时,加热时间过久,结果未能得到胶体。小甲得到的是
A.酸 B.碱 C.盐
【性质探究】
(4)小乙同学想证明Fe(OH)3胶体已经制备成功,他可以利用
(5)小丙同学利用

(6)小丁同学将提纯后的Fe(OH)3胶体置于U型管中(下图),通入直流电一段时间后,观察到与电源

您最近一年使用:0次
2022-08-25更新
|
1158次组卷
|
3卷引用:上海音乐学院附属安师实验中学2021-2022学年高一上学期期中考试化学试题
解题方法
3 . 氢氧化铁胶体的制备实验如图所示。取一小烧杯,加入25 mL蒸馏水,加热至沸腾,向沸水中逐滴加入1~2 mL饱和氯化铁溶液,继续煮沸至透明的红褐色液体,停止加热。
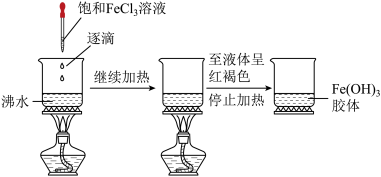
请回答下列问题。
(1)氢氧化铁胶体中分散质微粒直径的范围是_______ 。
(2)写出制备氢氧化铁胶体的化学方程式:_______ 。
(3)证明有氢氧化铁胶体生成的实验操作是_______ 。
(4)除去氢氧化铁胶体中的氯化铁采用的方法是_______ (填写字母)。
a.过滤 b.渗析 c.蒸发
(5)下列关于Fe(OH)3胶体的制备和性质的叙述中,正确的是_______ (填写字母)。
a.Fe(OH)3胶体与FeCl3溶液、Fe(OH)3沉淀的本质区别是:Fe(OH)3胶体具有丁达尔效应
b.可用饱和FeCl3溶液与浓NaOH溶液反应制备氢氧化铁胶体
c.Fe(OH)3胶体属于纯净物,而FeCl3溶液属于混合物
d.本题实验中,若向沸水中加入的饱和氯化铁溶液中含有1mol FeCl3,得不到NA个Fe(OH)3胶体微粒

请回答下列问题。
(1)氢氧化铁胶体中分散质微粒直径的范围是
(2)写出制备氢氧化铁胶体的化学方程式:
(3)证明有氢氧化铁胶体生成的实验操作是
(4)除去氢氧化铁胶体中的氯化铁采用的方法是
a.过滤 b.渗析 c.蒸发
(5)下列关于Fe(OH)3胶体的制备和性质的叙述中,正确的是
a.Fe(OH)3胶体与FeCl3溶液、Fe(OH)3沉淀的本质区别是:Fe(OH)3胶体具有丁达尔效应
b.可用饱和FeCl3溶液与浓NaOH溶液反应制备氢氧化铁胶体
c.Fe(OH)3胶体属于纯净物,而FeCl3溶液属于混合物
d.本题实验中,若向沸水中加入的饱和氯化铁溶液中含有1mol FeCl3,得不到NA个Fe(OH)3胶体微粒
您最近一年使用:0次
名校
4 . 下列实验设计可以达到实验目的的是
| 选项 | 实验目的 | 实验设计 |
| A | 证明金属活动性: | 将金属钠投入 溶液中 溶液中 |
| B | 检验待测液中含有 | 用玻璃棒蘸取待测液在无色火焰上灼烧,观察现象 |
| C | 制备 胶体 胶体 | 将5~6滴饱和 溶液滴加到煮沸的蒸馏水中,继续煮沸至液体呈红褐色为止 溶液滴加到煮沸的蒸馏水中,继续煮沸至液体呈红褐色为止 |
| D | 探究钠在空气中燃烧产物为 | 将燃烧后的物质置于水中,滴入无色酚酞溶液,一段时间后,溶液为红色 |
| A.A | B.B | C.C | D.D |
您最近一年使用:0次
2023-08-20更新
|
450次组卷
|
4卷引用:江西省赣州教育发展联盟2022-2023学年高一上学期12月月考化学试题
5 . 化学实验操作有严格的规范,下列实验操作描述错误的是
| A.实验剩余的钠块可以放回原瓶 |
| B.进行焰色试验前,将铂丝用硫酸清洗 |
| C.向试管中滴加试剂时,滴管下端不能接触试管内壁 |
| D.制备氢氧化铁胶体实验时,不宜用玻璃棒搅拌,也不宜使液体沸腾时间过长 |
您最近一年使用:0次
2023-10-17更新
|
385次组卷
|
5卷引用:湖北省重点高中智学联盟2023-2024学年高一上学期10月联考化学试题
名校
解题方法
6 . 下列有关胶体的相关叙述正确的是
| A.水泥厂、冶金厂常用静电降尘法除去工厂烟尘,减少对空气污染 |
| B.PM2.5是对空气中直径小于或等于2.5μm(2.5×10-6m)固体颗粒或液滴的总称,其分散在空气中一定形成气溶胶 |
| C.将蒸馏水加热至沸腾逐滴加入饱和氯化铁溶液后继续长时间煮沸即可得到氢氧化铁胶体 |
| D.将几滴汽油加入装有10mL水的试管中,用力振荡可以形成胶体, 其与溶液的本质区别是有没有丁达尔效应 |
您最近一年使用:0次
2022-08-30更新
|
405次组卷
|
3卷引用:宁夏回族自治区银川一中2022-2023学年高三上学期第一次月考理科综合化学试题
7 . 定性和定量是中学化学研究物质性质、组成的常用方法。胶体是一种重要的分散系(三种分散系分散质粒子大小如图示)。
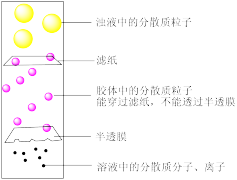
某兴趣小组按如下实验步骤制备Cu(OH)2胶体:用洁净的烧杯取少量蒸馏水,加热至沸腾,向烧杯中慢慢加入数滴浓CuCl2溶液,得到蓝色透明的液体。制备原理用化学方程式表示为:CuCl2+2H2O(沸水)=Cu(OH)2(胶体)+2HCl。
(1)Cu(OH)2胶体中分散质微粒直径范围是_____ 。
(2)Cu(OH)2浊液与Cu(OH)2胶体性质不同,本质原因是_____ 。
(3)下列哪种用于判断胶体制备成功的方法最简单_____ 。
(4)实验过程中,有一位同学向烧杯中一次性加入大量CuCl2溶液,结果没有制得胶体,反而出现了浑浊,请分析他实验失败的原因_____ 。

某兴趣小组按如下实验步骤制备Cu(OH)2胶体:用洁净的烧杯取少量蒸馏水,加热至沸腾,向烧杯中慢慢加入数滴浓CuCl2溶液,得到蓝色透明的液体。制备原理用化学方程式表示为:CuCl2+2H2O(沸水)=Cu(OH)2(胶体)+2HCl。
(1)Cu(OH)2胶体中分散质微粒直径范围是
| A.小于1nm | B.1~10nm | C.1~100 | D.大于100nm |
| A.分散剂的种类不同 | B.颜色和透明程度不同 |
| C.分散质粒子的大小不同 | D.分散质粒子所带电荷不同 |
| A.丁达尔现象 | B.半透膜实验 | C.聚沉 | D.电泳 |
您最近一年使用:0次
2023-01-10更新
|
378次组卷
|
2卷引用:上海市闵行区2022-2023学年高一上学期期末统考化学试题
名校
解题方法
8 . 下列关于胶体的叙述正确的是
A. 胶体的制备:将饱和 胶体的制备:将饱和 溶液逐滴加到沸水中,边加边搅拌至液体呈红褐色 溶液逐滴加到沸水中,边加边搅拌至液体呈红褐色 |
| B.溶液与胶体不同的本质原因是能否发生丁达尔效应 |
| C.用渗析的方法可以除去蛋白质溶液中的NaCl |
| D.在豆浆里加入盐卤做豆腐的原理是利用了胶体带电,加入电解质使胶体聚沉 |
您最近一年使用:0次
2023-08-26更新
|
357次组卷
|
3卷引用:云南省昆明市三校2023-2024学年高三上学期第二次联考化学试题
名校
9 . 研究小组以铁丝和Cl2为原料制备Fe(OH)3胶体进行下列三个实验。下列相关分析不正确的是


| A.实验①现象是出现红棕色的雾,容器中的水可防止集气瓶炸裂 |
| B.实验②中玻璃棒的作用是搅拌加速溶解 |
| C.②中的分散质1mol,可制备NA个③中的目标分散质 |
| D.取少量③中液体,逐滴滴入5mol/L硫酸,观察到先有红褐色沉淀又逐渐溶解 |
您最近一年使用:0次
2022-10-26更新
|
384次组卷
|
3卷引用:山东省青岛第二中学2021-2022学年高一上学期期中考试化学试题
名校
解题方法
10 . 胶体与溶液。化学的研究对象是物质,化学家常根据需要将众多物质进行分类,从而更好地探索各类物质的性质及其相互转化的规律。根据分散质粒子的大小,可将分散系分为溶液、胶体、浊液等。
(1)胶体分散系中的分散质粒子大小为_____。
(2)胶体和溶液在外观上并无太大差异。区分胶体和溶液可行的方法是_____。
(3)向沸腾的蒸馏水中逐滴加入1~2mL饱和 溶液,继续煮沸至液体呈红褐色,停止加热,可得到氢氧化铁胶体。写出上述制备氢氧化铁胶体的方程式
溶液,继续煮沸至液体呈红褐色,停止加热,可得到氢氧化铁胶体。写出上述制备氢氧化铁胶体的方程式___________ 。
(4)含21.4g 粒子的胶体分散系中,含有
粒子的胶体分散系中,含有___________ 个Fe原子。
(5)欲使上述分散系中 完全反应,至少需要2mol/L的稀硫酸
完全反应,至少需要2mol/L的稀硫酸___________ mL。向氢氧化铁胶体中滴加硫酸,反应的现象为___________ 。
(6)配制500mL 2mo/L的硫酸,用到的玻璃仪器除了烧杯、量筒、玻璃棒外,还需要__________ 、_________ 。
(7)物质的检验在生产、生活和科学研究中占有举足轻重的地位。检验上述反应后溶液中的 的方法为:
的方法为:___________ 。
(1)胶体分散系中的分散质粒子大小为_____。
| A.<1nm | B.1-100nm | C.>100nm | D.1~1000nm |
| A.观察分散质粒子的直径 | B.观察分散系是否均匀 |
| C.观察分散系是否能发生丁达尔现象 | D.观察分散质粒子是否能透过滤纸 |
 溶液,继续煮沸至液体呈红褐色,停止加热,可得到氢氧化铁胶体。写出上述制备氢氧化铁胶体的方程式
溶液,继续煮沸至液体呈红褐色,停止加热,可得到氢氧化铁胶体。写出上述制备氢氧化铁胶体的方程式(4)含21.4g
 粒子的胶体分散系中,含有
粒子的胶体分散系中,含有(5)欲使上述分散系中
 完全反应,至少需要2mol/L的稀硫酸
完全反应,至少需要2mol/L的稀硫酸(6)配制500mL 2mo/L的硫酸,用到的玻璃仪器除了烧杯、量筒、玻璃棒外,还需要
(7)物质的检验在生产、生活和科学研究中占有举足轻重的地位。检验上述反应后溶液中的
 的方法为:
的方法为:
您最近一年使用:0次



